Бактерии фаги
Бактериофаги представляют собой вирусы, избирательно поражающие бактериальные клетки. Их жизнедеятельность и репродукция возможна только внутри бактериальных клеток. Размножаясь внутри клетки, они вызывают разрушение и гибель самой бактерии.
Современная медицина рассматривает их как эффективное, безопасное и совершенное средство в борьбе с опасными, трудно поддающимися терапии бактериальными инфекциями. Но лечение бактериофагами у многих людей вызывает недоверие и страх.
Особенности строения и паразитирования бактериофагов
Бактериофаги представляют большую и разнообразную группу вирусов. Их размеры в сто раз меньше размеров бактериальных клеток. При многократном увеличении структура фагов поражает своим разнообразием, некоторые из них похожи на кристаллические комплексы, причудливо извитые между собой.
Являясь внутриклеточными вирусными паразитами, они избирательно уничтожают определенные бактериальные клетки. Они лишены клеточного строения и состоят только из генетического материала, покрытого наружной белковой оболочкой. Это вынуждает их искать подходящие клеточные комплексы, чтобы активно размножаться внутри них.
Среда обитания бактериофагов

Бактериофаги присутствуют везде, где живут бактерии, поэтому среда их обитания разнообразна. Это может быть организм человека, воздушная и водная среда, почва, пищевые продукты, одежда и т.д.
Механизм действия
Бактериофаг внедряется в бактериальную клетку лишь с одной целью – использовать ее клеточные структуры для собственного размножения. Для этого умный вирус впрыскивает в тело бактерии собственную генетическую информацию. Бактерия же начинает по установленной фагом программе синтезировать нехарактерные для нее частицы, из которых впоследствии осуществляется сборка новых бактериофагов. От бактериальной клетки остаются одни обломки, через которые выходит 100-200 синтезированных фагов, способных к дальнейшему поражению соседних бактериальных клеток.
В естественной среде бактериофаги играют важнейшую роль природных регуляторов количества патогенных микробов.
Сферы применения бактериофагов
Помимо медицинской отрасли, они нашли свое применение и в других важных направлениях.
- В сельском хозяйстве — успешно применяются для предупреждения и лечения растений и животных от бактериальных инфекций.
- В генной инженерии — эти маленькие вирусные структуры используются для естественного обмена генами между различными бактериями, что позволяет изменять первоначальную структуру бактериальной ДНК в нужном направлении.
Лечение бактериофагами
Это эффективная альтернатива антибиотикам.
Выращивают бактериофаги следующим образом. На питательную среду, засеянную определенной культурой чувствительных бактерий, наносят материал, содержащий бактериофаги. В том месте, куда они попали, формируется зона разрушенных бактерий в виде пустого пятна. При помощи бактериологической иглы данный материал забирается и переносится в суспензию, содержащую молодую бактериальную культуру. Такую манипуляцию выполняют 5-10 раз, чтобы выращенная культура бактериофага была чистой.
Препараты на основе бактериофагов выпускаются в виде аэрозолей, свечей, таблеток, растворов и других лекарственных форм. В названии таких лекарственных средств используют ту группу бактерий, против которых они направлены. Наиболее известные бактериофаги: псевдомонадные, стафилококковые, калийные, стрептококковые и дизентерийные фаги.
Производство бактериофагов в ближайшем будущем станет самой перспективной отраслью фармакологии.
Преимущества бактериофагов перед антибиотиками:
- Не угнетают иммунитет человека;
- Сочетаются абсолютно со всеми лекарственными препаратами, даже с антибиотиками, усиливая их действие;
- Не вызывают привыкания;
- Не приводят к выработке устойчивости бактериальных культур к фагам;
- Помогают в лечении вялотекущих бактериальных инфекций, малочувствительных к антибиотикам;
- Действуют избирательно, не уничтожая полезную бактериальную флору;
- Не имеют противопоказаний к лечению.
Их используют в лечении различных инфекций бактериальной природы. Поскольку размножение фагов происходит исключительно в бактериях, никакого вреда здоровью они не приносят. Бактериофаги действуют избирательно, поражая бактерии определенной группы. Наиболее широко используется стафилококковый бактериофаг, эффективный в лечении хронических стафилококковых инфекций и бактерионосительства.
Список препаратов бактериофагов
- Сальмонеллезный для приема внутрь 100мл — 650-800 руб
- Коли бактериофаг 20мл. 4 шт. 400-800 руб, колипротейный для приема внутрь 100мл — 650-800 руб.
- Стрептококковый для приема внутрь, местного и наружного применения 20 мл. 4 шт. — 750-800 руб.
- Клебсиелл поливалентный для приема внутрь 20 мл. 4 шт — 750-800 руб.
- Клебсифаг (клебселл пневмонии) 20мл. 4 шт. 500 руб.
- Дизентерийный поливалентный 80мг. 500 табл. 3400 руб, 20мл. 4 шт -400 руб.
- Протейный бактериофаг 20мл. 4 шт. 500-600 руб.
- Синегнойный бактериофаг/псевдомонас 100мл. и 20мл. 4шт. — 650-700 руб.
Комплексные бактериофаги:
- ИНТЕСТИ комплексный бактериофаг 20мл. 4 шт. и 100мл. для приема внутрь — 800 руб.
- Пиобактериофаг 100 мл. — 800 руб.
- Пиобактериофаг поливалентный очищенный 20мл. 4 шт. — 800 руб.
- Секстафаг Пиобактериофаг поливалентный 20мл. 4 шт. — 750 руб.
Источник: zdravotvet.ru
Боевые «машины»
Бактериофаги, эти настоящие природные боевые машины, устроены крайне просто: их генетический материал, ДНК или РНК, упакован в белковую оболочку, снабженную «орудиями» – специальными устройствами для нападения на бактерии.

Размер генома у разных фагов может различаться. У некоторых он очень мал – (от 3,5 тыс. пар нуклеотидов), в таком геноме хранится информация всего лишь о 3—4 белках. Более того, гены, кодирующие эти белки, вынуждены перекрываться (накладываться друг на друга). Размер геномов у других фагов сопоставим с размером геномов крупных, сложно организованных вирусов многоклеточных животных, достигая 170 тыс. пар нуклеотидов (самый крупный из известных фагов содержит около 480 тыс. пар оснований!). Такой геном может кодировать уже до двухсот различных белков. Именно такие фаги обычно имеют большие размеры и сложно организованы.
ЧУДЕСА БАКТЕРИОФАГОВ
Лизирующий фаг своим видом больше всего напоминает космический корабль-робот, способный стыковаться с заданным объектом. К головке фага, представляющей собой белковый резервуар с упакованной в ней ДНК, присоединен «хвост» − белковая структура наподобие щупалец, на которых расположены так называемые узнающие элементы, способные прочно связываться с рецепторами (особыми белками или полисахаридами) на поверхности бактерии.
После такой «стыковки» с бактерией-мишенью фаг прочно прилипает к ее поверхности. На одну бактериальную клетку могут одновременно напасть сотни бактериофагов, но чтобы убить ее, достаточно и одного. При этом взаимодействие фаг-клетка очень специфично: конкретный фаг может взаимодействовать лишь с определенными (целевыми) видами бактерий и не способен присоединяться к клеткам человека.

Когда фаг закрепится на поверхности бактерии, его «хвост» с помощью специальных белков внедряется в бактериальную стенку, протыкая ее. Сквозь хвостовой канал генетический материал фага вбрасывается в клетку. Генетические программы фага берут под контроль все жизнеобеспечение клетки: с этого момента все ее материальные и энергетические ресурсы, все молекулярные «машины» переключаются на синтез белков и копий генома фага.
Бактерия обречена. В течение следующего получаса в клетке синтезируются сотни и тысячи новых фаговых частиц, после чего она разрушается, высвобождая очередной отряд бактериальных «убийц».
Гонка вооружений
По оценке специалистов, каждые двое суток бактериофаги уничтожают половину мировой популяции бактерий. Вот почему эти быстро размножающиеся организмы не покрыли толстым слоем всю поверхность нашей планеты – в отсутствии фагов они сделали бы это за несколько дней.
Но несмотря на такую высочайшую антибактериальную эффективность фагов, бактерии все же не исчезли с лица планеты. Дело в том, что в течение многих миллионов лет шла совместная эволюция этих организмов, которую было бы точнее назвать «гонкой вооружений». Благодаря мутациям фаги «изобретали» все новые средства и приемы ведения войны, а бактерии, в свою очередь, хитроумные средства защиты.
Например, ДНК всех бактерий несет на себе особые метки (метилированные основания), и специальные бактериальные ферменты рестрикции расщепляют любую ДНК, на которой таких меток нет, в том числе и фаговую. Однако некоторые фаги научились имитировать такие метки и таким способом обходить защиту.

Еще один защитный механизм бактерий – изменение поверхностных рецепторов: в этом случае фаг просто не может узнать «свою» бактерию. В ответ на это появляются фаги, несущие измененные узнающие элементы, которые способны связываться с новыми бактериальными рецепторами. Имеется несколько механизмов подобной модификации генетических программ у фагов и бактерий. Мутации могут возникать случайно, в ходе генетического копирования. Кроме того, с помощью рекомбинации (генетического перераспределения) разные виды фагов могут обмениваться фрагментами своего генома и даже захватывать фрагменты генома бактерий.
К слову сказать, с точки зрения медицины, изменение рецепторов болезнетворной бактерии может быть благом для человека, поскольку именно бактериальные рецепторы служат факторами вирулентности, определяющими выживание и размножение возбудителя в организме-хозяине. И устойчивые к фагу мутанты обычно являются менее патогенными по сравнению со своими предшественниками.
Фаготерапия: сквозь тернии
Открытие вирусов, убивающих бактерии, дало начало новому способу контроля за численностью бактерий. Самое очевидное приложение – фаготерапия, применение бактериофагов для лечения бактериальных инфекций человека. Ее преимуществом является крайняя специфичность фагов, поражающих только «избранные» болезнетворные агенты.
В медицинских целях бактериофаги были впервые применены в 1915 г., когда один из их первооткрывателей, Ф. д’Эрель, использовал такой препарат для лечения дизентерии у детей. Однако дальнейшая история развития фаговой терапии была непростой. Дело в том, что предложения д’Эреля намного опередили свое время, и долгие годы ему пришлось бороться за признание своего открытия. В том числе со знаменитыми французскими коллегами, которые не признавали точку зрения д’Эреля на природу этих бактерицидных агентов, считая их ферментами. Истина восторжествовала лишь в 1940-х гг., но задолго до этого, устав от борьбы, д’Эрель уехал работать в США.
В 1934 г. он приехал в Грузию, в Тбилиси, где к тому времени сложились уникальные возможности для развития фаговой терапии. Еще с 1918 г. там существовала лаборатория (впоследствии − институт) микробиологии, руководитель которой, Г. Элиава, был командирован в знаменитый Институт Пастера для освоения методик и приобретения оборудования. Именно там он и познакомился с д’Эрелем и его удивительным открытием.
Так у Элиавы родилась мечта создать в Тбилиси мировой центр исследования бактериофагов. Эта идея заинтересовала И. В. Сталина, и в 1930 г. было построено и оснащено здание будущего Института бактериофагов, микробиологии и вирусологии, который сейчас носит имя его основателя. Однако далее события развивались по сценарию, характерному для СССР тех лет: в 1937 г. Элиава вместе с женой был арестован и расстрелян как «враг народа», а д’Эрель вернулся в Париж. Однако сам институт не погиб и продолжал успешно функционировать.
С начала 1940-х гг. фаговая терапия начала применяться в странах Европы и США. Такие препараты получили миллионы пациентов, однако результаты лечения оказались противоречивы и невоспроизводимы. Реклама обещала чудеса, но их не было – сама идея фаготерапии была скомпрометирована. Причина заключалась в том, что в то время не только производители препаратов, но и сами ученые не располагали необходимыми знаниями о свойствах фагов и о механизме их действия, да к тому же не имелось и надежных технологий работы с вирусами.
Неудачи следовали за неудачами, поэтому неудивительно, что аптекари и врачи вздохнули с облегчением с появлением антибиотиков. Эти относительно дешевые, с широким спектром антибактериальной активности, хорошо хранящиеся химические вещества, казалось, радикально решили проблему лечения инфекционных заболеваний. Бактериофаги на Западе были забыты на много лет. Основанная д’Эрелем французская компания по выпуску коммерческих фаговых препаратов переключилась на другие проекты (на ее основе выросла знаменитая косметическая компания L’Oreal).
Исследования фагов продолжались только в СССР, Польше и Чехословакии. Самым большим производителем фаговых препаратов был грузинский институт, созданный Элиавой: к 1980-х гг. там работало около 1200 человек, а препараты рассылались для испытаний в клиниках по всему СССР. Производство бактериофагов было организовано также в Уфе и Горьком.
Кстати сказать, в прекращении работ с бактериофагами за рубежом, помимо успеха антибиотиков, большую роль сыграл и политический аспект. Ведь фаговая терапия развивалась в СССР, и западным ученым было политически «неправильным» работать по тематике, связанной с именем Сталина. К тому же это были времена лысенковщины, когда западная наука воспринимала со скептицизмом все, что делалось советскими биологами.
Коктейли из фагов
Новый виток интереса к фаговой терапии пришелся на последние годы. Дело в том, что антибиотики тоже не стали панацеей при лечении бактериальных инфекций: в наши дни разработка новых препаратов не поспевает за ростом числа бактерий с приобретенной устойчивостью к существующим антибиотикам. Уже сегодня в госпиталях Англии около 40 % стафилококковых инфекций вызвано такими штаммами, а в США от госпитальных инфекций, вызванных лекарственно устойчивыми бактериями, ежегодно умирает около 90 тыс. пациентов. При пересчете на население Земли это число составляет 3—5 млн смертей в год!
ВОЗ предупреждает, что мир вскоре вступит в «постантибиотиковую» эру, когда лечить обычные бактериальные инфекции будет нечем. И на этом фоне фаготерапия выглядит весьма перспективным направлением, развитие которого может привести к созданию эффективных персонализированных методов лечения заболеваний. Для этого есть как необходимые знания о фагах и механизмах их взаимодействия с бактериальными клетками, так и технологии работы с вирусными агентами.
Для фаговой терапии сегодня используют только вирулентные лизирующие фаги, в основном «хвостатые» фаги порядка Caudovirales, а также нитчатые фаги семейств Leviviridae (с одноцепочечным РНК-геномом) и Inoviridae (с одноцепочечным кольцевым ДНК-геномом).
Как говорилось выше, спектры активности фагов обычно очень узки и ограничены одним или несколькими близкородственными видами бактерий. С одной стороны, такая узкая специфичность хороша для терапии, поскольку позволяет устранить конкретный микроорганизм, не нарушая всего бактериального сообщества человеческого организма. С другой стороны, при необходимости экстренного лечения (когда нет времени для выявления конкретной бактерии, вызывающей развитие болезнетворного процесса в ране или на обожженной поверхности) необходимо иметь препарат, поражающий сразу несколько видов бактерий, возможных возбудителей инфекции. Для решения этой проблемы обычно используют коктейли фагов – препараты, содержащие несколько фагов, отличающихся по специфичности.
Такой подход использовал еще д’Эрель. Коктейль д’Эреля, привезенный им из Парижа еще в 1930 г., до сих пор является одним из основных фаговых препаратов: он лежит в основе грузинского пиофага и российского интестифага. В Тбилиси на основе фаговых коктейлей разрабатывались препараты для лечения желудочно-кишечных заболеваний и гнойных ран для массового применения в случае возникновения эпидемий или военных действий. Результаты армейских испытаний и широкого эксперимента по предотвращению детских желудочно-кишечных расстройств, проведенного в Тбилиси, показали хорошую эффективность таких препаратов.
Фаговые коктейли производятся стандартными, и ориентированы они на сообщества бактерий, часто встречающиеся при конкретных заболеваниях. Конечно, более эффективные коктейли получаются в том случае, когда их компоненты подбирают к бактериальному сообществу конкретного пациента. Для получения такого коктейля необходимо протестировать бактерии пациента на чувствительность к фагам из коллекции, чтобы подобрать наиболее эффективные фаговые штаммы. Если нужных фагов в коллекции не окажется, специфичные для бактерий фаги ищут в природных субстратах.
Вообще поиск бактериофагов довольно прост: на бактериальную культуру воздействуют образцами из различных источников: водоемов, почвы, канализационных стоков и т. п. Если бактерии погибают, их отделяют от раствора центрифугированием, а оставшийся раствор тестируют на активность. Затем фаг размножают, выращивая на соответствующей бактериальной культуре. Более того, фаги можно лиофилизировать (высушить в вакууме) и непосредственно использовать в капсулах. В таком виде препарат сохраняют стабильность в течение 14 месяцев при температуре до 55 °С.
Современная история
К настоящему времени самый большой опыт фаготерапии имеют специалисты из Тбилиси и специализированного центра Института иммунологии и экспериментальной терапии им. Л. Хиршфельда (Вроцлав, Польша), где в небольших количествах производятся препараты бактериофагов для испытаний.
Польские исследователи изначально делали акцент на персонализированную терапию. Они использовали фаготерапию для экспериментального лечения пациентов с хроническими заболеваниями, которым не помогают антибиотики. Через центр прошли уже тысячи пациентов, многие из которых были полностью излечены.

Результаты этих клинических испытаний доказали высокую эффективность фагов при лечении инфекционных легочных заболеваний: для подавления инфекции в горле, носу и в легких достаточно однократного интраназального введения препарата. Не менее эффективно фаги элиминируют патогенные бактерии из желудочно-кишечного тракта. Высокая эффективность бактериофагов была также продемонстрирована практически во всех случаях гноеродной язвы диабетической стопы, заболеваний легких, мастита, урогенитальных инфекциях. Список таких заболеваний можно продолжить, при этом важно отметить, что ни в одном из испытаний не наблюдалось каких-либо побочных эффектов, вызванных бактериофагами.
В Англии фаговые препараты были успешно испытаны для лечения хронического отита, трудно излечимого заболевания вследствие образования так называемых бактериальных биофильмов – лекарственно-устойчивых микробных пленок. Во Франции –колыбели фаговой терапии – исследования в этой области сейчас почти не ведутся, хотя до последнего времени Институт Пастера делал фаговые коктейли на заказ.
В промышленных масштабах фаговые препараты сегодня производит российская компания Микроген. Подобные лекарства можно купить в аптеках в России, Белоруссии и на Украине. Фаговые препараты производства Микроген и Тбилисского центра для лечения ожоговых инфекций были успешно испытаны и в Бельгии.
Тем не менее до сих пор в большинстве стран применение бактериофагов в терапии официально не разрешено: это касается как FDA, американского Управления по контролю качества пищевых продуктов и лекарственных препаратов, так и аналогичных европейских агентств. На территории Евросоюза фаги для лечения больных используют только в вышеупомянутом польском Институте иммунологии и экспериментальной терапии.
Поэтому лечение заинтересованных больных проводится в режиме медицинского туризма. Компания «Phage international» (Калифорния, США) направляет пациентов из разных стран, страдающих от хронических заболеваний, вызванных лекарственно устойчивыми бактериями, либо в Центр фаговой терапии в Тбилиси, либо в свою клинику в Мексике.
Выбираем фаги
Почему же фаговая терапия до сих пор не нашла широкого применения? Ведь очевидно, что антибиотики должны быть препаратом выбора при остром, угрожающем жизни заболевании, когда нет времени для подбора специфичного агента. Зато при хронических инфекциях предпочтение следует отдать бактериофагам, как более дружественным агентам.
Среди причин, сдерживающих применения фагов в медицине, в первую очередь следует отметить скептическое отношение многих специалистов, особенно зарубежных. По сложившейся недоброй традиции западные исследователи, несмотря на свое отставание в этой области, до сих пор выражают недоверие к результатам исследований, в свое время успешно проводимых в СССР.
Но есть и более весомые причины, связанные с тем, что в бактериофагах не заинтересованы большие фармацевтические компании. Им нужны исключительные права на изобретения, но фаги – природные агенты, поэтому запатентовать их не так просто, а сама идея фаговой терапии опубликована давно. Кроме того, эти компании вложили огромные средства в производство антибиотиков, поэтому им не нужна конкуренция с дешевыми фаговыми препаратами.
Что касается самих врачей, то они стандартно обучены применять для достижения максимального эффекта антибиотики широкого спектра действия. При фаговой же терапии нужно иметь большой арсенал препаратов, каждый из которых нужно тестировать и подбирать индивидуально для каждого больного. Это в конечном счете приводит к значительному удорожанию такого персонализированного лечения. К тому же хотя люди продолжают умирать от заражения лекарственно устойчивыми бактериями, однако с экономической точки зрения, этот рынок не слишком велик, а лече-ние таких тяжелых больных чревато юридическими проблемами.
Вместе с тем та же FDA сегодня признает, что благодаря своей высокоспецифичности и нетоксичности фаги помогают там, где альтернативные методы оказываются неэффективными. Поэтому FDA планирует выработать практические рекомендации по использованию литических фагов в терапии. Для этого необходимо секвенировать их геномы, определить безопасные условия культивирования, провести современное стандартное тестирование токсичности на животных. В случае использования фаговых коктейлей каждый их компонент должен быть охарактеризован. И, наконец, для доказательства эффективности этих препаратов необходимы контролируемые клинические испытания.

Кстати сказать, применение фагов в медицине может оказаться шире, чем это сегодня представляется. Так, современные технологии позволяют создавать фаги, производящие антибактериальные токсины, которые фаги будут доставлять непосредственно в бактериальную клетку. С помощью генетической инженерии сегодня можно заниматься настоящим дизайном фагов, например, получить фаги с измененной и расширенной специфичностью. Совершенно реалистичной задачей является и полный синтез фаговых геномов.
АНТИБИОТИКИ Достоинства:
широкий спектр действия;
простота патентования
Недостатки:
разрушают собственную микрофлору организма,
что создает угрозу вторичных инфекций;
не способны концентрироваться в области
инфекционного поражения;
вызывают побочные эффекты: аллергии, кишечные
расстройства и т. д.;
приводят к возникновению бактериальных штаммов с лекарственной устойчивостью;
создание новых антибиотиков – длительный
и дорогостоящий процесс БАКТЕРИОФАГИ Достоинства:
специфичность действия, для любой бактерии можно найти убивающий ее бактериофаг;
поиск нового фага занимает несколько дней или недель;
производство недорогое и экологически чистое;
не вызывают дисбактериоза;
не токсичны и не вызывают побочных эффектов;
после уничтожения патогенного агента элиминируются из организма
Недостатки:
слишком высокая избирательность – для гарантии
успеха лечения нужно идентифицировать патоген;
патентование затруднено из-за многообразия агентов
Уже испытываются в качестве противобактериальных средств отдельные компоненты фагов и вещества, используемые ими для поражения бактерий. Например, бактериоцины, фрагменты хвостовой структуры фагов, которые повреждают клеточную стенку бактерий, образуя в ней поры, что приводит к быстрой потере важных для клетки ионов и ее гибели.
Также разрабатываются подходы к применению фагов в качестве носителей лекарств – антител или химических терапевтических препаратов. На одну фаговую частицу можно присоединить до тысячи молекул антител и до нескольких тысяч молекул антибиотика. А благодаря присоединению к поверхности бактериофагов молекул полиэтиленгликоля удается получать фаги, способные долгое время циркулировать в кровотоке. Кроме того, фаги, несущие на поверхности определенные пептидные антигены, можно использовать в качестве вакцин.
Очевидно, что в XXI в. стимуляция дальнейшего развития фаготерапии должна стать делом государственным. Необходимо создать все условия для создания и поддержания коллекции фагов против устойчивых к антибиотикам патогенов. Что касается всевозможных разрешительных документов, то есть простое решение проблемы: рассматривать фаговые препараты наравне с вакцинами от гриппа. Ведь каждый год готовятся живые противогриппозные вакцины, представляющие собой коктейли нескольких вирусных штаммов, при этом их состав постоянно меняется. И разрешение распространяется на все эти вирусные коктейли, – а чем хуже фаги?
В России сегодня сложилась уникальная ситуация: фаговая терапия у нас разрешена, производится широкий ассортимент «индивидуальных» фаговых препаратов и фаговых коктейлей. Почему же их так редко применяют? Главным образом по причине уже упоминавшейся необходимости персонализированного подхода при фаготерапии. Ведь стандартные фаговые препараты не гарантируют результата, а если препарат не срабатывает, то это не только разочаровывает лечащего врача, но и в случае острого заболевания создает рискованную ситуацию для пациента.
Выход в данной ситуации очевиден: нужно обязательно тестировать бактерии пациента на восприимчивость к фаговому препарату. Это можно делать лишь в хорошо оборудованных центрах, располагающих коллекциями фагов и лабораториями для микробиологического тестирования. Если сеть таких центров будет создаваться в рамках планируемого развития персонализированной медицины, то у нашей страны будут все шансы попасть в лидеры этого важнейшего биомедицинского направления.
Литература
Козлова Ю. Н., Репин В. Е., Анищенко и др. Штамм бактериофага Pseudomonas aeruginosa, используемый в качестве основы для приготовления асептического средства против синегнойной палочки // Патент RU 2455355 C1. 2011.
Тикунова Н. В., Морозова В. В. Фаговый дисплей на основе нитчатых бактериофагов: применение для отбора рекомбинантных антител // Acte Naturae. 2009. № 3б. С. 6—15.
Kropinski A., Lingohr E., Moyles D. et al. Endemic bacteriophages: a cautionary tale for evaluation of bacteriophage therapy and other interventions for infection control in animals // Virology J. 2012. V.9. P. 207—215.
Miedzybrodzki R., Borysowski J., Weber-Dabrowska B. et al. Clinical aspects of phage therapy //Advances in virus res. 2012. V. 83. P. 73—121.
Summers W. Bacteriophage therapy // Annu. Rev. Microbiol. 2001. V. 55. P. 437—451.
Работа была поддержана АНО «Центром Новых Медицинских Технологий» в Академгородке (Новосибирск)
Источник: scfh.ru
Что такое бактериофаги
В дословном переводе с древнегреческого языка, бактериофаги — это пожиратели бактерий. Под этим биологическим термином подразумеваются вирусы, которые избирательно поражают бактериальные клетки.
Бактериофаги присутствуют везде, где живут бактерии, поэтому средой обитания для них может быть воздух, вода, почва, организм человека, продукты питания, одежда.
.
Особенности строения бактериофага: у такого вируса нет клеточного строения, есть только генетический материал, покрытый сверху белковой оболочкой. Поэтому для размножения им приходится искать подходящие клеточные микроорганизмы.

Фаг начинает губительную для бактерии деятельность с того, что впрыскивает в ее тело собственную генетическую информацию, а затем приступает к активному размножению. Когда бактериальная клетка разрушается, через ее обломки выходит от 100 до 200 новых бактериофагов, незамедлительно приступающих к поражению находящихся рядом бактерий.
к оглавлению ^
Виды
Фаги — самая древняя и распространенная группа вирусов. В микробиологии различают множество ее представителей, каждый из которых паразитирует за счет определенных бактерий (как патогенных, так и сапрофитных).
Наиболее известные бактериофаги:
- дизентерийный;
- стафилококковый;
- стрептококковый;
- калийный;
- псевдомонадный;
- синегнойный.
к оглавлению ^
Преимущества
Некоторые ученые утверждают, что скоро применение препаратов на основе бактериофагов составит достойную конкуренцию употреблению антибиотиков в ходе лечения самых разных болезней.
Основание для этого смелого предположения дают следующие плюсы применения фагов:
- отсутствие привыкания и противопоказаний к применению препарата;
- отсутствие угнетающего действия на иммунную систему;
- избирательное действие (полезная бактериальная флора остается нетронутой);
- гармоничное сочетание с иными способами лечения, включая терапию с помощью антибиотиков (согласно результатам исследований, фаги даже усиливают их действие);
- ярко выраженный эффект при терапии вялотекущих болезненных состояний, вызванных малочувствительными к антибиотикам бактериальным агентами.
Это позволяет успешно использовать бактериофаг для детей, пожилых людей, беременных женщин, ослабленных пациентов.
к оглавлению ^
Показания
Бактериофаги хорошо зарекомендовали себя в качестве действенного средства, которое используется при лечении инфекционных болезней, возбудителями которых являются патогенные бактерии.
Показаниями для включения бактериофагов в схему лечения являются следующие инфекции:
- хирургические (абсцесс, панариций, парапроктит, остеомиелит, фурункулы, ожоги, флегмона, карбункулы, гнойные раны);
- урогенитальные (цистит, пиелонефрит, кольпит, уретрит, эндометрит, сальпингоофорит);
- энтеральные (холецистит, гастроэнтероколит, дисбактериоз кишечника);
- заражение крови;
- болезни ЛОР органов (ангина, гайморит, отит);
- заболевания дыхательных путей и легких (трахеит, плеврит, ларингит, бронхит, пневмония).
к оглавлению ^
Способы применения
Метод, которым должен применяться бактериофаг, напрямую зависит от характера и места расположения очага воспаления. В разных ситуациях уместными будут следующие способы применения:
- перорально (лекарственный препарат принимается через рот);
- ректально (клизма бактериофагом);
- местно (в виде промывания, примочек, орошений, закапывания, полоскания, введения турунд, пропитанных препаратом).
Бактериофаг действует более эффективно, если лечение совмещает разные способы применения. Существуют определенные клинические показания, по которым внутрь принимается бактериофаг в таблетках, а местное действие оказывает бактериофаг жидкий в виде примочки.
Набирают популярность препараты на основе бактериофагов, выпускаемые в форме растворов, аэрозолей, таблеток, свечей и гелей. Аптечные формы препаратов снабжены подробной инструкцией, как принимать бактериофаг.
к оглавлению ^
Противопоказания
Большинство людей с определенной долей недоверия рассматривает возможность лечения бактериофагами, хотя уже доказана эффективность, а главное, безопасность подобной терапии.
к оглавлению ^
Источник: woman-l.ru
История
Впервые спонтанный лизис бактерий был описан Η. Ф. Гамалеей в 1898 году. Английский бактериолог Туорт (F. Twort) в 1915 году описал феномен «стекловидного» перерождения стафилококков и микрококков при длительном культивировании их на питательной среде. В ходе перерождения бактериальные колонии становились прозрачными и в конце концов теряли способность к пересевам. Фактор, вызывавший растворение колонии, переносился с зараженной колонии на незараженную и сохранял свою активность при разведении в 1 млн. раз. Туорт высказал предположение, что агент, вызывающий стекловидное перерождение бактерий, является вирусом, паразитирующим в бактериальной клетке. В 1917 году канадский микробиолог д’Эрелль (F. d’Herelle) независимо от Туорта описал аналогичный феномен у дизентерийных бактерий и присвоил агенту, вызывающему гибель клеток, название «бактериофаг». Д’Эрелль (см.) заложил основы современного учения о бактериофаге. Он считал, что фаг представляет собой фильтрующийся вирус, являющийся облигатным паразитом бактерий. Д’Эреллю удалось разработать достаточно точный метод титрования фага, используя который, он обнаружил, что в цикле взаимодействия фага с бактерией существует четыре фазы: прикрепление фага к клетке, проникновение внутрь клетки, размножение внутри клетки и лизис клетки с освобождением потомков фага в среду.
Открытие д’Эрелля привлекло к себе внимание медицинского мира в связи с надеждой использовать бактериофаг в качестве средства для лечения и профилактики инфекционных болезней (см. Фагопрофилактика, фаготерапия). Однако большинство экспериментов и исследований, проведенных в клинике, показало относительно низкую терапевтическую ценность бактериофага по сравнению с антибиотиками, что в первую очередь связано с широким распространением фагорезистентных форм бактерий и их быстрой селекцией при использовании фага в практике. Тем не менее бактериофаг могут эффективно использоваться в диагностике инфекционных заболеваний (см. Реакция нарастания титра фагов, Фагодиагностика, Фаготипирование).
Принципы классификации, основные свойства и морфология бактериофагов
Современная классификация фагов основана прежде всего на их химической структуре, на типе нуклеиновой киислоты, заключенной в белковой оболочке. По этому критерию все фаги подразделяют на ДНК- и РНК-содержащие.
Вторым важнейшим классификационным признаком фагов является форма их взаимодействия с бактериальной клеткой. Согласно этому критерию фаги делят на вирулентные и умеренные. Заражение бактерий первыми из них всегда завершается лизисом клетки и освобождением в среду фагового потомства. Для умеренных же фагов существуют два альтернативных цикла развития — лизис клетки, как и при заражении вирулентным фагом, или же установление особого типа симбиотического взаимоотношения с клеткой, которое сохраняется при последующем делении бактерии и передается ее потомкам (см. Лизогения). Это состояние, как правило, обусловлено включением хромосомы умеренного фага в хромосому бактерии, с которой она реплицируется. Бактерии, несущие умеренный фаг, называются лизогенными, а форма бактериофага, присутствующая в лизогенной бактерии, — профагом.
Одним из таксономических признаков фагов является их отношение к половой дифференциации бактерий. По этому признаку фаги можно разделить на три основные группы: 1) f-1, f-2, Qбета, MS-2, атакующие только мужские бактерии; 2) Т-3, Т-7, Φ-ΙΙ, взаимодействующие с женскими клетками (см. Конъюгация у бактерий); 3) индифферентные к половой дифференциации клеток фаги.
Одним из классификационных признаков фагов является их морфология. Обычно фаги делят на крупные и мелкие; кроме того, их различают по форме белкового чехла — капсида. К числу крупных фагов относятся наиболее детально изученные вирулентные колифаги (производное от E. coli + фаг) группы Т, подразделяющиеся в свою очередь на четные и нечетные: Т-1, Т-2, Т-3, Т-4, Т-5, Т-6, Т-7, а также умеренные кишечные фаги λ, Р-1, Р-2 и Р-22 (рис. 1). К категории мелких фагов относятся РНК-содержащие фаги f-2, MS-2, М-12, Д H K-со держащий фаг ФХ-174 и др.
Основные морфологические типы фагов представлены на рис. 2. Наиболее сложно устроены T-четные фаги E. coli: Т-2, Т-4, Т-6, некоторые из фагов Вас. subtilis: SPO-1, SP-8, SP-82 и др. Фаги T-четной группы имеют вытянутую гексагональную головку, ригидный хвостовой отросток длиной 100 нм, диаметром 2,5 нм и прикрепленный к нему сократительный чехол (рис. 2, а). Хвостовой отросток у некоторых фагов, например, у фага Т-2 (рис. 4), имеет дополнительные структуры, которые необходимы для осуществления отдельных этапов взаимодействия фага с клеткой. Кишечные фаги Т-1, Т-5 и умеренный фаг λ также имеют гексагональную головку и хвост (рис. 2, б), однако последний не обладает сократительной способностью. Диаметр головки фага λ — ок. 60 нм, — фага Т-5 — 90 нм, длина хвоста — 160 и 200 нм соответственно. Фаги, относящиеся к третьей морфологической группе (рис. 2,в), имеют крупную гексагональную головку и очень короткий хвостовой придаток. Представителями этой группы являются ДНК-содержащие фаги Т-3 и Т-7, диаметр головки которых достигает 50—60 нм. Наконец, существуют бесхвостые ДHK-содержащие мелкие фаги (рис. 2, г), типичным представителем которых является фаг ФХ-174. Этому фагу присуща полигональная структура капсида с диаметром около 20 нм. Другие бесхвостые фаги, характеризующиеся малыми размерами капсида (20—35 нм), относятся к группе РНК-содержащих и обнаружены у различных представителей кишечной группы (f-2, f-7, MS-2, R-17 и др.), а также у Pseudomonas aeruginosa (рис. 2, д). Кроме полигональных или сферических, обнаружены нитеобразные кишечные фаги, содержащие однонитчатую ДНК (рис. 2, е). Длина нитевидных фагов достигает 800 нм, а диаметром — 6 нм. Большинство фагов такого типа взаимодействует с мужскими штаммами E. coli, но известны и другие нитеобразные фаги, активные в отношении представителей рода Pseudomonas, способные инфицировать и женские штаммы.
Выявление фагов и подсчет количества фаговых частиц можно проводить путем электронной микроскопии очищенных препаратов или же наблюдая действие фагов на популяцию чувствительных бактерий.
Добавление вирулентного фага к взвеси бактерий с последующей инкубацией смеси при t° 30—37° приводит к растворению культуры — лизису, который сопровождается полным просветлением культуральной среды, содержащей бактерии. Скорость наступления лизиса зависит от множественности инфекции, то есть от числа частиц фага, приходящегося на одну бактерию. Если фаголизированную культуру инкубировать большее время, то может появиться вторичный рост (повторное помутнение культуры) за счет размножения селекционированных предсуществующих в бактериальной популяции резистентных мутантов. Инфекция бактерий умеренными фагами, проведенная в аналогичных условиях, приводит к временному уменьшению мутности культуры, за которым вскоре следует нарастание мутности за счет роста и размножения лизогенезированных бактерий.
Количество жизнеспособных частиц фага определяют на твердых питательных средах различными методами, из которых наиболее распространенным является метод Грациа (см. Грациа метод). В этом случае на поверхности твердой питательной среды с засеянным газоном чувствительных бактерий образуются участки лизиса культуры, которые называют бляшками фага, негативными колониями или стерильными пятнами (рис. 3).
Морфология негативных колоний специфична для различных фагов и часто используется как генетическая метка в различных исследованиях.
Вирулентные фаги обычно образуют прозрачные негативные колонии, а умеренные — мутные. Число колоний, или бляшкообразующих единиц (БОЕ), умноженное на фактор разведения исходной взвеси фага, дает величину титра фага, то есть количество БОЕ в 1 мл исходного препарата. Фаги характеризуются и другой величиной, а именно эффективностью посева, то есть отношением общего числа частиц фага, присутствующего в препарате (подсчитанного с помощью электронного микроскопа), к количеству БОЕ. Обычно при оптимальных условиях показатель эффективности посева фага колеблется в пределах 0,5—1,0.
Структура и химический состав фага
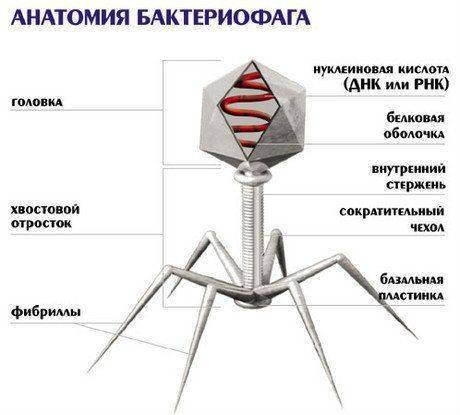
Начиная с работ Шлезингера (М. Schlesinger), проведенных в 30-х годах, стало ясно, что бактериофаг представляет собой нуклеопротеид. В последующем было установлено, что любой Б. состоит из белковой оболочки, окружающей одну молекулу нуклеиновой кислоты. Структура белковой оболочки (капсида) наиболее изучена у T-четных фагов кишечной палочки (Т-2, Т-4, Т-6), относящихся к классу крупных ДНК-содержащих фагов. Вес частицы T-четного фага примерно равен 5 X 10^-16 г, из которых примерно 60% приходится на белки. Исследование структуры и функциональной анатомии T-четных фагов [Андерсон (Т. Anderson), 1953; Бреннер (S. Brenner), 1959; Хорн (R. Horne), 1959; Келленбергер (E. Kellenberger), 1966; Б. Ф. Поглазов, 1970] установило, что капсид состоит из сложно организованных элементов, каждый из которых выполняет определенную функцию при взаимодействии фага с клеткой. Тонкий анализ структуры фага стал доступен после разработки двух основных методических приемов: дезинтеграции частицы фага с помощью физических и химических факторов и метода негативного окрашивания для электронной микроскопии, визуализирующего ультраструктуру в большей степени, чем напыление металлом (Бреннер, Хорн, 1959). На основе этих методов установлено, что T-четные фаги состоят из следующих элементов (рис. 4): головки, воротничка и хвостового отростка, заканчивающегося шестиугольной базальной пластинкой с короткими шипами. К базальной пластинке прикреплены фибриллы. Хвост фага состоит из полого цилиндрического стержня и окружающего его сократительного чехла.
Каждый из структурных элементов фага в свою очередь состоит из большого числа строго ориентированных белковых субъединиц (капсомеров). При переносе Т-четного фага из солевого раствора в дистиллированную воду головка лопается (осмотический шок), заключенная в ней ДНК освобождается и может быть исследована электронно-микроскопическим (рис. 5) и физико-химическими методами. Установлено, что ДНК T-четного фага представляет собой линейную двухспиральную молекулу длиной около 50 мкм, состоящую из 2 X 105 пар оснований. ДНК большинства фагов содержит в своем составе обычные азотистые основания — аденин, тимин, гуанин и цитозин (А, Т, Г, Ц). Исключением из этого правила являются ДНК T-четных фагов и ДНК некоторых фагов Вас. subtilis, содержащие необычные (аномальные) азотистые основания. Так, вместо обычного цитозина содержится 5-оксиметилцитозин, который может быть в глюкозилированной или неглюкозилированной форме.
В ДНК фагов Вас. subtilis (2С, SPO-1, SP-8, SP-82 и др.) тимин замещен на 5-оксиметилурацил. Столь необычная структура ДНК этих фагов придает им ряд свойств, отличающих их от обычных ДНК, в частности наделяет их высокой иммунологической специфичностью [Левин (L. Levine), 1961; Д. М. Гольдфарб, Л. А. Замчук, 1968; Н. А. Брауде, Л. А. Замчук, 1972].
Содержание отдельных азотистых оснований в ДНК различных фагов варьирует и зависит от вида фага. Кроме ДНК, внутри головки фагов Т-2, Т-4 находится так называемый внутренний белок фага, который ассоциирован с его ДНК. В состав этого белка входят полиамины: спермидин и путресцин, кислоторастворимый полипептид, содержащий аспарагиновую кислоту, глутаминовую кислоту и лизин, и кислотонерастворимый белок [Херши (A. Hershey), 1957].
Функция этих компонентов сводится, вероятно, к нейтрализации кислотности ДНК и к созданию матрикса, обеспечивающего ее конденсацию.
Внутриклеточный цикл развития бактериофага. Кинетика репродукции бактериофага иллюстрируется опытом одноступенчатого цикла роста [Эллис, Дельбрюк (Eliis, М. Delbruck), 1939], в котором определяется титр БОЕ в зависимости от времени после смешивания определенного количества частиц T-четного фага с бактериальной суспензией. Культура E. coli, содержащая 109 клеток в 1 мл у заражается фагом со средней множественностью 1. Смесь инкубируют 2—5 минут в аэрируемой среде, а затем пробу переносят в 0,9 мл антифаговой сыворотки (1 : 100), получаемой путем иммунизации кроликов фаголизатами или концентратами фагов. За это время 80% фага адсорбируется на клетках. Зараженные бактерии разводят свежей средой в 10 000 раз (первая ростовая пробирка) и дополнительно еще в 20 раз (вторая ростовая пробирка). Обе пробирки инкубируют при t° 37° и периодически берут пробы, в которых определяют содержание БОЕ путем высева по методу Грациа. В течение первых 25 мин. инкубации такой смеси число БОЕ остается постоянным (латентный период), затем наблюдается резкое возрастание количества фага, продолжающееся около 10 минут, после чего число БОЕ вновь становится постоянным (рис. 6). Латентный период и период возрастания числа БОЕ соответствует одному циклу размножения фага (литическому циклу), включающему события от взаимодействия фаговой частицы с поверхностью клетки-хозяина до выхода фагового потомства в окружающую среду. Литический цикл можно условно разделить на несколько этапов.
1. Адсорбция. В результате случайных столкновений частиц фага с бактериями специфические белки его капсида приходят в соприкосновение с поверхностными фагоспецифическими рецепторами клеточной стенки бактерии. В результате происходит необратимая адсорбция частиц фага (рис. 7). T-четные фаги взаимодействуют с бактериальными рецепторами с помощью специфических белков на концах хвостовых нитей. Для успешной адсорбции необходим определенный ионный состав среды и присутствие кофактора адсорбции, которым для фага Т-4 является триптофан.
2. Проникновение фага внутрь клетки по существу представляет собой «инъекцию» нуклеиновой кислоты фага внутрь бактерии [Херши, Хейс (W. Hayes), 1952]. У T-четных фагов этот процесс происходит следующим образом: шипы базальной пластинки хвостового отростка приходят в контакт с поверхностью бактерии, хвостовой чехол сокращается, в результате чего хвостовой стержень «прокалывает» клеточную стенку и ДНК перетекает в цитоплазму клетки через полость в хвостовом стержне. Вероятно, в процессе «прокалывания» клеточной стенки роль ферментов играет лизоцим (см.), обнаруженный в составе белков хвоста, растворяющий внутренний пептидогликановый слой стенки бактерии. Механизмы адсорбции и проникновения нуклеиновых кислот других фагов отличаются от таковых у Т-четных фагов, однако в конечном итоге во всех случаях свободная нуклеиновая кислота оказывается внутри клетки.
3. Проникновение фаговой ДНК в клетку знаменует собой начало так называемого эклипс-периода, в течение которого не удается обнаружить полноценные фаговые частицы внутри зараженной клетки при ее разрушении ультразвуком или лизоцимом. В это время в клетке происходит ряд процессов, конечным результатом которых является образование предшественников фагового потомства. Генетическая информация, содержащаяся в нуклеиновой кислоте фага, начинает реализовываться с использованием декодирующих систем бактерии. В случае ДНК-содержащих бактериофаг фаговые гены транскрибируются с образованием фагоспецифических информационных РНК, которые определяют синтез фагоспецифических белков транскрипционным аппаратом бактерии. В случае РНК-содержащих бактериофаг фагоспецифические белки синтезируются под контролем фаговой РНК, выполняющей функцию и-РНК (см. Рибонуклеиновые кислоты). К числу фагоспецифических белков, помимо структурных белков капсида, относится также ряд ферментов, не входящих в состав зрелых частиц фага, но необходимых для перестройки биохимического аппарата бактерии в соответствии с нуждами фага. Многие бактериофаги, проникнув в клетку, вызывают подавление бактериальных макромолекул (ДНК, РНК, белков) и деградацию нуклеиновых кислот бактерии. Продукты деградации используются в качестве субстратов для синтеза нуклеиновых кислот фага. Выражение генома бактериофага на протяжении эклипспериода происходит в соответствии с четкой программой, определяющей момент включения и выключения определенных групп фаговых генов (Р. Б. Хесин, М. М. Шемякин, 1962; Р. Б. Хесин, 1970). В бактериях, зараженных T-четными фагами, на первых стадиях эклипс-периода образуются так называемые ранние белки, представляющие собой группу ферментов, обеспечивающих синтез фаговой ДНК. После начала репликации ДНК фага синтез ранних белков прекращается и начинается синтез поздних белков — структурных компонентов фаговых частиц.
Репликация (см.) нуклеиновых кислот фагов в большинстве случаев осуществляется специфическими ферментами, индуцированными фагом. У T-четных фагов, содержащих двунитчатую ДНК, этот процесс протекает по полуконсервированному механизму с участием фагоспецифической ДНК-полимеразы — одного из ранних фагоиндуцированных белков. В случае РНК-содержащих фагов, а также фагов, содержащих однонитевую ДНК (например, фаг ФХ-174), синтез нуклеиновых кислот включает промежуточную двунитчатую репликативную форму: сначала на исходной «плюс»-нити фаговой нуклеиновой кислоты синтезируется комплементарная ей «минус»-молекула, которая затем используется в качестве матрицы для образования «плюс»-нитей ДНК-фагового потомства (рис. 8).
4. Сборка фаговых частиц. Эклипс-период сменяется стадией морфогенеза частиц фагового потомства. На этой стадии латентного периода фаговые частицы могут быть выявлены внутри зараженных клеток. Морфогенез бактериофага заключается в сборке фагового капсида из отдельных молекул структурных белков фага. Сборка происходит поэтапно; сначала образуются отдельные компоненты капсида, которые затем объединяются в более крупные структуры. Большинство этапов морфогенеза происходит по принципу самосборки и может быть воспроизведено in vitro при смешивании отдельных компонентов фага. Однако некоторые этапы сборки осуществляются при участии специфических белков, не являющихся структурными компонентами фага. Наименее понятным моментом морфогенеза фага является упаковка фаговой ДНК внутрь капсида.
5. Цикл размножения фага завершается выходом фаговых частиц потомства из клетки в окружающую среду. Выход сопровождается лизисом бактериальной клетки, который выражается в просветлении бактериальной культуры, зараженной фагом. У T-четных фагов лизис осуществляется двумя фагоспецифическими ферментами, один из которых неизвестной природы, так называемый продукт гена t, разрушает мембрану, а другой — лизоцим — растворяет оболочку бактерий изнутри. Количество частиц фагового потомства в расчете на одну зараженную клетку (урожай фага) может быть вычислено по кривой одноступенчатого цикла роста как отношение числа БОЕ после выхода фага к таковому до начала латентного периода. Величина выхода фага варьирует у различных фагов от нескольких десятков до нескольких тысяч. В оптимальных условиях образуется около 200 частиц T-четных фагов. Эта величина может быть повышена за счет повторной адсорбции частиц фага на зараженных клетках после начала латентного периода (феномен задержки лизиса).
Генетика бактериофага
Исходным моментом в анализе генетической организации фага, как и любого другого организма, является выделение разнообразных мутантов, позволяющих проведение рекомбинационного анализа, необходимого для построения генетической карты фага.
Мутации фага по морфологии негативных колоний. Классическим признаком фага, использованным в фундаментальных исследованиях по молекулярной генетике и в генетическом анализе, является морфология негативных колоний фага. Негативные колонии могут варьировать в размерах, отличаться друг от друга характером края, прозрачностью, размером ореола вокруг зоны лизиса и пр. Все эти изменения часто являются результатом изменений физиологических условий, определяющих особенности взаимодействия фага с бактериальным хозяином. Они могут возникать также в результате мутаций в хромосоме фага и служить в качестве генетических маркеров при рекомбинационном анализе. Наиболее изученным типом мутаций, приводящих к изменению морфологии негативных колоний, является так называемая r-мутация у T-четных фагов. Этот тип мутации был обнаружен Херши в 1946 году. Нормальный (дикий) тип фага Т-2 на бактериальном газоне E. coli В формирует маленькие негативные колонии, окруженные зоной неполного лизиса. Однако среди 103—104 таких колоний фага Т-2 обнаруживаются единичные негативные колонии, имеющие значительно большие размеры с четко очерченным краем. Херши назвал такие мутанты быстролизирующими и обозначил их буквой «г» (от английского rapid — быстрый), дикий тип — символом r+. Мутанты типа г можно подразделить на три группы: r-I, r-II, r-III, которые картируются в разных участках генетической карты фага Т-4 и фенотипически отличаются друг от друга по характеру роста на трех штаммах E. coli (В, S, К). Наиболее изученными из них являются r-II мутанты T-четных фагов, образующие на штамме E. coli В типичные r-колонии и не растущие на штамме E. coli К-12 (λ).
Из числа других мутантов, фенотип которых характеризуется изменением морфологии негативных колоний, следует упомянуть мутные, или tu-мутанты фага Т-4 (от англ. turbid — мутный), негативные колонии которых окружены мутным кольцом, и звездчатые мутанты, описанные Саймондсом (N. Symonds, 1958). Аналогичные типы мутаций по морфологии бляшек описаны и у других фагов, в частности у фага λ, фагов Вас. subtilis и др.
Мутанты фага по диапазону действия. Этот тип мутации связан с изменением структуры белков рецепторного аппарата фага и фенотипически выражается в появлении способности мутанта инфицировать резистентные варианты бактерий, нечувствительные к дикому типу фага. Впервые мутанты по диапазону действия были открыты Лурией (S. Luria)в 1945 году при изучении фага Т-1, а затем обнаружены и у других фагов. Лурия показал, что кишечная палочка, обычно чувствительная к фагу Т-1, мутирует, образуя резистентную форму, обозначаемую символом Ton-r (Т — название группы фагов, опе — англ. один, resistant — резистентный). Подобно этому у E. coli можно получить резистентные мутанты к Т-четным фагам, например, к Т-2, то есть превратить дикий тип кишечной палочки, чувствительный к фагу Т-2 (Tto-s), в резистентный — Tto-r. Мутации такого рода возникают в генах кишечной палочки, контролирующих синтез рецепторов, взаимодействующих с адсорбционным аппаратом фага. При посеве фага дикого типа на резистентный бактериальный штамм большинство фаговых частиц не способно инфицировать бактерии, однако на газонах резистентных культур можно обнаружить единичные колонии фага, возникающие за счет инфекции резистентных клеток мутантными фаговыми частицами. Такие мутанты фага с измененным диапазоном действия обозначают индексом h (от английского host — хозяин). Штрезингер (G. Streisinger, 1956) установил, что диапазон действия фага Т-2 контролируется единичным геном, определяющим конфигурацию белковой субъединицы, входящей в состав хвостовых фибрилл фага. Таким образом, мутацию по диапазону действия четного фага можно характеризовать как переход от h+ генотипа к h генотипу. Интересно, что независимо полученные h-мутанты фага Т-2 не рекомбинируют, и при скрещивании не удается получить h+-рекомбинант, способный инфицировать E. coli Tto-S и не способный — E. coli Tto-r. С другой стороны, если из h-мутантов фага Т-2 получить h+-ревертанты (см. Реверсия) и скрестить их, то можно получить h-рекомбинанты. Это указывает на то, что исходной структурой гена — h фага Т-2 является h-форма, а наблюдаемый в лабораторных условиях h+ генотип по существу является мутантным.
Условно летальные мутанты характеризуются тем, что в одних условиях (рестриктивных, или ограничивающих) они ведут себя как летали, то есть погибают, а в других (пермиссивных, или разрешающих) как дикий тип.
Одним из хорошо изученных классов условно летальных мутантов являются так называемые ts, или температурночувствительные, мутанты, которые размножаются в инфицированных клетках при t° 28—30° и не размножаются в них при t° 42—45°.
Показано, что мутации этого типа могут возникнуть в любом участке хромосомы фага Т-4, то есть затрагивать различные функции фага. В дальнейшем было установлено, что ts-мутанты возникают не только у T-четных фагов, но и у всех других описанных бактериальных вирусов, равно как и у вирусов животных и человека, а также у грибов и бактерий [Браун, Арбер (A. Brown, W. Arber), 1964; Фаттиг (W. Fattig) и соавторами, 1965]. Фенотип ts-мутантов является результатом мутации, изменяющей в конечном итоге первичную структуру специфического белка. Это в свою очередь приводит к изменению его вторичной, третичной и четвертичной структуры.
Белок приобретает повышенную чувствительность к температуре окружающей среды и при повышении последней (42—45°) денатурируется, оставаясь активным при t° 28°. Этот же белок у фага дикого типа сохраняет свою структуру, а следовательно, и активность в диапазоне t° 42—45®.
Амбер-мутанты (am) фага Т-4 характеризуются отсутствием роста на штамме E. coli В, но способны формировать негативные колонии на E. coli К-12 (CR-63) [Эпстайн (R. Epstein) и соавт., 1963]. Штаммы бактериального хозяина, «разрешающие» репродукцию в них амбер-мутантов фага, называют пермиссивными, а штаммы, в которых репродукция мутантов подавлена,— неразрешающими, или непермиссивными. Изучение молекулярных механизмов амбер-мутаций показало, что в ДНК таких мутантов возникает мутационное изменение, которое транскрибируется (см. Транскрипция) на и-РНК в виде одного из так называемых нонсенс-кодонов — УАГ, не распознаваемого антикодоном транспортной РНК (см. Генетический код, Трансляция). В результате при транскрипции прекращается синтез полипептида в том участке, где находится нонсенс-кодон [Стреттон, Бреннер (A. Stretton, S. Brenner), 1965]. Исходя из этого свойства, амбер-кодон является терминирующим кодоном. Однако при заражении пермиссивного бактериального хозяина синтез полипептида продолжается, так как в такой бактерии присутствует транспортная РНК, к-рая способна транслировать («осмысливать») терминирующий кодон и включать в данный участок полипептидной цепи приемлемую аминокислоту, восстанавливая тем самым функциональную активность синтезированного белка. Таким образом, в пермиссивном бактериальном хозяине амбер-мутация супрессируется (см. Супрессия) и такой бактериальный штамм обозначается как su+, а соответствующая амбер-мутация фага относится к типу sus,то eсть супрессор-чувствительному классу мутаций.
Свойство бактерий супрессировать амбер-мутацию определяется генетическим локусом, локализованным в ее хромосоме. Соответственно непермиссивная бактерия обозначается символом su-.
Охра-мутации фага Т-4, так же как и амбер-мутации, относятся к классу нонсенс-мутаций. Фаги, несущие охра-мутацию, размножаются в пермиссивном бактериальном хозяине, имеющем супрессирующие гены, которые отличаются от генов, супрессирующих амбер-мутацию. Нонсенс-кодоном у охра-мутации является триплет УАА [Бреннер, Беквит (J. Beckwith), 1965].
Особенностью этого класса условно летальных мутаций является то, что они супрессируются специфичными для них супрессорами, хотя некоторые амбер-мутации супрессируются также и охра-супрессорами. Поскольку амбер-кодон УАГ отличается от охра-кодона УАА только по одному азотистому основанию, они могут переходить друг в друга в результате единичного мутационного события.
Третьим известным типом нонсенс-мутации у фага Т-4 является так наз. опал-мутация, для к-рой характерен бессмысленный триплет У ГА, не распознаваемый транспортной РНК в su—штаммах. Изучение опал-мутаций позволило прийти к заключению, что УГА-триплет является, как и кодоны УАГ и УАА, терминирующим. Опал-мутация супрессируется в бактериальных штаммах, несущих специфический супрессор, и не супрессируется амбер- или охра-супрессорами.
Скрещивание и рекомбинация фагов
Впервые рекомбинация фагов была проведена в 1946 году Дельбрюком и Бейли (W. Bailey) и независимо от них — Херши.
Для проведения скрещивания фагов необходимо располагать генетически маркированной парой родительских фагов, отличающихся друг от друга по крайней мере двумя признаками. Классические мутации, использованные в первых исследованиях по рекомбинации фагов, были h и г. В последующем скрещивание и рекомбинация проводились с использованием фагов, несущих мутации по всем известным признакам.
Скрещивание фагов проводят путем заражения чувствительного бактериального хозяина двумя родительскими фагами, генетически отличающимися друг от друга. Условия заражения бактерии обоими фагами должны быть такими, чтобы почти все бактерии одновременно были инфицированы обоими типами фагов. Для этого множественность инфекции каждым фагом в среднем должна быть равна 5. Для достижения синхронной инфекции бактерий двумя скрещиваемыми фагами применяют метод Бензера— Жакоба, заключающийся в подавлении внутриклеточного цикла репродукции фага цианидом. Затем, снизив концентрацию цианида путем разведения взвеси зараженных бактерий до неэффективной, «включают» этим самим внутриклеточную фазу инфекции, в ходе которой осуществляется рекомбинация между родительскими фагами. В результате последующего лизиса клеток в потомстве обнаруживают 4 класса фагов: оба родительских и два реципрокных класса рекомбинантов (рис. 9). Кроме указанных классов, обнаруживаются редкие варианты (2%), характеризующиеся признаками обоих родительских фагов (гетерозиготы). Отношение числа рекомбинантов фагов в потомстве к общему числу частиц потомства характеризует частоту рекомбинации. Этот показатель постоянен для двух данных маркеров фага при условии, если скрещивание проводят в строго стандартных условиях. Однако частота рекомбинации варьирует в зависимости от того, какие маркеры фага выбраны для рекомбинации. Скрещивания фагов, несущих различные генетические маркеры, показывают, что частота рекомбинации варьирует от 0,01% при внутригенной рекомбинации до 40% в случае маркеров, удаленных друг от друга. Поскольку частота рекомбинации пропорциональна расстоянию между генами, то с помощью рекомбинационного анализа удалось установить положение одних генов относительно других в пределах хромосомы фага. Результаты такого анализа привели к заключению, что генетический аппарат фага представлен одной группой сцепления, то есть состоит из одной хромосомы. На основании результата двухфакторных скрещиваний было установлено, что наиболее отдаленные друг от друга маркеры хромосомы фага не сцеплены, что соответствовало представлению о линейной организации хромосомы T-четного фага.
Генетический анализ, проведенный на основе трехфакторного скрещивания с большим набором ts и am-мутаций фага Т-4, обнаружил сцепленность между крайними маркерами, что указывает на циркулярность карты сцепления генов у этого фага. Заключение относительно существования у фага одной группы сцепления генов, полученное на основании генетических данных, соответствует физическим наблюдениям, установившим, что в головке фага находится одна молекула ДНК. Однако представление о циркулярности генетической карты оказалось в противоречии с электронномикроскопическими данными Клейншмидта (А. Kleinschmidt, 1962), однозначно устанавливающими существование свободных концов в молекуле ДНК, извлеченной из головки фага Т-2. Это противоречие было устранено после открытия в хромосоме Т-четных фагов терминальной избыточности и циркулярных перестроек.
Источник: xn--90aw5c.xn--c1avg