Рибосома фото
Строение рибосом
Рибосомы относятся к немембранным органоидам. Они очень мелкие (около 20 нм), но многочисленные (тысячи и даже миллионы на клетку), состоят из двух частей – субъединиц. В состав субчастиц входят рибосомальные РНК (рРНК) и рибосомные белки, т. е. рибосомы по химическому составу являются рибонуклеопротеидами. Однако в них также присутствует небольшое количество низкомолекулярных соединений. Из-за многочисленности рибосом, рРНК составляет более половины от всей РНК клетки.
Одну из субъединиц называют «малой», вторую – «большой».
В собранной из субъединиц рибосоме выделят два (по одним источникам) или три (по другим) участка, которые называют сайтами. Один из участков обозначают A (aminoacyl) и называют аминоацильным, второй — P (peptidyl) — пептидильный. Данные сайты являются основными каталитическими центрами протекающих на рибосомах реакций. Третий участок обозначают E (exit), через него освободившаяся от синтезируемого полипептида транспортная РНК (тРНК), покидает рибосому.
Кроме перечисленных сайтов на рибосомах есть другие участки, используемые для связывания различных ферментов.
Когда субъединицы диссоциированы (разъединены) специфичность сайтов теряется, т. е. они определяются сочетанием соответствующих областей обеих субъединиц.
Отличие рибосом прокариот и эукариот
Соотношение по массе белков и РНК в рибосоме примерно поровну. Однако у прокариот белков меньше (около 40%).
Размеры как самих рибосом, так и субъединиц выражают в скорости их седиментации (осаждения) при центрифугировании. При этом S обозначает константу Сведберга — единицу, характеризующую скорость оседания в центрифуге (чем больше S, тем быстрее частица осаждается, а значит тяжелее). У прокариот рибосомы имеют размер в 70S, а у эукариот — в 80S (т. е. они тяжелее и крупнее). При этом субъединицы прокариотических рибосом имеют значения 30S и 50S, а эукариотических — 40S и 60S. Размеры рибосом в митохондриях и хлоропластах эукариот сходны с прокариотическими (хотя имеют определенную вариабельность по размерам), что может указывать на их происхождение от древних прокариотических организмов.
У прокариот в состав большой субъединицы рибосом входит две молекулы рРНК и более 30 молекул белка, в состав малой — одна молекула рРНК и около 20 белков. У эукариот в субъединицах больше молекул белка, а также в большой субъединице три молекулы рРНК. Составляющие рибосому белки и молекулы рРНК обладают способностью к самосборке и в итоге образуют сложную трехмерную структуру. Структуру рРНК поддерживают ионы магния.
Синтез рРНК
У эукариот в состав рибосом входят 4 вида рРНК. При этом три образуются из одного транскрипта-предшественника — 45S рРНК. Он синтезируется в ядрышке (на петлях хромосом его формирующем) при помощи РНК-полимеразы-1. Гены рРНК имеют много копий (десятки и сотни) и обычно располагаются на концах разных пар хромосом. После синтеза 45S рРНК разрезается на 18S, 5.8S и 28S рРНК, каждая из которых подвергается тем или иным модификациям.
Четвертый вид рРНК синтезируется вне ядрышка с помощью фермента РНК-полимеразы-3. Это 5S РНК, которая после синтеза не нуждается в процессинге.
Третичная структура рРНК в составе рибосом очень сложная и компактная. Она служит каркасом для размещения рибосомных белков, которые выполняют вспомогательные функции для поддержания структуры и функциональности.
Функция рибосом
Функционально рибосомы являются местом связывания молекул, участвующих в синтезе (мРНК, тРНК, различные факторы). Именно в рибосоме молекулы могут занять друг по отношению к другу такое положение, которое позволит быстро протечь химической реакции реакции.
В эукариотических клетках рибосомы могут находиться свободно в цитоплазме или быть прикрепленными с помощью специальных белков к ЭПС (эндоплазматическая сеть, она же ЭР — эндоплазматический ретикулум).
В процессе трансляции рибосома перемещается по мРНК. Часто по одной нитевидной мРНК двигаются несколько (или множество) рибосом, образуя так называемую полисому (полирибосому).
Источник: biology.su
Исследовав трехмерную структуру рибосомной РНК современных бактерий, канадские биохимики из Монреальского университета (Département de Biochimie, Université de Montréal) пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая ее структуру и постепенно повышая эффективность ее работы.
Рибосомы — сложные молекулярные комплексы, состоящие из рибосомных РНК (рРНК) и белков. Рибосомы играют ключевую роль в трансляции — синтезе белка по «инструкции», записанной при помощи генетического кода в молекуле матричной РНК (мРНК).
Рибосомы у всех живых существ — от бактерий до человека — устроены очень похоже. По-видимому, это означает, что рибосомы в их «современном» виде имелись уже у общего предка всех нынешних форм жизни (см. LUCA, Last universal common ancestor). Рибосома состоит из двух субъединиц — большой (главной) и малой (вспомогательной). Основу обеих субъединиц составляют молекулы рибосомной РНК (рРНК). Снаружи к молекулам рРНК прилегают молекулы рибосомных белков.
Согласно общепризнанной в настоящее время теории «РНК-мира», на ранних этапах развития жизни все основные функции, которые сегодня выполняются белками, выполнялись молекулами РНК. Появление системы синтеза белка на основе записанных в РНК «инструкций» стало ключевым событием, ознаменовавшим переход от «мира РНК» к привычному нам «белковому миру». Поскольку рибосомы являются центральным компонентом этой системы, вопрос о происхождении рибосом чрезвычайно важен для понимания того, как РНК-организмы превратились в первые прокариотические клетки.
До сих пор многим экспертам казалось, что загадка происхождения рибосом вряд ли когда-нибудь будет разгадана. Ведь в природе не осталось никаких «переходных звеньев», то есть более простых молекулярных комплексов, которые могли бы претендовать на роль «предков» рибосом. Однако канадские биохимики, похоже, нашли ключик к этой тайне в самой структуре рибосом современных организмов.
Они сосредоточились на самой главной части рибосомы — на молекуле 23S-рРНК, которая представляет собой основу большой субъединицы рибосомы кишечной палочки (Escherichia coli).
а молекула весьма велика: она состоит почти из 3000 нуклеотидов. В клетке она сворачивается в сложный трехмерный «клубок». Разные петли, выступы и другие элементы структуры этого «клубка» обеспечивают выполнение разных функций: связь с рибосомными белками, присоединение малой субъединицы, присоединение и удерживание в нужных позициях молекул транспортных РНК (тРНК), которые несут на своих «хвостиках» (CCA-3′-концах) аминокислоты, необходимые для синтеза белка.
Ранее уже было показано, что рибосомные белки играют в рибосоме вспомогательную роль: они делают ее более стабильной и повышают эффективность ее работы, однако все главные действия, необходимые для синтеза белка, осуществляются не белками, а рибосомными РНК. Это значит, что изначально рибосомы могли состоять только из рРНК, а белки добавились позже. Самый главный этап трансляции — присоединение аминокислот к синтезируемой белковой молекуле (реакция транспептидации) — осуществляется молекулой 23S-рРНК. Поэтому логично предположить, что всё началось именно с этой молекулы.
Однако молекула 23S-рРНК слишком велика и сложна, чтобы появиться в готовом виде в результате случайного комбинирования нуклеотидов. Таким образом, ключевой вопрос состоит в том, могла ли 23S-рРНК произойти от более простой молекулы-предшественницы в результате постепенной эволюции, то есть путем последовательного добавления новых фрагментов. Главный вывод обсуждаемой статьи заключается в том, что структура 23S-рРНК свидетельствует именно о таком ее происхождении.
Молекула 23S-рРНК состоит из шести основных структурных блоков, или доменов. Каждый домен, в свою очередь, состоит из более мелких структурных единиц. Целостность трехмерной структуры молекулы поддерживается разнообразными связями (в основном водородными) между ее участками. Некоторые участки молекулы сворачиваются в двойные спирали на основе принципа комплементарности. Важную роль играют и так называемые «А-минорные» связи. А-минорная связь возникает между последовательностью из нескольких идущих подряд аденозинов (А) в одной части молекулы и двойной спиралью в другой ее части (см. рис. 2).
Исследуя структуру 23S-рРНК, авторы обратили внимание на следующее странное обстоятельство. Двойные спирали и образующие с ними А-минорные связи «стопки» аденозинов (adenosine stacks) распределены по шести доменам молекулы более или менее хаотично, за единственным исключением: в пятом домене наблюдается необычное скопление двойных спиралей и практически нет аденозиновых «стопок». Таким образом, А-минорные связи, образуемые пятым доменом, являются однонаправленными (см. рис. 3).
Это наблюдение навело авторов на мысль, что эволюция молекулы 23S-рРНК могла начаться с домена V или с какой-то его части.
ло в том, что А-минорные взаимодействия необходимы для поддержания стабильной трехмерной структуры той части молекулы, к которой принадлежит аденозиновая «стопка», но они не влияют на стабильность той ее части, к которой принадлежит двойная спираль. Иными словами, если мы разорвем какую-нибудь А-минорную связь, показанную на рис. 3 голубой линией, это нарушит структуру той части молекулы, где находится желтый кружок, но не причинит вреда той части, где расположен красный кружок. Таким образом, если 23S-рРНК развивалась постепенно из простой молекулы-предшественницы, то сначала должны были появляться двойные спирали (красные кружки), и только потом к ним могли «пристраиваться» аденозиновые стопки (желтые кружки).
Но если пятый домен был той «затравкой», с которой началась эволюция 23S-рРНК, то следует ожидать, что именно в этом домене находится какой-то важный функциональный центр молекулы. Так ли это? Оказывается, это действительно так: именно пятый домен играют ключевую роль в транспептидации. Он удерживает в правильных позициях CCA’-хвосты двух молекул тРНК (той, что принесла предыдущую аминокислоту, уже присоединенную к синтезируемому белку, и той, что принесла следующую аминокислоту, см. рис. 1). Именно пятый домен 23S-рРНК обеспечивает сближение новой аминокислоты с предыдущей, уже присоединенной к белку, и катализирует соединение аминокислоты с белком.
Обнаружив эти факты, исследователи перешли к более тонкому анализу структуры 23S-рРНК. Они подразделили молекулу на 60 относительно самостоятельных структурных блоков и детально проанализировали характер связей между ними. Фактически они рассматривали молекулу как сложный трехмерный «пазл» и пытались выяснить, поддается ли он сборке и разборке без поломки деталей. Оказалось, что молекулу действительно можно постепенно «разобрать», ни разу не нарушив структуру остающихся блоков. Сначала можно отделить 19 блоков, причем структура оставшихся блоков остается неповрежденной. После этого отделяются еще 11 блоков, затем еще 9, 5, 3, 3, 2, 2, 2; наконец, еще три блока можно отделить последовательно по одному. После этого остается «неразобранным» лишь маленький фрагмент молекулы, составляющий 7% от ее общей массы. Этот неразобранный фрагмент представляет собой участок пятого домена, содержащий в себе каталитический центр, ответственный за транспептидацию (пептидил-трансферазный центр, PTC, peptidyl-transferase centre).
Возможность последовательной разборки молекулы без повреждения остающихся частей — факт весьма нетривиальный. Все блоки молекулы связаны друг с другом, причем связи эти имеют направленный характер: при их разрыве один блок повреждается, а другой нет. Можно представить систему блоков и связей между ними как множество точек, соединенных стрелками, причем стрелка будет указывать на тот блок, который повреждается при разрыве связи.
ли бы эти стрелки образовали хотя бы одну кольцевую структуру (иными словами, если бы мы, двигаясь из какой-то точки по стрелкам, могли вернуться в ту же точку), то разобрать молекулу без повреждения остающихся частей было бы невозможно. Однако ни одной такой кольцевой структуры в молекуле 23S-рРНК не обнаружилось. Если бы направление связей было случайным, вероятность отсутствия кольцевых структур составляла бы менее одной миллиардной. Авторы делают вывод, что это вряд ли результат случайности. По-видимому, структура связей между блоками молекулы отражает последовательность добавления этих блоков в ходе постепенной эволюции молекулы.
Получается, что исходной функциональной молекулой — «проторибосомой», с которой началась эволюция рибосомы, — был пептидил-трансферазный центр (PTC) пятого домена молекулы 23S-рРНК. Сам PTC состоит из двух симметричных лопастей. Каждая лопасть удерживает CCA’-хвостик одной молекулы тРНК. Логично предположить, что такая структура возникла в результате дупликации (удвоения) одной исходной лопасти.
Могла ли такая «проторибосома», способная удерживать две молекулы тРНК и сближать в пространстве прикрепленные к ним аминокислоты, выполнять какую-то полезную функцию в РНК-организме? Эксперименты позволяют ответить на этот вопрос утвердительно. Методом искусственной эволюции были получены функциональные РНК (рибозимы), способные катализировать транспептидацию (соединение аминокислот, прикрепленных к тРНК, в короткие белковые молекулы). Структура этих искусственно выведенных рибозимов очень близка к структуре той проторибосомы, которую «вычислили» авторы обсуждаемой статьи.
По-видимому, проторибосома была просто устроенным рибозимом, катализирующим синтез небольших белковых молекул в РНК-организме. Специфичность синтеза поначалу была очень низкой (аминокислоты выбирались более или менее случайно). В дальнейшем к проторибосоме добавлялись новые блоки, причем добавлялись они таким образом, чтобы не нарушить структуру активного центра молекулы, а также всех тех блоков, которые присоединились ранее. Если очередная мутация приводила к нарушению уже сложившихся структур, она отсеивалась отбором.
Авторы детально реконструировали предполагаемый процесс постепенной эволюции 23S-рРНК. Первые восемь дополнительных блоков присоединились к проторибосоме таким образом, что образовали нечто вроде массивного «основания», благодаря которому структура проторибосомы стала гораздо более стабильной. Следующие 12 блоков еще более укрепили и расширили это «основание». Новые блоки образовали поверхность контакта с малой субъединицей, что позволило включить ее в состав рибосомы. В числе последних добавились блоки, образующие особые выросты (protuberances) на поверхности большой субъединицы. Функция этих выростов состоит в том, что они помогают рибосоме выбирать «правильную» тРНК, несущую нужную аминокислоту, а также выпускать из рибосомы «отработанные» тРНК. В итоге проторибосома оказалась окружена другими блоками со всех сторон, за исключением канала, который был оставлен для выхода образующейся белковой цепочки.
Таким образом, 23S-рРНК, при всей ее кажущейся сложности, построена на основе довольно простого принципа. Ее блочная структура свидетельствует о том, что она могла довольно быстро развиться в ходе эволюции из проторибосомы под действием мутаций и отбора.
Авторы предполагают, что переход от РНК-мира к «белковому миру» состоялся после этапа, обозначенного буквой b на рис. 5. Дело в том, что те блоки рибосомы, которые показаны на рис. 5b, не контактируют с рибосомными белками. Они могли развиться еще до того, как у РНК-организма появилась возможность синтезировать белки с такой точностью, чтобы некоторые из этих белков могли пригодиться для укрепления и усовершенствования рибосом. Все остальные блоки рибосомы (начиная с рис. 5c) уже находятся в тесном контакте с рибосомными белками и «нуждаются» в них для поддержания своей стабильности. Вероятно, они добавлялись уже в «белковом мире», и их эволюция была изначально сопряжена с эволюцией белков.
Источник: Konstantin Bokov, Sergey V. Steinberg. A hierarchical model for evolution of 23S ribosomal RNA // Nature. 2009. V. 457. P. 977–980.
См. также:
А. С. Спирин. Принципы функционирования рибосом.
Александр Марков
Источник: elementy.ru
Строение функция рибосома

Строение функция рибосома
Рибосомы — это важнейшие компоненты клеток как прокариот, так и эукариот. Строение и функции рибосом связаны с синтезом белка|белка в клетке, т. е. процессом трансляции.
По химическому составу рибосомы представляют собой рибонуклеопротеиды, т. е. состоят из РНК и белков. В рибосомы входит только один тип РНК – рРНК (рибосомальная РНК). Однако существует 4 разновидности её молекул.
По строению рибосомы — это мелкие, округлой формы, немембранные органоиды клетки. Их количество в разных клетках варьирует от тысяч до нескольких миллионов. Рибосома — это не монолитная структура, она состоит из двух частиц, которые называют большой и малой субъединицами.
В клетках эукариот большинство рибосом прикреплено к ЭПС, в результате чего последняя становится шероховатой.
Большая|Большая часть рРНК, составляющая рибосомы, синтезируется в ядрышке. Ядрышко образуют определённые участки разных хромосом, содержащие множество копий генов, на которых синтезируется предшественник молекул рРНК. После синтеза предшественника он видоизменяется и распадается на три части — разные молекулы рРНК.
Одна из четырёх типов молекул рРНК синтезируется не в ядрышке, а в ядре на других участках хромосом.
В ядре происходит сборка отдельных субъединиц рибосом, которые затем выходят в цитоплазму, где при синтезе белка|белка объединяются.
По строению обе субъединицы рибосом представляют собой молекулы рРНК, которые принимают определённые третичные структуры (сворачиваются) и инкрустируются десятками различных белков. При этом в состав большой субъединицы рибосом входит три молекулы рРНК (у прокариот — две), а в состав малой — только одна.
Единственная функция рибосом — это обеспечение возможности протекания химических реакций при биосинтезе белка|белка в клетке. Матричная РНК, транспортные РНК, множество белковых факторов в рибосоме занимают определённые положения, что даёт возможность эффективно протекать химическим реакциям.
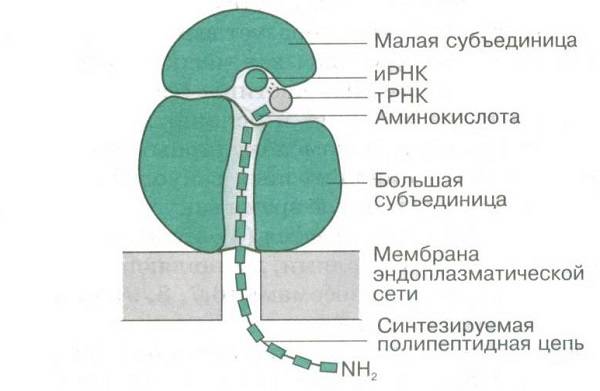
При объединении субъединиц в рибосоме образуются «места|места» – сайты. Рибосома движется по мРНК и «считывает» кодон за кодоном. В один сайт поступает тРНК с присоединённой к ней аминокислотой, в другом – находится ранее прибывшая тРНК, к которой прикреплена ранее синтезированная полипептидная цепочка. В рибосоме между аминокислотой и полипептидом образуется пептидная связь. В результате полипептид оказывается на «новой» тРНК, а «старая» покидает рибосому. На её место смещается оставшаяся тРНК вместе со своим «хвостом» (полипептидом). Рибосома сдвигается по мРНК вперёд на один триплет, и к нему присоединяется комплементарная тРНК и т. д.
По одной цепи мРНК могут двигаться друг за другом|другом несколько рибосом, образуя полисому.
Видео по теме : Строение функция рибосома
Строение функция рибосома

Каждая клетка любого организма имеет сложную структуру, включающую в себя множество компонентов.
Вкратце о строении клетки
Она состоит из мембраны, цитоплазмы, органоидов, которые в них расположены, а также ядра|ядра (кроме прокариотов), в котором находятся молекулы ДНК. Кроме того, над мембраной имеется дополнительная защитная структура. В животных клетках это гликокаликс, во всех остальных — клеточная стенка. У растений она состоит из целлюлозы, у грибов — из хитина, у бактерий — из муреина. Мембрана состоит из трёх слоёв: двух фосфолипидных и белкового между ними. В ней есть поры|поры, благодаря которым осуществляется перенос веществ внутрь и наружу. Возле каждой поры|поры расположены специальные транспортные белки|белки, которые пропускают в клетку только определённые вещества. Органоидами животной клетки являются:
- митохондрии, которые выполняют роль своеобразных «электростанций» (в них происходит процесс клеточного дыхания и синтез энергии);
- лизосомы, которые содержат специальные ферменты для осуществления обмена веществ;
- комплекс Гольджи, предназначенный для хранения и видоизменения некоторых веществ;
- эндоплазматический ретикулум, который нужен для транспорта химических соединений;
- центросома, состоящая из двух центриолей, которые участвуют в процессе деления;
- ядрышко, которое регулирует обменные процессы и создаёт некоторые органоиды;
- рибосомы, о которых мы детально поговорим в этой статье;
- растительные клетки имеют дополнительные органоиды: вакуоль, которая нужна для накопления ненужных веществ в связи с невозможностью вывода их наружу из-за прочной клеточной стенки; пластиды, которые подразделяются на лейкопласты (отвечают за запасание питательных химических соединений); хромопласты, содержащие красочные пигменты; хлоропласты, в которых находится хлорофилл и где происходит процесс фотосинтеза.
-
Рибосома — это что?
Раз уж мы говорим о ней в данной статье, то вполне логично задать такой вопрос. Рибосома — это органоид, который может быть расположен на внешней стороне стенок комплекса Гольджи. Нужно уточнить ещё, что рибосома — это органоид, который содержится в клетке в очень больших|больших количествах. В одной может находиться до десяти тысяч.
Где находятся данные органоиды?
Итак, как уже говорилось, рибосома — это структура, которая находится на стенках комплекса Гольджи. Также она может свободно передвигаться|передвигаться по цитоплазме. Третий вариант, где может располагаться рибосома — мембрана клетки. И те органоиды, которые находятся в этом месте, практически не покидают его и являются стационарными.
Рибосома — строение
Как же выглядит данная органелла? Она похожа на телефон с трубкой. Рибосома эукариот и прокариот состоит из двух частей, одна из которых больше, другая — меньше. Но эти две её составляющие не соединяются вместе, когда она находится в спокойном состоянии. Это происходит только тогда, когда рибосома клетки непосредственно начинает выполнять свои функции. О функциях мы поговорим позже. Рибосома, строение которой описывается в статье, также имеет в своём составе информационную РНК и транспортную РНК. Данные вещества необходимы для того, чтобы записывать на них информацию о нужных клетке белках|белках. Рибосома, строение которой мы рассматриваем, не имеет собственной мембраны. Её субъединицы (так называются две её половины) ничем не защищены.
Какие функции выполняет в клетке данный органоид?
То, за что отвечает рибосома, — синтез белка|белка. Он происходит на основе информации, которая записана на так называемой матричной РНК (рибонуклеиновой кислоте). Рибосома, строение которой мы рассмотрели выше, объединяет свои две субъединицы только на время синтеза белка|белка — процесса под названием трансляция. Во время данной процедуры синтезируемая полипептидная цепь находится между двумя субъединицами рибосомы.
Где они формируются?
Рибосома — органоид, который создаётся ядрышком. Данная процедура происходит в десять этапов, на протяжении которых постепенно формируются белки|белки малой и большой субъединиц.
Каким образом происходит формирование белков?
Биосинтез белков происходит в несколько этапов. Первый из них — это активация аминокислот. Всего их существует двадцать, при комбинировании их разными методами можно получить миллиарды различных белков. На протяжении данного этапа из аминокислот формируется аминоалиц-т-РНК. Данная процедура невозможна без участия АТФ (аденозинтрифосфорной кислоты|кислоты). Также для осуществления этого процесса необходимы катионы магния. Второй этап — это инициация полипептидной цепи, или процесс объединения двух субъединиц рибосомы и поставка к ней необходимых аминокислот. В данном процессе также принимают участие ионы магния и ГТФ (гуанозинтрифосфат). Третий этап называется элонгацией. Это непосредственно синтез полипептидной цепи. Происходит методом трансляции. Терминация — следующий этап — это процесс распада рибосомы на отдельные субъединицы и постепенное прекращение синтеза полипептидной цепочки. Далее идёт последний этап — пятый — это процессинг. На этой стадии из простой цепи аминокислот формируются сложные структуры, которые уже и представляют собой готовые белки|белки. В данном процессе участвуют специфические ферменты, а также кофакторы.
Структура белка|белка
Так как рибосома, строение и функции которой мы разобрали в этой статье, отвечает за синтез белков, то давайте рассмотрим подробнее их структуру. Она бывает первичной, вторичной, третичной и четвертичной. Первичная структура белка|белка — это определённая последовательность, в которой располагаются аминокислоты|аминокислоты, формирующие данное органическое соединение. Вторичная структура белка|белка представляет собой сформированные из полипептидных цепочек альфа-спирали и бета-складки. Третичная структура белка|белка предусматривает определённую комбинацию альфа-спиралей и бета-складок. Четвертичная же структура заключается в формировании единого макромолекулярного образования. То есть комбинации альфа-спиралей и бета-структур формируют глобулы либо фибриллы. По этому принципу можно выделить два типа белков — фибриллярные и глобулярные. К первым относятся такие, как актин и миозин, из которых сформированы мышцы. Примерами вторых могут служить гемоглобин, иммуноглобулин и другие. Фибриллярные белки|белки напоминают собой нить, волокно. Глобулярные больше похожи на клубок сплетённых между собой альфа-спиралей и бета-складок.
Что такое денатурация?
Каждый наверняка слышал это слово. Денатурация — это процесс разрушения структуры белка|белка — сначала четвертичной, затем третичной, а после — и вторичной. В некоторых случаях происходит и ликвидация первичной структуры белка|белка. Данный процесс может происходить вследствие воздействия на данное органическое вещество высокой температуры. Так, денатурацию белка|белка можно наблюдать при варке куриных яиц. В большинстве случаев этот процесс необратим. Так, при температуре выше сорока|сорока двух градусов начинается денатурация гемоглобина, поэтому сильная гипертермия опасна для жизни. Денатурацию белков до отдельных нуклеиновых кислот можно наблюдать в процессе пищеварения, когда с помощью ферментов организм расщепляет сложные органические соединения на более простые.
Вывод
Роль рибосом очень сложно переоценить. Именно они являются основой существования клетки. Благодаря данным органоидам она может создавать белки|белки, которые ей необходимы для самых разнообразных функций. Органические соединения, формирующиеся рибосомами, могут играть защитную роль, транспортную, роль катализатора, строительного материала для клетки, ферментативную, регуляторную (многие гормоны имеют белковую структуру). Поэтому можно сделать вывод, что рибосомы выполняют одну из самых важных функций в клетке. Поэтому их и так много — клетке всегда нужны продукты, синтезируемые данными органоидами.
Источник: biologyinfo.ru
Какую функцию выполняют рибосомы
Назначение описываемого органоида в любой клетке заключается в осуществлении синтеза белков. Белки используются практически всеми клетками:
- в качестве катализаторов — ускоряют время реакции;
- в качестве волокон — обеспечивают стабильность клетки;
- многие белки имеют индивидуальные задачи.

Основным хранилищем информации в клетках служит молекула дезоксирибонуклеиновой кислоты (ДНК). Специальный фермент, РНК-полимераза, связывается с молекулой ДНК и создает «зеркальную копию» — матричную рибонуклеиновую кислоту (мРНК), свободно перемещающуюся из ядра в цитоплазму клетки.
Цепочка рибонуклеиновой кислоты обрабатывается при выходе из ядра; области РНК, которые не кодируют белки, удаляются; мРНК используется для дальнейшего синтеза белка.
Каждая мРНК состоит из 4 различных нуклеиновых кислот, тройки которых составляют кодоны. Каждый кодон определяет специфическую аминокислоту. В организме всех живых существ на Земле встречаются 20 аминокислот. Кодоны, используемые для спецификации аминокислот, почти универсальны.
Кодон, запускающий все белки — «AUG», последовательность нуклеиновых оснований:
- аденин;
- урацил;
- гуанин.
Специальная молекула РНК поставляет аминокислоты для синтеза — транспортная РНК или тРНК. К активному кодону подходит тРНК, несущая соответствующую аминокислоту, ассоциируется с ним. Происходит образование пептидной связи новой аминокислоты со строящимся белком.
Где образуются рибосомы
Составные части органоида образуются в ядрышке. Две субъединицы объединяются для начала химического процесса синтеза белка из цепи мРНК. Рибосома действует в качестве катализатора, образуя пептидные связи между аминокислотами. Использованная тРНК высвобождается обратно в цитозоль, в дальнейшем она может связываться с другой аминокислотой.

Органоид достигнет стоп-кодона мРНК (UGA, UAG и UAA), остановив процесс синтеза. Специальные белки (факторы терминации) прервут цепочку аминокислот, отделив ее от последней тРНК — формирование белка закончится.
Различные белки требуют некоторых модификаций, транспортировки в определенные области клетки до начала функционирования. Рибосома, прикрепленная к эндоплазматическому ретикулуму, поместит вновь образованный белок внутрь, он пройдет дополнительные модификации, будет должным образом свернут. Другие белки образуются непосредственно в цитозоли, где действуют как катализатор для различных реакций.
Рибосомы создают нужные клеткам белки, составляющие около 20 процентов состава клетки. Приблизительно в клетке находится 10 000 различных белков, приблизительно по миллиону копий каждого.
Рибосома эффективно и быстро участвует в синтезе, добавляя 3-5 аминокислот к белковой цепи в секунду. Короткие белки, содержащие несколько сотен аминокислот, могут быть синтезированы за считанные минуты.
Состав и строение рибосом
Рибосомы имеют схожую структуру в клетках всех организмов Земли, незаменимы при синтезе белков. В начале эволюции различных форм жизни рибосома была принята в качестве универсального способа перевода РНК в белки. Эти органоиды изменяются в различных организмах незначительно.

Описываемые органоиды состоят из большой и малой субъединицы, располагающихся вокруг молекулы мРНК. Каждая субъединица представляет собой комбинацию белков и РНК, называемых рибосомальной РНК (рРНК).
Длина рРНК в разных цепях разная. рРНК окружена белками, создающими рибосому. рРНК удерживает мРНК и тРНК в органоиде и действует в качестве катализатора для ускорения образования пептидных связей между аминокислотами.
Рибосомы измеряются в единицах Svedberg, означающих сколько времени требуется молекуле для осаждения из раствора в центрифуге. Чем больше число, тем больше молекула.
Различия между прокариотическими и эукариотическими рибосомами рассмотрены в таблице.
| Критерий | Прокариотические | Эукариотические |
| Размер в единицах Svedberg | 70S | 80S |
| содержание белков и РНК | меньше белков и меньше РНК | больше белков и больше РНК |
| содержание молекул РНК | 3 молекулы РНК | 4 молекулы РНК |
Рибосомы отвечают за процесс синтеза белка – двигательной силы организма и являются одним из ключевых органоидов живой клетки, представленной во всем многообразии живых существ на Земле.
Источник: 1001student.ru