Функции белков мембраны
5
Лекция 5
Строение и функции мембранных белков
Клеточные мембраны содержат белка от 20 до 80% (по весу). Как правило, именно белки ответственны за функциональную активность мембран. К ним относятся разнообразные ферменты, транспортные белки, рецепторы, каналы, поры и. т.д., которые обеспечивают уникальность функций каждой мембраны. Первые успехи в изучении мембранных белков были достигнуты тогда, когда биохимики научились использовать детергенты для выделения мембранных белков в функционально активной форме.
о были работы по изучению ферментных комплексов внутренней мембраны митохондрий. До этого считалось, что мембранные белки имеют исключительно β – складчатую структуру (вторичная структура белка), но данные работы показали, что мембраны содержат большое количество α – спиралей. Значительно реже встречается β – спираль, которой, однако, придают важное биологическое значение. Дело в том, что на участках, окружённых липидами, β – спираль представляет собой полый цилиндр, в наружной стенке которого сосредоточены неполярные (гидрофобные) аминокислотные остатки, а во внутренней – гидрофильные. Такой цилиндр мог бы образовать в мембране канал, через который свободно проходят ионы и водорастворимые вещества. Дальнейшие исследования показали, что мембранные белки могут глубоко проникать в липидный бислой или даже пронизывать его и их стабилизация осуществляется за счёт гидрофобных взаимодействий. Существует, как минимум, четыре вида расположения белков в мембранах: Первый вид – трансмембранный, когда белок пронизывает всю мембрану, а гидрофобный участок белка имеет α – конфигурацию. Похожее расположение в мембране имеет молекула бактериородопсина из Halobacterium halobium его α – спирали последовательно пересекают бислой; Второй вид – связывание с помощью гидрофобного якоря, когда у белка есть короткий участок, состоящего из гидрофобных остатков аминокислот вблизи карбоксильного конца.
о, так называемый, гидрофобный якорь, который можно удалить с помощью протеолиза, а высвобождённый белок становится водорастворимым. Такое расположение в мембране присуще многим цитохромам. Третий вид – связывание с поверхностью бислоя, когда взаимодействие белков имеет в первую очередь электростатическую природу или гидрофобную природу. Данный тип взаимодействия может использоваться как дополнение к другим взаимодействиям, например, к трансмембранному заякориванию. Четвёртый тип- связывание с белками, погружёнными в бислой, это когда некоторые белки связываются с белками, которые располагаются внутри липидного бислоя. Например, F1- часть Н+ — АТФазы, которая связывается с F0 – частью, погружённой в мембрану, а также некоторые белки цитоскелета.
В основе современных представлений о структуре мембранных белков лежит идея о том, что их полипептидная цепь уложена так, чтобы образовалась неполярная, гидрофобная поверхность, контактирующая с неполярной областью липидного бислоя. Полярные домены белковой молекулы могут взаимодействовать с полярными головками липидов на поверхности бислоя. Многие белки являются трансмембранными и пронизывают бислой. Некоторые белки, по – видимому, связаны с мембраной лишь за счёт их взаимодействия с другими белками.
Многие мембранные белки обычно связываются с мембраной с помощью нековалентных взаимодействий. Однако есть белки, которые связаны с липидами ковалентно. Многие белки плазматических мембран относятся к классу гликопротеинов. Углеводные остатки этих белков всегда находятся с наружной стороны плазматической мембраны.
Обычно мембранные белки подразделяют на наружные (периферические) и внутренние (интегральные). При этом критерием служит степень жёсткости обработки, необходимой для извлечения этих белков из мембраны. Периферические белки высвобождаются при промывании мембран буферными растворами с низкой ионной силой, низким или, наоборот, с высоким значением рН и в присутствии хелатирующих агентов (например, ЭДТА), связывающих двухвалентные катионы. Часто бывает, что очень трудно отличить периферические мембранные белки от белков, связавшихся с мембраной в процессе выделения.
Для высвобождения интегральных мембранных белков необходимо использовать детергенты или даже органические растворители.
Многие мембранные белки эукариот и прокариот ковалентно связаны с липидами, которые присоединяются к полипептиду после трансляции.
Мембранные белки, ковалентно связанные с липидами
(А) Белки, к которым присоединена миристиновая кислота
(Б) Белки, к которым присоединена пальмитиновая кислота
(В) Белки с гликозилфосфатидилинозитольным якорем
4. Адгезивная молекула нервных клеток |
В некоторых случаях эти липиды играют роль гидрофобного якоря, с помощью которого белок прикрепляется к мембране. В других случаях липиды, вероятно, выполняют функцию помощника при миграции белка в соответствующую область клетки или (как в случае белков оболочки вирусов) в слиянии мембран.
У прокариот наиболее полно охарактеризован белок липопротеин Брауна – основной липопротеин наружной мембраны E.
li. Зрелая форма этого белка содержит ацилглицерол, который связан тиоэфирной связью с N – концевым цистеином. Кроме того, N – концевая аминокислота связана с жирной кислотой амидной связью. Мембраносвязанная форма пенициллазы прикрепляется к цитоплазматической мембране с помощью N – концевого ацилглицерола аналогично липопротеинам мембраны.
Мембранные белки эукариот ковалентно связанные с липидами, как показано в таблице, их можно разделить на три класса. Белки первых двух классов, по – видимому, локализованы в основном на цитоплазматической поверхности плазматической мембраны, а белки третьего класса на наружной поверхности.
Существуют мембранные белки, которые ковалентно связаны с углеводами. К ним относятся поверхностные белки клеток в основном, выполняющих функции транспорта и рецепции. До сих пор неясно, в чём тут дело. Возможно, это связано с тем, что белки нужно сортировать при направлении их к плазматической мембране. Сахарные остатки могут защищать белок от протеолиза или участвовать в узнавании или адгезии. Поэтому сахарные остатки в мембранных гликопротеинах локализованы исключительно на наружной стороне мембраны.
Можно выделить два основных класса олигосахаридных структур мембранных гликопротеинов: 1) N – гликозидные олигосахариды, связанные с белками через амидную группу аспаргина; 2) О-гликозидные олигосахариды, связанные через гидроксильные группы серина и треонина. Данный класс олигосахаридов состоит из трёх подклассов.
- Простой или обогащённый маннозой комплекс, в котором олигосахарид содержит маннозу и N – ацетилглюкозамин.
- Нормальный комплекс, в котором обогащённый маннозой кор имеет дополнительные боковые ветви, содержащие другие сахаридные остатки, например сиаловую кислоту.
- Большой комплекс, который связан с анионным переносчиком мембраны эритроцитов
Большинство олигосахаридов мембранных гликопротеинов принадлежат к подклассу 1 или2.
Как уже отмечалось выше, белки в цитоплазматической мембране составляют около 50% её поверхности. Примерно 10% мембраны образовано прочно связанными белково–липидными комплексами. Молекула любого встроенного в мембрану белка окружена 45 – 130 и более липидными молекулами. Около половины свободных липидов связано с периферическими белками мембраны.
Белковый состав цитоплазматической мембраны бактерий более разнообразен, чем липидный.
к, в цитоплазматической мембране E. coli K 12 обнаружено около 120 различных белков. В зависимости от ориентации в мембране и характера связи с липидным бислоем, как уже отмечалось выше, белки делят на интегральные и периферические. К периферическим белкам бактерий можно отнести ряд ферментов таких как, НАДН – дегидрогеназа, малатдегидрогеназа и др., а также некоторые белки, которые входят в состав АТФазного комплекса. Этот комплекс представляет собой группу определённым образом расположенных белковых субъединиц, контактирующих с цитоплазмой, периплазматическим пространством и образующих в мембране канал, через который осуществляется переход протона. Участок комплекса, обозначаемый F1, погружён в цитоплазму, а и с – компоненты участка F0 – гидрофобными сторонами молекул погружены в мембрану. Субъединица b частично погружена в мембрану своей гидрофобной частью и осуществляет связь мембранной и цитоплазматической частей ферментного комплекса, а также связь синтеза АТФ в участке F1 с протонным потенциалом в мембране. Субъединицы а, b и с обеспечивают протонный канал. Другие компоненты комплекса обеспечивают его структурную и функциональную целостность.
К интегральным белкам E. coli, которые для проявления энзиматической активности необходимы липиды, можно отнести сукцинатдегидрогеназу, цитохром b. Очень интересными свойствами обладает антибиотики грамицидин А, аламетицин, амфотерицин и нистацин. Они при взаимодействии с мембраной бактерий становятся интегральными белками (антибиотики являются полипептидами и макроциклами).
Грамицидин А – это гидрофобный пептид, состоящий из 15 L- D-аминокислот. При встраивании в мембрану он образует каналы, которые пропускают одновалентные катионы. Этот канал, который образует грамицидин А – охарактеризован наиболее полно. Канал образован двумя молекулами грамицидина А. В результате чередования L- и D- аминокислот образуется спираль, в которой боковые цепи располагаются снаружи, а карбоксильные группы остова – внутри канала. Этот тип спирали, не встречается больше ни в каких белках и образуется из – за необычного чередования стереоизомеров аминокислот в грамицидине А. Грамицидиновый канал, как уже отмечалось выше, катионселективен. Небольшие неорганические и органические катионы проходят через него, в тоже время проницаемость по Cl- равна нулю.
Аламетицин – это пептидный антибиотик из 20 аминокислотных остатков, способный образовывать в мембране электовозбудимые каналы. Аминокислотная последовательность аламетицина включает необычные остатки –α –аминомасляную кислоту и L –фенилаланин. При связывании с мембраной в отличие от грамицидина А он образует пору. Она намного по размеру меньше, чем канал, который образует грамицидин А. Прежде всего это связано с тем, что пространство вокруг α – спирали слишком мало, чтобы через него мог пройти ион.
Марколидные антибиотки, такие как, нистатин и амфотерицин связываются с холестерином и образуют каналы. Каналы образуют 8 –10 молекул этих полиеновых антибиотиков, через которые, правда, с невысокими скоростями проникают ионы.
Источник: refleader.ru
7.6.3.1.1. Функции мембранных белков
На основании функций, которые выполняют мембранные белки их можно разделить на две группы:
— структурные белки – поддерживают структуру всей мембраны. Это, как правило, периферийные белки.
— динамические белки — непосредственно участвуют в процессах, происходящих на мембране.
Выделяют три класса таких белков:
— транспортные – участвуют в переносе веществ через мембрану;
— каталитические — это ферменты, интегрированные в мембрану и катализирующие происходящие там реакции;
— рецепторные – это мембранные рецепторы, специфически связывающие сигнальные молекулы (гормоны, токсины) на наружной стороне мембраны, что служит сигналом для изменения процессов обмена на мембране и внутри клетки.
7.6.3.2. Основные свойства биомембран
К наиболее важным свойствам мембран следует отнести:
— замкнутость мембран;
— ассиметричность мембран;
— динамичность мембран;
— избирательный транспорт веществ через мембрану.
Замкнутость мембран. В процессе самосборки липидные слои замыкаются сами на себя, что позволяет их гидрофобным хвостам полностью избегать контактов с водой. При этом образуются замкнутые области внутри клетки – органеллы.
Ассиметричность мембран. По химическому составу наружная поверхность мембран отличается от внутренней:
а) в состав наружного слоя мембраны входит больше холестерина и липидов, содержащих остатки придельных жирных кислот, такой состав обеспечивает жёсткость наружного слоя мембраны, защищая тем самым клетку от механических повреждений.
Липиды, входящие во внутренний слой мембраны, содержат большее количество остатков непредельных жирных кислот, что обусловливает текучесть внутреннего слоя.
б) наиболее ассиметрично распределены в мембране гликолипиды и гликопротеины: углеводные части гликопротеинов и гликолипидов выходят на наружную поверхность мембраны.
Динамичность мембран. Отдельные молекулы мембранных липидов и белков свободно перемещаются в мембране – участвуют в двух видах движения – продольном и вращательном:
продольное – меняются со своими соседями местами в приделах одного монослоя;
вращательное – вращаются вокруг собственной оси;
перепрыгивают из наружного слоя во внутренний и обратно.
Избирательный транспорт веществ через мембрану:
а) пассивный транспорт — осуществляется без затраты энергии, благодаря:
— градиенту концентраций по разные стороны мембраны для незаряженных частиц;
— направлением электрического поля для ионов металлов;
б) активный или энергозависимый транспорт – транспорт вещества против градиента концентрации, т. е. перенос вещества в область более высоких концентраций. Для активного транспорта используется энергия АТФ. Транспорт осуществляется с помощью мембранных белков.
Источник: studfile.net
Однако данная модель не могла объяснить накапливающиеся экспериментальные данные, и в 1972 году С. Д. Сингером и Г. Л. Николсоном была предложена жидкостно-мозаичная модель мембраны, где мембранные белки «плавают» в жидком липидном бислое, как айсберги в открытом море. При этом предполагалось, что белки никак не упорядочены и могут свободно перемещаться в мембране. Белки, согласно этой модели, могут как взаимодействовать с поверхностью мембраны и потому находиться с одной ее стороны (периферические белки), так и пронизывать мембрану насквозь (интегральные мембранные белки). Последние имеют, таким образом, возможность взаимодействовать как со внеклеточной средой, так и с цитоплазмой клетки. Иногда также выделяют полуинтегральные белки, частично погруженные в мембрану, но не пронизывающие ее насквозь.
Тем не менее даже такая сложная модель организации биологической мембраны потребовала уточнения, когда к 80-м годам XX века развилась концепция липидных рафтов. Сам термин «липидные рафты» был впервые предложен в 1988 году К. Симонсом и Г. ван Меером для описания выделенных участков плотно упакованного липида. В настоящее время существование липидных доменов (то есть областей с определенным набором свойств) в плазматической мембране подтверждено огромным количеством исследований. Показано, что их формирование определяется в том числе белками, находящимися в рассматриваемой части мембраны. Мембранные белки, таким образом, распределены по поверхности клетки не хаотично, а занимают определенные участки, в которых может достигаться высокоупорядоченная структура.
Мембранные белки
Надо понимать, что живая клетка лишена привычных для нас органов чувств, которые, между прочим, сами состоят из определенных типов клеток. Тем не менее, как и нам с вами, клетке нужно взаимодействовать с окружающей средой. При этом для некоторых воздействий, например для света или для маленьких липофильных молекул, плазматическая мембрана не является препятствием, и потому они могут напрямую взаимодействовать с внутриклеточными белками. Здесь следует напомнить, что в ответ на внешние воздействия в клетке происходят каскады химических реакций, завершающиеся, например, началом выработки определенных белков или запуском определенных программ жизнедеятельности клетки. Так, в ответ на некоторые воздействия клетка может выделять во внешнюю среду гормоны или ферменты, начинать деление или даже запускать запрограммированный механизм собственной гибели — апоптоз. Это далеко не все возможные ответы, однако все они имеют общий принцип запуска в виде каскада химических превращений во внутриклеточном пространстве.
Также для поддержания жизнедеятельности необходим постоянный транспорт вещества через мембрану. Так как существует множество различных внешних сигналов, на которые клетка должна уметь отвечать, на ее поверхности представлено большое многообразие различных мембранных белков. Среди них выделяют рецепторы, ионные каналы, порины, транспортеры, молекулярные моторы и структурные белки. Рецепторные белки формируют внутри клетки сигнал в ответ на появление снаружи гормонов и сигнальных молекул. К ним относится, например, рецептор инсулина, отвечающий за поступление в клетку глюкозы. Ионные каналы обеспечивают транспорт ионов и поддержание градиента (то есть разницы в концентрациях) их концентраций между внешней средой и цитоплазмой клетки. Натриевые и калиевые каналы непосредственно участвуют в передаче нервного импульса. Порины и транспортеры обеспечивают перенос воды и определенных молекул через мембрану. Молекулярные моторы присутствуют у многих бактерий и обеспечивают подвижность клеток. Наконец, структурные белки поддерживают структуру мембраны и взаимодействуют с остальными белками. Не менее сложной является сеть внутриклеточных путей передачи сигналов с помощью каскадов реакций. Взаимодействиями белков в клетке и, соответственно, путями передачи сигналов занимается специальное научное направление, называемое интерактомикой (от англ. interaction — ‘взаимодействие’).
Источник: postnauka.ru
Липидам в составе мембран отводят, в первую очередь, структурные свойства — они создают бислой, или матрикс, в котором размещаются активные компоненты мембраны — белки. Именно белки придают разнообразным мембранам уникальность и обеспечивают специфические свойства. Многочисленные мембранные белки выполняют следующие основные функции: обусловливают перенос веществ через мембраны (транспортные функции), осуществляют катализ, обеспечивают процессы фото- и окислительного фосфорилирования, репликацию ДНК, трансляцию и модификацию белков, рецепцию сигналов и передачу нервного импульса и др.
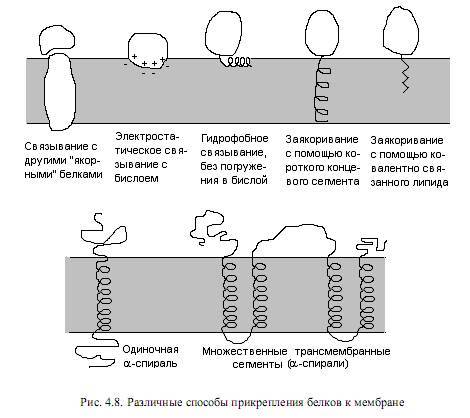
Принято делить мембранные белки на 2 группы: интегральные(внутренние) и периферические (наружные). Критерием такого разделения служит степень прочности связывания белка с мембраной и, соответственно, степень жесткости обработки, необходимой для извлечения белка из мембраны. Так, периферические белки могут высвобождаться в раствор уже при промывке мембран буферными смесями с низкой ионной силой, низкими значениями рН в присутствии хелатирующих веществ, например этилендиаминотетраацетата (ЭДТА), связывающих двухвалентные катионы. Периферические белки выделяются из мембран при таких мягких условиях, поскольку связаны с головками липидов или с другими белками мембраны при помощи слабых электростатических взаимодействий, либо с помощью гидро-фобных взаимодействий — с хвостами липидов. Наоборот, интегральные белки представляют собой амфифильные молекулы, имеют на своей поверхности большие гидрофобные участки и располагаются внутри мембраны, поэтому для их извлечения требуется разрушить бислой. Для этих целей наиболее часто используют детергенты или органические растворители. Способы прикрепления белков к мембране довольно разнообразны (рис. 4.8).
Транспортные белки. Липидный бислой является непроницаемым барьером для большинства водорастворимых молекул и ионов, и их перенос через биомембраны зависит от деятельности транспортных белков. Можно выделить два основных типа этих белков: каналы (поры) и переносчики. Каналы представляют собой туннели, пересекающие мембрану, в которых места связывания транспортируемых веществ доступны на обеих поверхностях мембраны одновременно. Каналы в процессе транспорта веществ не претерпевают каких-либо конформационных изменений, их конформация меняется лишь при открывании и закрывании. Переносчики, наоборот, в процессе переноса веществ через мембрану изменяют свою конформацию. Причем в каждый конкретный момент времени место связывания переносимого вещества в переносчике доступно только на одной поверхности мембраны.
Каналы, в свою очередь, можно разделить на две основные группы: потенциалзависимые и регулируемые химически. Примером потенциалзависимого канала является Na+ -канал, его работа регулируется изменением напряжения электрического поля. Иными словами, эти каналы открываются и закрываются в ответ на изменение трансмембранного потенциала. Химически регулируемые каналы

открываются и закрываются в ответ на связывание специфических химических агентов. Например, никотиновый ацетилхолиновый рецептор при связывании с ним нейромедиатора переходит в открытую конформацию и пропускает одновалентные катионы (подрадел 4.7 данной главы). Термины «пора» и «канал» обычно взаимозаменяемы, но под порой чаще понимают неселективные структуры, различающие вещества главным образом по размеру и пропускающие все достаточно малые молекулы. Под каналами чаще понимают ионные каналы. Скорость транспорта через открытый канал достигает 106 — 108 ионов в секунду.
Переносчики также можно разделить на 2 группы: пассивные и активные. С помощью пассивных переносчиков через мембрану осуществляется транспорт одного типа веществ. Пассивные переносчики задействованы в облегченной диффузии и лишь увеличивают поток вещества, осуществляемый по электрохимическому градиенту (например, перенос глюкозы через мембраны эритроцитов). Активные переносчики транспортируют вещества через мембрану с затратами энергии. Эти транспортные белки накапливают вещества на одной из сторон мембраны, перенося их против электрохимического градиента. Скорость транспорта с помощью переносчиков в очень сильной степени зависит от их типа и колеблется от 30 до 105 с-1. Часто для обозначения отдельных переносчиков используют термины «пермеаза», «транслоказа», которые можно считать синонимами термина «переносчик».
Ферментные функции мембранных белков. В клеточных мембранах функционирует большое количество разнообразных ферментов. Одни из них локализуются в мембране, находя там подходящую среду для превращения гидрофобных соединений, другие благодаря участию мембран располагаются в них в строгой очередности, катализируя последовательные стадии жизненно важных процессов, третьи нуждаются в содействии липидов для стабилизации своей конформации и поддержания активности. В биомембранах обнаружены ферменты — представители всех известных классов. Они могут пронизывать мембрану насквозь, присутствовать в ней в растворенной форме или, являясь периферическими белками, связываться с мембранными поверхностями в ответ на какой-либо сигнал. Можно выделить следующие характерные типы мембранных ферментов:
1) трансмембранные ферменты, катализирующие сопряженные реакции на противоположных сторонах мембраны. Эти ферменты имеют, как правило, несколько активных центров, размещающихся на противоположных сторонах мембраны. Типичными представителями таких ферментов являются компоненты дыхательной цепи или фотосинтетические редокс-центры, катализирующие окислительно-восстановительные процессы, связанные с транспортом электронов и созданием ионных градиентов на мембране;
2) трансмембранные ферменты, участвующие в транспорте веществ. Транспортные белки, сопрягающие перенос вещества с гидролизом АТР, например, обладают каталитической функцией;
3) ферменты, катализирующие превращение связанных с мембраной субстратов. Эти ферменты участвуют в метаболизме мембранных компонентов: фосфолипидов, гликолипидов, стероидов и др.
4) ферменты, участвующие в превращениях водорастворимых субстратов. С помощью мембран, чаще всего в прикрепленном к ним состоянии, ферменты могут концентрироваться в тех областях мембран, где содержание их субстратов наибольшее. Например, ферменты, гидролизующие белки и крахмал, прикрепляются к мембранам микроворсинок кишечника, что способствует увеличению скорости расщепления этих субстратов.
Белки цитоскелета. Цитоскелет представляет собой сложную сеть белковых волокон разного типа и присутствует только в эукариотических клетках. Цитоскелет обеспечивает механическую опору для плазматической мембраны, может определять форму клетки, а также местоположение органелл и их перемещение при митозе. С участием цитоскелета осуществляются также такие важные для клетки процессы, как эндо- и экзоцитоз, фагоцитоз, амебоидное движение. Таким образом, цитоскелет является динамическим каркасом клетки и определяет ее механику.
Цитоскелет формируется из волокон трех типов:
1) микрофиламенты(диаметр ~ 6 нм). Представляют собой нитевидные органеллы — полимеры глобулярного белка актина и других связанных с ним белков;
2) промежуточные филаменты (диаметр 8— 10 нм). Сформированы кератинами и родственными им белками;
3) микротрубочки (диаметр ~ 23 нм) — длинные трубчатые структуры.
Состоят из глобулярного белка тубулина, субъединицы которого формируют полый цилиндр. Длина микротрубочек может достигать нескольких микрометров в цитоплазме клеток и нескольких миллиметров в аксонах нервов.
Перечисленные структуры цитоскелета пронизывают клетку в разных направлениях и тесно связываются с мембраной, прикрепляясь к ней в некоторых точках. Эти участки мембраны играют важную роль в межклеточных контактах, с их помощью клетки могут прикрепляться к субстрату. Они же играют важную роль в трансмембранном распределении липидов и белков в мембранах.
Источник: studopedia.ru