Запрограммированная смерть клетки
Апоптоз, или запрограммированная гибель клеток, является естественным процессом в организме. Он включает в себя контролируемую последовательность событий, в которых клетка сигнализируют о самоуничтожении. Апоптоз помогает контролировать естественный процесс деления клеток посредством митоза.
Почему клетки проходят апоптоз?
Существует несколько случаев, когда клеткам необходимо самоуничтожение. Например, естественный процесс менструации включает в себя распад и удаление ткани из матки. Также клетки могут подвергнутся повреждению или некоторым типам инфекции. Один из способов убрать эти клетки, не причинив вреда здоровым клеткам, является апоптоз.
Что происходит во время апоптоза?
Апоптоз — сложный процесс, который включает в себя множество событий. Во время апоптоза клетка вызывает процесс изнутри, что позволяет ей совершить самоубийство. Если клетка испытывает некоторый тип значительного стресса, такой как повреждение ДНК, то высвобождаются сигналы, которые активируют митохондрии для высвобождения белков индуцирующих апоптоз.
В результате клетка подвергается уменьшению размера, поскольку ее клеточные компоненты и органеллы разрушаются и конденсируются. На поверхности клеточной мембраны появляются пузырьки, повышающие ее проницаемость. Затем клетка разделяется на более мелкие фрагменты, называемые апоптозными телами. Эти фрагменты заключены в мембраны, чтобы не повредить соседние клетки.
Затем фагоцитарные клетки, такие как макрофаги, поглощают и разрушают апоптотические тела, не вызывая воспалительную реакцию. Апоптоз также может запускаться снаружи химическими веществами, которые связываются с конкретными рецепторами на поверхности клетки. Это путь, используемый некоторыми лейкоцитами для активации апоптоза в инфицированных клетках.
Апоптоз и рак
Некоторые виды рака сохраняются в результате неспособности клетки пройти апоптоз. Опухолевые вирусы меняют клетки путем интеграции их генетического материала с ДНК клетки-хозяина. Эти вирусы инициируют производство белков, останавливающими процесс апоптоза. Пример этого можно увидеть с вирусами папилломы, которые связывают с раком шейки матки. Раковые клетки, которые не развиваются из вирусной инфекции, могут также продуцировать вещества, ингибирующие апоптоз и способствуют неконтролируемому росту. Радиационная и химическая терапия используется для индукции апоптоза при некоторых видах рака.
Источник: natworld.info
Что такое апоптоз?
Апоптоз – физиологическая смерть клетки, представляющая собой своеобразную генетически запрограммированную самоликвидацию.
Термин «апоптоз» в переводе с греческого означает «опадающий». Авторы термина дали такое название процессу запрограммированной смерти клеток потому, что именно с ним связано осеннее опадание увядших листьев. Кроме того, само название характеризует процесс как физиологический, постепенный и абсолютно безболезненный.
У животных в качестве наиболее яркого примера апоптоза, как правило, приводят исчезновение хвоста у лягушки во время метаморфозы из головастика во взрослую особь.
По мере взросления лягушонка хвост полностью исчезает, поскольку его клетки подвергаются постепенному апоптозу – запрограммированной смерти, и поглощению деструктированных элементов другими клетками.
Явление генетически запрограммированной гибели клеток встречается у всех эукариотов (организмов, клетки которых имеют ядро). Прокариоты же (бактерии) имеют своеобразный аналог апоптоза. Можно сказать, что данный феномен характерен для всего живого, за исключением таких особых доклеточных форм жизни, как вирусы.
Апоптозу могут подвергаться как отдельные клетки (как правило, дефектные), так и целые конгломераты. Последнее особенно характерно для эмбриогенеза. К примеру, опыты исследователей доказали, что благодаря апоптозу во время эмбриогенеза исчезают перепонки между пальцами на лапках у цыплят.
Ученые утверждают, что у человека такие врожденные аномалии, как сросшиеся пальцы на руках и ногах, также возникают вследствие нарушения нормального апоптоза на ранних стадиях эмбриогенеза.
История открытия теории апоптоза
Изучение механизмов и значения генетически программируемой клеточной смерти началось еще в шестидесятых годах прошлого века. Ученых заинтересовал тот факт, что клеточный состав большинства органов на протяжении жизни организма практически одинаков, а вот жизненный цикл различных типов клеток значительно отличается. При этом происходит постоянная замена многих клеток.
Таким образом, относительное постоянство клеточного состава всех организмов поддерживается динамическим равновесием двух противоположных процессов – клеточной пролиферации (деление и рост) и физиологического отмирания отживших клеток.
Авторство термина принадлежит британским ученым – Дж. Керру, Э. Уайли и А. Керри, которые впервые выдвинули и обосновали концепцию о принципиальном различии физиологической смерти клеток (апоптоз), и их патологической гибели (некроз).
В 2002 году ученые из кембриджской лаборатории, биологи С. Бреннер, Дж. Салстон и Р. Хорвиц, получили Нобелевскую Премию по физиологии и медицине за раскрытие основных механизмов генетической регуляции развития органов и исследования программируемой клеточной смерти.
Сегодня теории апоптоза посвящены десятки тысяч научных работ, раскрывающие основные механизмы его развития на физиологическом, генетическом и биохимическом уровнях. Ведется активный поиск его регуляторов.
Особенно большой интерес представляют исследования, дающие возможность практического применения регуляции апоптоза при лечении онкологических, аутоиммунных и нейродистрофических заболеваний.
Механизм
 Механизм развития апоптоза на сегодняшний день до конца не изучен. Доказано, что процесс может индуцироваться малыми концентрациями большинства веществ, вызывающих некроз.
Механизм развития апоптоза на сегодняшний день до конца не изучен. Доказано, что процесс может индуцироваться малыми концентрациями большинства веществ, вызывающих некроз.
Однако в большинстве случаев генетически запрограммированная гибель клеток происходит при поступлении сигналов от молекул – клеточных регуляторов, таких как:
- гормоны;
- антигены;
- моноклональные антитела и др.
Сигналы к апоптозу воспринимаются специализированными клеточными рецепторами, которые запускают последовательные этапы внутриклеточных сложных биохимических процессов.
Характерно, что сигналом к развитию апоптоза может быть как наличие активирующих веществ, так и отсутствие некоторых соединений, препятствующих развитию запрограммированной смерти клетки.
Ответ клетки на сигнал зависит не только от его силы, но и от общего исходного состояния клетки, морфологических особенностей ее дифференцировки, стадии жизненного цикла.
Одним из базовых механизмов апоптоза на стадии его реализации является деградация ДНК, в результате чего происходит фрагментация ядра. В ответ на повреждение ДНК запускаются защитные реакции, направленные на ее восстановление.
Неудачные попытки восстановить ДНК приводят к полному энергетическому истощению клетки, что и становится непосредственной причинной ее гибели.
Механизм апоптоза — видео
Фазы и стадии
Различают три физиологические фазы апоптоза:
1. Сигнальная (активация специализированных рецепторов).
2. Эффекторная (формирование из разнородных эффекторных сигналов единого пути апоптоза, и запуск каскада сложных биохимических реакций).
3. Дегидратационная (букв. обезвоживание – гибель клетки).
Кроме того, морфологически выделяют две стадии процесса:
1. Первая стадия – преапоптоз. На этой стадии происходит уменьшение размеров клетки за счет ее сморщивания, возникают обратимые изменения в ядре (уплотнение хроматина и скопление его по периферии ядра). В случае воздействия некоторых специфических регуляторов апоптоз может быть остановлен, и клетка возобновит свою нормальную жизнедеятельность.
2. Вторая стадия – собственно апоптоз.
утри клетки происходят грубые изменения во всех ее органеллах, однако наиболее значимые превращения развиваются в ядре и на поверхности ее внешней мембраны. Клеточная мембрана теряет ворсинки и обычную складчатость, на ее поверхности формируются пузырьки – клетка как бы кипит, и в результате распадается на так называемые апоптические тельца, поглощаемые тканевыми макрофагами и/или соседними клетками.
Морфологически определяемый процесс апоптоза занимает, как правило, от одного до трех часов.
Некроз и апоптоз клетки. Сходство и различие
Терминами некроз и апоптоз обозначают полное прекращение жизнедеятельности клетки. Однако апоптозом обозначают физиологическое отмирание, а некрозом – ее патологическую гибель.
Апоптоз является генетически запрограммированным прекращением существования, то есть по определению имеет внутреннюю причину развития, в то время как некроз происходит в результате воздействия сверхсильных внешних, по отношению к клетке, факторов:
- травма;
- ожог;
- кислородное голодание;
- недостаток питательных веществ;
- отравление токсинами и т.п.
Для апоптоза характерна постепенность и стадийность процесса, в то время как некроз наступает более остро, и четко различить стадии практически невозможно.
Кроме того, гибель клетки при процессах некроза и апоптоза отличается морфологически – первый характеризуется её набуханием, а при втором происходит сморщивание клетки, и уплотнение ее мембран.
Во время апоптоза происходит гибель клеточных органелл, однако мембрана сохраняется в целостности, так что образуются, так называемые, апоптические тельца, которые впоследствии поглощаются специализированными клетками – макрофагами или клетками-соседями.
При некрозе происходит разрыв клеточной мембраны, и содержимое клетки выходит наружу. Начинается воспалительная реакция.
Если некрозу подверглось достаточно большое количество клеток, воспаление проявляется известными с древности характерными клиническими симптомами, такими как:
- боль;
- покраснение (расширение сосудов в области поражения);
- припухлость (воспалительный отек);
- местное, а иногда и общее повышение температуры;
- более или менее выраженное нарушение функции органа, в котором произошел некроз.
Биологическое значение
 Биологическое значение апоптоза заключается в следующем:
Биологическое значение апоптоза заключается в следующем:
1. Осуществление нормального развития организма в период эмбриогенеза.
2. Предотвращение размножения мутировавших клеток.
3. Регуляция деятельности иммунной системы.
4. Предотвращение преждевременного старения организма.
Данный процесс играет ведущую роль в эмбриогенезе, поскольку многие органы и ткани претерпевают значительные трансформации во время эмбрионального развития. Многие врожденные дефекты возникают вследствие недостаточной активности апоптоза.
Как запрограммированная самоликвидация дефектных клеток, данный процесс является мощной природной защитой против онкологических заболеваний. Так, к примеру, вирус папилломы человека блокирует клеточные рецепторы, ответственные за апоптоз и, таким образом, приводит к развитию рака шейки матки и некоторых других органов.
Благодаря данному процессу происходит физиологическая регуляция клонов Т-лимфоцитов, ответственных за клеточный иммунитет организма. Клетки, неспособные распознавать белки собственного организма (а таких в общей сложности созревает около 97%), подвергаются апоптозу.
Недостаточность апоптоза приводит к тяжелым аутоиммунным заболеваниям, в то время как его усиление возможно при иммунодефицитных состояниях. К примеру, тяжесть течения СПИДа коррелирует с усилением данного процесса у Т-лимфоцитов.
Кроме того, этот механизм имеет большое значение для функционирования нервной системы: он ответственен за нормальное формирование нейронов, и он же может вызывать раннее разрушение нервных клеток при болезни Альцгеймера.
Одна из теорий старения организма – теория апоптоза. Уже доказано, что именно он лежит в основе преждевременного старения тканей, где гибель клеток остается невосполнимой (нервная ткань, клетки миокарда). С другой стороны, недостаточный апоптоз может способствовать накоплению в организме стареющих клеток, которые в норме физиологически отмирают, и заменяются новыми (раннее старение соединительной ткани).
Источник: www.tiensmed.ru
Олег Чагин
Наши клетки — склонны к самоубийству
Более того, они могут покончить с собой по малейшему поводу: перегрев, радиационное облучение, гипоксия… У них даже есть свои антидепрессанты!
Клетки всё время получают сигнал от других клеток: «живи-живи-живи» и прерывание его сразу приводит к смерти.
Но иногда от «соседей» поступает совсем другое послание.
Клетки внимательно следят друг за другом, и при неадекватном поведении посылают сигнал апоптоза — запрограммированной смерти.
Биологическая клетка — это сложный и крайне интересный объект, по сути своей она является целым организмом, который рождается, дышит, питается, размножается и умирает.
Но это не удивительно, ведь огромная часть живых существ на нашей планете состоят только из одной клетки.
Стоит отличать апоптоз от некроза, который является гибелью клеток в результате травмы и повреждения.
Основное отличие — при апоптозе, которые не происходит случайно, из остатков клеток образуются апоптические тела, которые поедаются вызванными для этого фагоцитами, что препятствует воспалению и отравлению соседних клеток, а при некрозе происходит отмирание клеток и целых тканей, сопровождающееся сильным воспалением.
Интересный факт, что термин «апоптоз» означал опадание лепестков и листьев у растений (др.-греч. ἀπόπτωσις — опадание листьев).
Условно можно выделить три стадии апоптоза: инициация или получение сигнала, эффекторная стадия, в которой запускаются процессы деградации и, собственно, процесс разрушения и деградация — формирование апоптических тел с последующим поеданием макрофагами.
Выделяют 2 пути инициации: митохондриальный и внешний сигнал
Митохондрии — энергетические станции нашего организма, там собственно и происходит процесс клеточного дыхания с превращением кислорода в воду.
В школьных учебниках митохондрии изображались как такие вытянутые овалы разбросанные по всех клетке. Но это не совсем так.
Если посмотреть на срез клетки, то вы действительно увидите такую картину, но при трехмерной реконструкции клеток по этим тонким срезам ученые обнаружили, что митохондирия в клетке всего одна, но она имеет сложную изогнутую структуру, поэтому на срезах мы видим различные ее выросты.
Митохондрии окружены двумя клеточными мембранами и между ними находятся белки апоптоза или апоптические белки, которые вырываются на свободу при разрыве внешней мембраны или формировании в ней пор.
Собственно это и является ключевой фазой начала апоптоза.
Освободившиеся белки через ряд биохимических реакций активируют каспазы — ферменты, которые разрушают другие белки.
Каспазы начинаю крушить все вокруг себя, разрушая все основные клеточные структуры.
В процессе разрушения митохондриальной мембраны не только высвобождаются белки, но и вода начинает активно поступать в митохондрию, вызывая ее разбухание.
Второй путь начала апоптоза — сигнальный.
На поверхности клеток есть рецепторы клеточной гибели, специальные лиганды, продуцируемые другими клетками (части это бывают активированные макрофаги, которые позже и подъедают остатки), связываются с этими лигандами и активируют их.
Рецепторы представляют собой большую молекулу, которая сидит в клеточной мембране и выступает с обоих сторон: внутрь клетки и наружу.
С наружной стороны садится лиганд и по всему рецептору передается сигнал на внутреннюю сторону.
Далее запускается цепь биохимических реакций, в результате которой, как и в митохондриальном пути, активируются каспазы.
На второй стадии апоптоза — эффекторной, уже не так важно как клетка получила сигнал.
На этой стадии внутри начинается настоящий апокалипсис и главную роль в нем играют каспазы
Второй важный элемент этой стадии — флавопротеин AIF, который выходит из митохондрий и активируют эндонуклеазы — белки, которые разрушают ДНК клетки.
Фактически, после этой стации клетка представляет собой город после ядерной бомбежки.
Во время разрушения митохондриальной мембраны также высвобождается весь энергетический комплекс, который провоцируют образование активных форм кислорода внутри клетки.
Свободные радикалы запускают цепные реакции, которые способствуют разрушению содержимого клетки.
В этот момент их уже нельзя сдержать антиоксидантами.
После этого начинается третья и последняя стадия — деградация.
Клетка теряет свою форму и сжимается из-за разрушения клеточного скелета.
Далее начинается фрагментация клетки на мелкие части, которые представляют собой клеточную мембрану с остатками внутри — эти образования получили название — апоптические тела.
Вокруг умирающей клетки уже дежурят макрофаги, готовые набросится на останки.
В процессе клетки, на поверхности мембраны появляются сигнальные белки, которые привлекают голодных макрофагов и вот, они уже поглощают останки погибшего сородича.
Но и у клеток есть антидепрессанты, которые держат эти процессы под контролем не давая среагировать на малейший стресс — это ингибиторы апоптических белков.
Но, как только мембрана митохондрий начинает выпускать предшественников апокалипсиса, на волю вырывается и белок SMAC, который деактивируют эти ингибиторы и они становятся бесполезны.
После этой стадии апоптоз уже сложно остановить.
Не стоит думать, что апоптоз — исключительно мрачно-негативное явление нашего организма.
С помощью апоптоза поддерживается правильное количество и соотношение различных клеток в организме
Апоптоз играет далеко не последнюю роль в нашем развитии: например, разделение пальцев на руках и ногах является следствием запрограммированной гибели клеток.
При прорезании зубов у детей еще до того, как появится зуб, начинается процесс гибели клеток десны, чтобы зубу было легко выйти.
Хвост у головастиков также не отваливается с появлением ног, а деградирует с помощью того же явления.
Апоптоз незаменим при предотвращении развития раковых опухолей.
Во время нашей обычной жизни огромное количество клеток в организме претерпевают патологические изменения и перерождаются в потенциально раковые клетки.
Соседние клетки, как и бабушки на скамейки около подъезда, внимательно следят за своими соседями и при неадекватном поведении посылают клетке сигнал апоптоза еще до того, как она размножится и станет опасна.
Собственно по этой причине за последние 20 лет сильно возрос интерес к апоптозу, как средству для предотвращения и борьбы со злокачественными опухолями.
Источник: matveychev-oleg.livejournal.com
Некроз
– это посмертные изменения клетки необратимого характера, заключающиеся в постепенном ферментативном разрушении и денатурации ее белков. Он развивается при чрезмерной альтерации клетки, не требует затрат энергии и не зависит от управляющих сигналов местного и центрального происхождения («анархических путь гибели»). Вследствие синтеза поврежденной клеткой БАВ (простогландины) и нарушения целостности ее мембран (выход различных ферментов), некроз представляет определенную угрозу окружающим структурам – это часто способствует развитию воспалительного процесса.
Насильственная гибель клетки обусловлена:
-
лишением ее питания и кислорода;
-
необратимыми изменениями структуры и функции с угнетением важнейших метаболических процессов различными патогенными агентами.
Некрозу предшествует глубокая, частично необратимая стадия повреждения клетки – некробиоз (рис. 1). Несмотря на многообразие этиологических факторов, провоцирующих в конечном счете развитие некробиоза и некроза, молекулярно-клеточные изменения, выявляемые при гибели клетки в большинстве случаев одинаковы (Зайчик А.Ш., Чурилов Л.П., 1999). Согласно их мнению, важно различать гипоксический и свободно-радикальный некробиоз. Механизмы свободно-радикального повреждения клетки (см. выше) могут запускаться без первичной гипоксии, а иногда даже в условиях его избытка. Гипоксический некробиоз (см. раздел «Гипоксия») инициируется различными патогенными факторами, вызывающих продолжительную гипоксию. Оба вида некробиоза могут комбинироваться и взаимно дополнять друг друга. Исходом обоих видов некробиоза являются такие повреждения клетки, при которых она уже неспособна к самостоятельному энергообеспечению (т. необратимости, рис. 1) и подвергается некрозу.
Некоторые исследователи иногда рассматривают некробиоз, как процесс собственной гибели клетки. По Давыдовскому И.В., некробиоз – это процесс отмирания клеток. Некроз же, в большей степени характеристика морфологическая, наблюдающаяся после гибели клетки, а не механизм самой гибели.
Различают две основные разновидности некроза:
-
коагуляционный (сухой) некроз. При нем в клетке развивается значительный ацидоз, идет коагуляция белков и отмечается повышенное накопление кальция с агрегацией элементов цитоскелета. Очень часто наблюдается при тяжелой гипоксии, например, в кардиомиоцитах при инфаркте миокарда. Данный некроз преимущественно развивается в тканях богатых белком и кальцием и характеризуется ранними и глубокими поражениями митохондрий;
-
колликвационный некроз. Для него типично преобладание гидролитических процессов лизосомального аутолиза или гетеролизиса при участии фагоцитов. Очаг некроза размягчен, наблюдается накопление активных гидроксильных радикалов и эндогенное омыление клеток, что приводит к разрушению ее структур, например различных мембран.
Между коагуляционным и колликвационным некрозоми четких границ нет. Возможно, это объясняется тем, что механизмы их развития во многом общие. Ряд исследователей выделяют и так называемый казеозный (творожистый) некроз (при туберкулезе), пологая при этом, что он представляет собой комбинацию двух предыдущих типов.
Апоптоз.
Апоптоз – это программированная клеточная смерть (инициирующаяся под действием вне- или внутриклеточных факторов) в развитии которой активную роль принимают специальные и генетически запрограммированные внутриклеточные механизмы. Он, в отличие от некроза активный процесс, требующий определенных энергозатрат. Первоначально пытались разграничить понятия «программированная клеточная гибель» и «апоптоз»: к первому термину относили устранение клеток в эмбриогенезе, а ко второму – программированную смерть только зрелых дифференцированных клеток. В настоящее время выяснилось, что никакой целесообразности в этом нет (механизмы развития клеточной гибели одинаковы) и два понятия превратились в синонимы, хотя это объединение и не бесспорно.
Прежде чем приступить к изложению материала о роли апоптоза для жизнедеятельности клетки (и организма) в норме и патологии, мы рассмотрим механизм апоптоза. Их реализацию можно представить в виде поэтапного развития следующих стадий:
1 стадия – стадия инициации (индукции).
В зависимости от происхождения сигнала, стимулирующего апоптоз, различают:
-
внутриклеточные стимулы апоптоза. Среди них к наиболее известным относят – разные виды облучения, избыток Н+, оксид азота, свободные радикалы кислорода и липидов, гипертермия и др. Все они могут вызывать различные повреждения хромосом (разрывы ДНК, нарушения ее конформации др.) и внутриклеточных мембран (особенно митохондрий). То есть в данном случае поводом для апоптоза служит «неудовлетворительное состояние самой клетки» (Мушкамбиров Н.П., Кузнецов С.Л., 2003). Причем, повреждение структур клеток должно быть достаточно сильным, но не разрушительным. У клетки должны сохраниться энергетические и материальные ресурсы для активации генов апоптоза и его эффекторных механизмов. Внутриклеточный путь стимуляции программированной смерти клетки можно обозначить как «апоптоз изнутри»;
-
трансмембранные стимулы апоптоза, т.е., в этом случае он активируется внешней «сигнализацией», которая передается через мембранные или (реже) внутриклеточные рецепторы. Клетка может быть вполне жизнеспособной, но, с позиции целостного организма или «ошибочной» стимуляции апоптоза, она должна погибнуть. Этот вариант апоптоза получил название «апоптоз по команде».
Трансмембранные стимулы подразделяются на:
-
«отрицательные» сигналы. Для нормальной жизнедеятельности клетки, регуляции ее деления и размножения необходимо воздействие на нее через рецепторы различных БАВ: факторов роста, цитокинов, гормонов. Среди прочих эффектов, они подавляют механизмы клеточной гибели. И естественно, дефицит или отсутствие данных БАВ активирует механизмы программированной смерти клетки;
-
«положительные» сигналы. Сигнальные молекулы, такие как ФНОα, глюкокортикоиды, некоторые антигены, адгезивные белки и др., после взаимодействия с клеточными рецепторами могут запускать программу апоптоза.
На клеточных мембранах находится группа рецепторов, в задачу которых передача сигнала к развитию апоптоза является основной, возможно даже единственной функцией. Это, например, белки группы DR (death receptos – «рецепторы смерти»): DR3, DR4, DR5. Наиболее хорошо изучен Fas-рецептор, появляющийся на поверхности клеток (гепатоцитах) спонтанно или под влиянием активации (зрелые лимфоциты). Fas-рецептор при взаимодействии с Fas-рецептором (лигандом) Т-киллера запускает программу смерти клетки мишени. Однако, взаимодействие Fas-рецептора с Fas-лигандом в областях, изолированных от иммунной системы, заканчивается гибелью самого Т-киллера (см. нижеигандом в областях, изолированных от иммунной системы, заканчивается гибелью самого Т-киллера ()ожно000000000000000000000000000).
Следует помнить, что некоторые сигнальные молекулы апоптоза, в зависимости от ситуации могут наоборот, блокировать развитие программированной смерти клеток. Амбивалентность (двойственное проявление противоположных качеств) характерна для ФНО, ИЛ-2, интерферона γ и др.
На мембранах эритроцитов, тромбоцитов, лейкоцитов, а так же клеток легкого и кожи обнаружены особые антигены-маркеры. На них синтезируются физиологические аутоантитела, и они, выполняя роль опсонинов, способствуют фагоцитозу этих клеток, т.е. гибель клеток происходит путемаутофагоцитоза. Выяснилось, что антигены-маркеры появляются на поверхности «старых» (прошедших свой путь онтогенетического развития) и поврежденных клетках, молодые и неповрежденные клетки их не имеют. Данные антигены получили название «антигены-маркеры стареющих и поврежденных клеток» или «белок третьей полосы». Появление белка третьей полосы контролируется геномом клетки. Следовательно, аутофагоцитоз можно рассматривать, как вариант запрограммированной гибели клеток.
-
Смешанные сигналы. Это сочетанное воздействие сигналов первой и второй группы. Например, апоптоз происходит с лимфоцитами, активированных митогоном (положительный сигнал), но не вступивших в контакт с АГ (отрицательный сигнал).
2 стадия – стадия программирования (контроля и интеграции механизмов апоптоза).
Для этой стадии характерно два, диаметрально противоположных процесса, наблюдающихся после инициации. Происходит либо:
-
реализация пускового сигнала к апоптозу через активацию его программы (эффекторами являются каспазы и эндонуклеазы);
-
блокируется эффект пускового сигнала апоптоза.
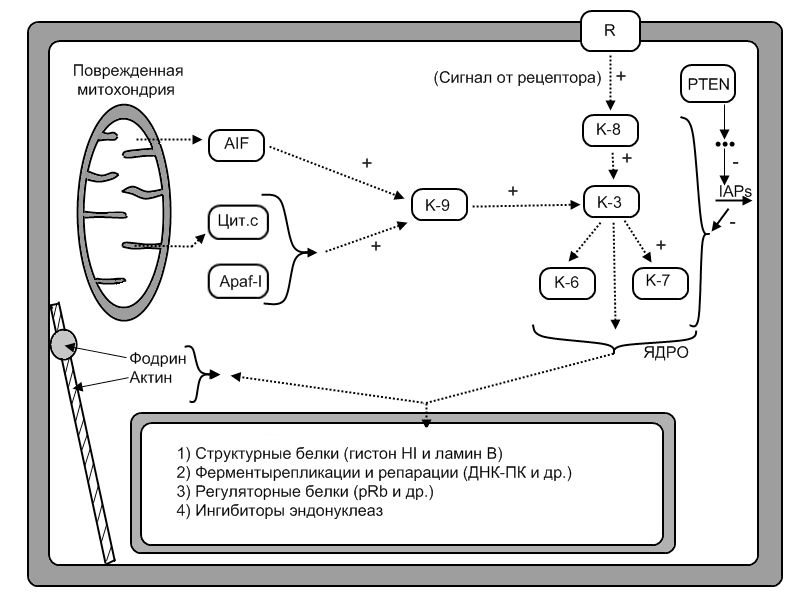
Различают два основных, но не исключающих друг друга, варианта исполнения стадии программирования (рис. 14):

Рис. 14. Каспазный каскад и его мишени
R– мембранный рецептор; К – каспазы;AIF– митохондриальная протеаза; Цит. С – цитохром с;Apaf-1 – цитоплазматический белок;IAPs– ингибиторы каспаз
1. Прямая передача сигнала (прямой путь активации эффекторных механизмов апоптоза минуя геном клетки) реализуется через:
-
адапторные белки. Например, так осуществляется запуск апоптоза Т-киллером. Он активирует каспазу-8 (адапторный белок). Аналогично может действовать и ФНО;
-
цитохром С и протеазу ΑIF (митохондриальная протеаза). Они выходят из поврежденной митохондрии и активируют каспазу-9;
-
гранзимы. Т-киллеры синтезируют белок перфорин, который образует каналы в плазмолемме клетки-мишени. Через эти каналы в клетку проникают протеолитические ферменты гранзимы, выделяемые все тем же Т-киллером и они запускают каскад каспазной сети.
2. Опосредованная передача сигнала. Она реализуется с помощью генома клетки путем:
-
репрессии генов, контролирующих синтез белков-ингибиторов апоптоза (гены Bcl-2, Bcl-XL и др). Белки Bcl-2 в нормальных клетках входят в состав мембраны митохондрий и закрывают каналы по которым из этих органоидов выходят цитохром С и протеаза AIF;
-
экспрессии, активации генов, контролирующих синтез белков-активаторов апоптоза (гены Bax, Bad, Bak, Rb, P53 и др.). Они, в свою очередь активируют каспазы (к-8, к-9).
На рис. 14 представлена примерная схема каспазного принципа активации каспаз. Видно, что откуда бы не запускался каскад, его узловым моментом является каспаза 3. Она активируется и каспазой 8 и 9. Всего в семействе каспаз – более 10 ферментов. Локализуются в цитоплазме клетки в неактивном состоянии (прокаспазы). Положение всех каспаз в данном каскаде до конца не выяснено, поэтому на схеме ряд из них отсутствует. Как только активируются каспазы 3,7,6 (возможно и их другие типы) наступает 3 стадия апоптоза.
3 стадия – стадия реализация программы (исполнительная, эффекторная).
Непосредственными исполнителями («палачами» клетки) являются выше указанные каспазы и эндонуклеазы. Местом приложения их действия (протеолиза) служат (рис. 14):
-
цитоплазматические белки – белки цитоскелета (фодрин и актин). Гидролизом фодрина объясняют изменение поверхности клетки – «гофрирование» плазмолеммы (появление на ней впячиваний и выступов);
-
белки некоторых цитоплазматических регуляторных ферментов: фосфолипазы А2, протеинкиназы С и др.;
-
ядерные белки. Протеолиз ядерных белков занимает основное место в развитии апоптоза. Разрушаются структурные белки, белки ферментов репликации и репарации (ДНК-протеинкиназы и др.), регуляторные белки (рRb и др.), белки-ингибиторов эндонуклеаз.
Иннактивация последней группы – белков ингибиторов эндонуклеаз приводит к активации эндонуклеаз, второму «орудию» апоптоза. В настоящее время эндонуклеазы и в частности, Са2+, Мg2+ -зависимая эндонуклеаза, рассматривается как центральный фермент программируемой смерти клетки. Она расщепляет ДНК не в случайных местах, а только в линкерных участках (соединительные участки между нуклеосомами). Поэтому хроматин не лизируется, а только фрагментируется, что определяет отличительную, структурную черту апоптоза.
Вследствие разрушения белка и хроматина в клетке формируются и от нее отпочковываются различные фрагменты – апоптозные тельца. В них находятся остатки цитоплазмы, органелл, хроматина и др.
4 стадия – стадия удаления апоптозных телец (фрагментов клетки).
На поверхности апоптозных телец экспрессируются лиганды, они распознаются рецепторами фагоцитов. Процесс обнаружения, поглощения и метаболизирования фрагментов погибшей клетки происходит сравнительно быстро. Это способствует избежать попадания содержания погибшей клетки в окружающую среду и тем самым, как отмечено выше, воспалительный процесс не развивается. Клетка уходит из жизни «спокойно», не беспокоя «соседей» («тихий суицид»).
Программированная клеточная гибель имеет важное значение для многих физиологических процессов. С апоптозом связаны:
-
поддержание нормальных процессов морфогенеза – запрограммированная смерть клеток в процессе эмбриогенеза (имплантации, органогенеза) и метаморфоза;
-
поддержание клеточного гомеостаза (в том числе ликвидация клеток с генетическими нарушениями и инфицированных вирусами). Апоптозом объясняется физиологическая инволюция и уравновешивание митозов в зрелых тканях и органах. Например, гибель клеток в активно пролиферирующих и самообновляющихся популяциях – эпителиоцитов кишечника, зрелых лейкоцитов, эритроцитов. Гормонально-зависимая инволюция – гибель эндометрия в конце менструального цикла;
-
селекция разновидностей клеток внутри популяции. Например, формирование антигенспецифической составляющей иммунной системы и управление реализацией ее эффекторных механизмов. С помощью апоптоза происходит выбраковка ненужных и опасных для организма клонов лимфоцитов (аутоагрессивных). Сравнительно недавно (Griffith T.S., 1997) показали значение программированной гибели клеток в защите «иммунологически привилегированных» зон (внутренние среды глаза и семенников). При прохождении гисто-гематических барьеров данных зон (что случается редко), эффекторные Т-лимфоциты гибнут (см. выше). Включение механизмов их смерти обеспечивается при взаимодействии Fas-лиганда барьерных клеток с Fas-рецепторами Т-лимфоцита, тем самым предотвращается развитие аутоагрессии.
Роль апоптоза в патологии и виды различных заболеваний связанных с нарушением апоптоза представлены в виде схемы (рис. 15) и таблицы 1.
Конечно, значение апоптоза в патологии меньше чем некроза (возможно, это связано с недостаточностью таких знаний). Однако, проблема его в патологии имеет и несколько иной характер: она оценивается по степени выраженности апоптоза — усиление или ослабление при тех или иных болезнях.
Источник: alexmed.info
Апоптоз — это генетически регулируемая программа клеточной гибели, которая имеет определенные морфологические критерии и биохимические маркеры. Эта программа очень важна для нормального развития многоклеточного организма, сохранения нормального числа полноценных и своевременного удаления поврежденных клеток.
Термин «апоптоз» (гр. аро — полное, ptosis — падение, утрата) предложил в 1972 году J. F. Kerr, заимствовав его у Гиппократа, назвавшего так осенний листопад.
Известно, что действие сильных повреждающих факторов вызывает некроз клетки. Гибель клетки в этом случае обусловлена избыточной внешней энергией (физической, химической или биологической), нарушающей ее внутриклеточный энергетический баланс и приводящей к потере структурной целостности.
В последние годы растет интерес к запрограммированной гибели клеток — апоптозу. Важно понимать, что фактор, вызывающий апоптоз, не обладает достаточной энергией для непосредственного повреждения клетки. Он лишь включает ее собственные механизмы самоуничтожения, т.е. апоптоз реализуется за счет внутренней энергии клетки и является таким же неотъемлемым свойством живого, как рост, пролиферация и размножение.
Возможности регуляции клеточной жизни всегда вызывали большой интерес биологов и врачей. Если процессы пролиферации являются достаточно изученными, то точка зрения на регуляцию разрушения (умирания) клеток пока еще не оформлена в окончательном виде в то же время при многих состояниях нарушения именно этой программы становятся определяющими для течения заболевания.
Апоптоз имеет четко выраженные и довольно хорошо изученные морфологические критерии: уменьшение размеров, сморщивание клетки, конденсация и фрагментация ядра, разрушение цитоскелета при сохранении целостности клеточной мембраны.
Апоптотические тельца
Когда процесс внутренней деградации завершен, клетка представляет собой совокупность фрагментов цитоплазмы, окруженных мембранами (т. н. апоптотические тельца). Изоляция внутриклеточного содержимого элементами цитолеммы является главной причиной отсутствия асептического воспаления при апоптозе. Таким образом, гибель клетки путем апоптоза (в отличие от некротической) переносится организмом относительно «безболезненно». В последующем апоптотические тельца фагоцитируются макрофагами, где макромолекулы погибшей клетки расщепляются до мономеров.
Сегодня установлено множество факторов, способных индуцировать апоптоз клетки. С другой стороны, некоторые воздействия могут повысить устойчивость к запрограммированной гибели (табл. 1).
|
I. Ингибиторы апоптоза |
|
Физиологические ингибиторы |
|
|
Гены вирусов |
|
|
Фармакологические агенты |
|
|
II. Индукторы апоптоза |
|
Физиологические активаторы |
|
|
Агенты, вызывающие повреждение |
|
|
Агенты, связанные с лечением каких-либо заболеваний |
|
|
Токсины |
|
В иммунной системе апоптоз выполняет по крайней мере две функции. Во-первых, апоптоз это эффекторный механизм иммунных реакций. Вторая функция апоптоза — регуляция иммунного ответа.
Эффекторный механизм иммунных реакций
см. Клеточная цитотоксичность
Регуляция иммунного ответа
Апоптоз иммунокомпетентных клеток является неотъемлемым компонентом иммунных реакций. Установлено, что селекция антигенспецифических Т- и В-лимфоцитов сопровождается массовой гибелью активированных, но антигеннеспецифических лимфоцитов. С другой стороны, результатом иммунного ответа является накопление избыточного количества антигенспецифических Т- и В-клеток, что ведет к нарушению генетически детерминированного баланса клеток макроорганизма. Выравнивание клеточного баланса после удаления патогена обусловлено именно запрограммированной гибелью большей части антигенспецифических лимфоцитов.
Цитоплазматический апоптоз
Как уже указывалось, апоптоз является внутренним свойством клетки, своеобразной ее реакцией на различные внешние раздражители. Поэтому неудивительно, что в любой клетке человеческого организма функционирует целая система цитоплазматического апоптоза (рис. 32), Информация о структуре компонентов этой системы содержится в геноме и передается от поколения к поколению. Указанную систему цитоплазматического апоптоза условно можно разделить на три части. Первая — это совокупность мембранных рецепторов, способных воспринимать проапоптотические сигналы из внутренней среды организма. Вторая — это комплекс цитоплазматических посредников, передающих воспринятый рецептором сигнал внутрь клетки к эффекторному звену. Третья — это эффекторное звено апоптоза, т.е. те компоненты, активация которых приводит к непосредственной гибели клетки.
Рецепторы апоптоза
Сегодня открыт целый ряд рецепторов, воспринимающих проапоптотические сигналы. Это Fas (CD95), TNF-R1 (рецептор 1-го типа к ФНО-α), DR3 (WS1-1), DR4 (TRAIL-рецептор 1), DR5 (1 RAIL-рецептор 2), DR6. Хотя указанные рецепторы приводят к одному и тому же биологическому эффекту, они относятся к разным семействам и поэтому отличаются по структуре. Так, Fas и TNF-R принадлежат к семейству рецепторов к ФF10, а молекулы DR — к антигенам гистосовместимости. Общность их биологического действия обусловлена природой молекул, связанных с цитоплазматической частью рецептора. Такие молекулы получили название доменов смерти Именно они и приводят к активации апоптоза. Наиболее изученными доменами смерти являются молекулы FADD и TRADD.
Ферменты апоптоза
Цитоплазматическими посредниками в системе апоптоза являются специальные ферменты, каспазы. Каспазы способны к последовательной активации друг друга, поэтому образуют своеобразный внутриклеточный каскад, включаемый доменами смерти. Домены смерти находятся на внутренней поверхности цитолеммы в неактивном состоянии. При активации рецептора, с которым функционально связан тот или иной домен, происходит изменение конформации обеих структур. Вследствие этого высвобождается активный центр домена, и он приобретает возможность взаимодействовать с каспазой 8 — инициатором всего каспазного каскада. Конечным компонентом этого каскада является каспаза 7. Именно этот фермент активирует латентную эндонуклеазу, оказывающую непосредственный повреждающий эффект на генетический материал клетки (разрывает ДНК в межнуклеосомных участках). Таким образом, эффекторным звеном системы апоптоза является латентная эндонуклеаза.
Митохондриальный апоптоз
Кроме цитоплазматических, в клетке содержится комплекс митохондриальных посредников апоптоза. Известно, что разрушение митохондриального аппарата приводит к неминуемой гибели клетки, поскольку последняя лишена энергетического обеспечения Для предотвращения некроза при повреждении митохондрий активируются указанные белки, обуславливающие более экономную апоптотическую гибель нежизнеспособной клетки. Таким образом, каскад апоптоза может реализовываться как по цитоплазматическому, так и по митохондриальному пути.
см. Регуляция апоптоза
Источник: wiki-med.com