Фагоцитоз это процесс
Уничтожение антигена макрофагом (фагоцитоз)
Механизмы иммунного ответа
Иммунный ответ по гуморальному типу без помощи Т-клеток
Иммунный ответ по гуморальному типу с помощью Т-хелперов
Иммунный ответ по клеточному типу (информация передается Т-хелперу)
Иммунный ответ по клеточному типу (фагоцитоз)

Фагоцитоз – это разновидность клеточного иммунитета, характеризующаяся распознаванием, поглощением и перевариванием фагоцитами различных чужеродных корпускулярных объектов.
Классификация фагоцитоза
В зависимости от нахождения клетки:
1. Внутрисосудистый
2. Тканевый
В зависимости от завершенности:
1. Завершенный
2. Незавершенный.
В зависимости от размеров фагоцитируемого объекта:
1. Истинный фагоцитоз – поглощение объектов размером 0,5 – 50 мкм,
2. Ультрафагоцитоз (размер объекта < 0,01 мкм),
3. Пиноцитоз (размер объекта < 0,001 мкм).
Классификация фагоцитов
1. По морфологическим и функциональным особенностям:
1. Микрофаги – нейтрофилы, эозинофилы, базофилы;
2. Макрофаги – моноциты крови и костного мозга, тканевые макрофаги (гистиоциты, купферовские клетки, альвеолярные, перитонеальные, плевральные, микроглиальные макрофаги, макрофаги селезенки, лимфатических узлов, костного мозга, остеокласты и др.).
2. По способности к активному передвижению:
1. Фиксированные – купферовские клетки печени, гистициты соединительной ткани, макрофаги костного мозга, лимфоузлов, синовиальных оболочек, ЦНС и др.;
2. Подвижные – макрофаги серозных полостей, воспалительных экссудатов, альвеолярные макрофаги, моноциты и др.

I – приближение фагоцита к объекту фагоцитоза;
II – аттракция;
III – поглощение объекта фагоцитом;
IV – умерщвление жизнеспособных объектов (стадия киллинга);
V – переваривание нежизнеспособных объектов.
1 стадия.Стадия приближения фагоцита к объекту фагоцитоза осуществляется за счет случайного столкновения фагоцита с чужеродным объектом в кровяном русле или направленного активного движения фагоцита к объекту фагоцитоза, которое называется положительным хемотаксисом.
Для осуществления процесса хемотаксиса необходимы следующие факторы: наличие на поверхности фагоцита рецепторов к хемоаттрактантам, энергии АТФ, способности фагоцита к активному передвижению, а также достаточного количества хемоаттрактантов.
В роли хемоаттрактантов могут выступать продукты специфических реакций в организме (компоненты комплемента – С3а, С5а, С567, лимфокины, цитофильные антитела, иммунные комплексы и др.), эндогенные неспецифические хемоаттрактанты, выделяющиеся из поврежденных или активированных клеток, в том числе из фагоцитов, (протеазы, протеиназы, эндотоксины, калликреин, плазминогенный активатор, IgG, коллаген, цАМФ и др.).
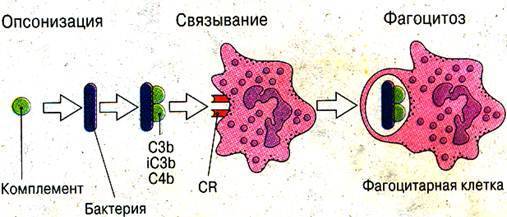
2 стадия.Стадия аттракции включает опсонизацию, распознавание и прикрепление фагоцита к объекту фагоцитоза.
Опсонизация– процесс адсорбции на поверхности чужеродного объекта опсонинов – веществ, являющихся молекулярными посредниками при взаимодействии фагоцитов с фагоцитируемым объектом. Опсонины облегчают распознавание и повышают интенсивность фагоцитоза.
Разновидности опсонинов:
1. Термолабильные опсонины (компоненты комплемента – С3в, С4в, α– и β-глобулины, коопсонин, С-реактивный белок, фибронектин и др.);
2. Термостабильные опсонины (IgG1, IgG3, IgM, агрегированные IgA1, IgA2 и др.);
3. Тафтсин – тетрапептид активного центра антител.
Распознавание фагоцитом объекта фагоцитоза осуществляется за счет наличия на поверхности фагоцита специфических (для IgG1 – 2, IgA, С3в, С4в, С5а и др.) и неспецифических рецепторов (для чужеродных химических структур).
Прикрепление фагоцита к объекту фагоцитоза обеспечивается взаимодействием рецепторов фагоцита с поверхностью чужеродного объекта и находящимися на ней опсонинами.
3 стадия.Стадия поглощения – активный энергозависимый процесс, заключающийся в последовательном охвате частицы псевдоподиями со всех сторон и погружении ее в цитоплазму фагоцита вместе с окружающим участком плазматической мембраны. Результатом стадии поглощения является формирование фагосомы, содержащей чужеродную частицу.
4 стадия.Стадия киллинга обеспечивается наличием у фагоцита факторов бактерицидности, которые выделяются в фагосому или в окружающую фагоцит среду, что может обеспечить дистантный бактерицидный эффект.
Классификация бактерицидных факторов фагоцитов.
I. Кислородзависимые:
1. Миелопероксидаза;
2. миелопероксидазнезависимые факторы – продукты «дыхательного взрыва», возникающего при активации фагоцитов (Н2О2, супероксидный анион-радикал, гидроксильный радикал, синглетный кислород, галогены и др.).
II. Кислороднезависимые:
1. Лизоцим;
2. Лактоферрин;
3. Щелочная фосфатаза;
4. Катионные белки;
5. Кислая среда фагосомы (рН до 4,5).
5 стадия.Стадия переваривания возможна только в том случае, если фагоцитируемый объект утратил жизнеспособность. Переваривание обусловлено выделением в фагосому содержимого лизосом фагоцита. Лизосомы содержат около 60 различных ферментов – гидролаз (протеазы, липазы, фосфолипазы, эластазы, коллагеназы, ДНК-азы, РНК-азы, амилазы, глюкозидазы и др.). В результате слияния лизосом и фагосом формируется фаголизосома, в которой происходит окончательная деградация компонентов чужеродного объекта. При этом гибнут и сами фагоциты. Продукты их разрушения стимулируют процессы пролиферации.
Источник: studopedia.su
ФАГОЦИТОЗ (phagocytosis, греческий phagos пожирающий -j- kytos вместилище, здесь — клетка + -osis) — процесс узнавания, активного захвата и поглощения микроорганизмов, разрушенных клеток и инородных частиц специализированными клетками иммунной системы.
Объектом фагоцитоза являются микробы, чужеродные и измененные собственные клетки или их фрагменты, комплексы антиген — антитело и др. Неотъемлемую часть фагоцитоза составляет направленное движение — хемотаксис (см. Таксисы) — фагоцитов к месту локализации чужеродной частицы.
Определение эффективности фагоцитоза проводится для оценки состояния иммунобиологической реактивности организма, а также при различных медико-биологических исследованиях.
Явление фагоцитоза как биологической универсальной реакции одноклеточных, многоклеточных и высших организмов было открыто И. И. Мечниковым, который в 1883 году сформулировал теорию фагоцитоза. И. И. Мечников рассматривал фагоцитоз как одну из форм питания клеток (начиная с простейших). У высокоорганизованных организмов эта форма питания свойственна особым мезенхимальным клеткам-фагоцитам поглощающим и убивающим патогенные микробы и таким образом выполняющим защитную функцию. Именно с функцией этих клеток И. И. Мечников связывал иммунитет к возбудителям инфекционных болезней. Им были описаны фазы фагоцитарного процесса и состояние активации фагоцитов, характеризующееся их новыми свойствами и усиленной способностью поглощать и уничтожать бактерии. Ключевая роль фагоцитов была доказана им в иммунитете, при воспалении, удалении поврежденных клеток, регенерации, атрофии, старении.
К фагоцитам относятся гранулоциты, в основном нейтрофильные лейкоциты (см.), и мононуклеарные фагоцитирующие клетки (см. Система мононуклеарных фагоцитов), например, моноциты, макрофаги и др. В процессе узнавания фагоцитами микробов, веществ и частиц большую роль играют особые компоненты сыворотки крови, которые являются молекулярными посредниками при взаимодействии микробов с фагоцитами и обусловливают усиление фагоцитоза.
и компоненты называются опсонинами (см.), к ним относятся антитела IgGl, IgG3, IgM, агрегированные IgAl и IgA2 (см. Иммуноглобулины), и термолабильные субкомпоненты комплемента, в основном СЗЬ (см. Комплемент), а также а-1 и р-глобулины, сывороточный а2— HS-гликопротеид. Указывают на опсонизирующие свойства С-реактивного белка (см.) и др. Антитела IgG и IgM специфически связываются с антигенами соответствующих бактерий и через Fc-рецепторы фиксируют их к рецепторам фагоцитов. Фагоциты могут соединяться с объектом фагоцитоза и неспецифически — через гидрофобные связи Ван-дер-Ваальса. Субкомпоненты комплемента, возникающие при классическом или альтернативном пути его активации, сорбируются на объектах фагоцитоза , прикрепление которых к поверхности фагоцита осуществляется через СЗЬ-и С4Ь-рецепторы.
Опсонизированные и неопсонизированные частицы прикрепляются к фагоцитам также с помощью специфических Fc-рецепторов для IgE, гликопротеидов и полисахаридов и неспецифических рецепторов для чужеродных веществ. Большинство нейтрофилов человека содержат Fc-рецепторы для агрегированного IgGl и IgG3, а возможно и для агрегированного I g А; моноциты — рецепторы для IgGl и IgG3. Рецепторы для комплемента высокоаффинны (обладают высокой прочностью соединения), они обеспечивают прилипание опсонизированных частиц к неактивированным макрофагам, поглощают же такие частицы только активированные клетки. На нейтрофилах найдены рецепторы для СЗЬ-, С4Ь- и С5а-субкомпонентов комплемента, на макрофагах — один рецептор для СЗЬ- и С4Ь-, другой — для СЗЬ- и СЗс1-субкомпонентов комплемента.
ли частица опсонизирована иммуноглобулином и комплементом, связывание с фагоцитом осуществляется кооперативно через специфические к ним рецепторы, что значительно активирует ее поглощение. Имеются различия между классами рецепторов и опосредуемыми ими реакциями фагоцитоза. Посредством неспецифических и специфических для гликопротеидов и полисахаридов рецепторов осуществляется фагоцитоз бактерий без опсонинов. Известен фагоцитоз инертных частиц — кремнезема, угля и др.
Опсонины не только прикрепляют объект фагоцитоза к поверхности фагоцитов, но и активируют их, индуцируя сигналы, идущие от плазматической мембраны, опосредованно вызывают активацию разных гуморальных систем организма, усиливая фагоцитоз.
Процесс поглощения опсонизированной частицы начинается с взаимодействия рецепторов фагоцита с опсонинами, локализованными на поверхности частицы. В дальнейшем происходит взаимодействие соседних свободных рецепторов фагоцита с близлежащими свободными опсонинами частицы до тех пор, пока не будут связаны все опсонины, покрывающие частицу на периферии, и она полностью не погрузится в цитоплазму фагоцита вместе с окружающим участком плазматической мембраны, образуя фагосому. Взаимодействие частицы с плазматической мембраной фагоцита посредством образующихся комплексов опсонин-рецептор запускает сложный механизм фагоцитоза, основная роль в котором принадлежит работе сократительных белков.
оцесс поглощения начинается с образования псевдоподии — вытягивания участка цитоплазмы фагоцита в направлении частицы. При формировании псевдоподии находящиеся в ней неориентированные актиновые нити (филаменты) становятся параллельными, что сопровождается преходящим изменением вязкости цитоплазмы. Сформулирована гипотеза жесткости (желатинизации) — сокращения цитоплазмы, изменяющего ее состояние и генерирующего механическую силу движения фагоцита, регулируемого ионами кальция. При желатинизации актиновые нити перекрестно связываются актинсвязывающим белком, превращающим цитоплазму в гель вследствие образования актиновой решетки. Этот процесс подавляется особЫхМ кальцийзависимым актин-регуляторным белком — гельсолином, являющимся физиол. регулятором желатинизации актина. Далее миозин образует перекрестные мостики с актином и гель начинает сокращаться, особенно в присутствии ионов магния, АТФ и кофактора, являющегося киназой, фосфорилирующей тяжелую цепь миозина. В месте контакта плазматической мембраны и частицы возрастает жесткость цитоплазматических структур (желатинизация участка цитоплазмы). Процесс идет непрерывно; постоянно из плазматической мембраны выделяется растворимый актинсвязывающий белок и мембрана движется по направлению к частице. В области прилипания частицы к плазматической мембране возрастает концентрация ионов кальция, которые «растворяют» актиновую решетку, снижают в этом участке жесткость цитоплазмы, и она движется в сторону повышенной жесткости на конце псевдоподии, т. к. нити миозина натягивают актиновые нити в направлении области наибольшей жесткости решетки.
В процессе фагоцитоза у нейтрофилов потребляется энергия, запасенная в виде АТФ, образованной в результате реакции гликолиза (см.). У альвеолярных макрофагов энергия для фагоцитоза в большей степени (возможно, в основном) извлекается из АТФ, образованной в процессе окислительного фосфорилирования (см. Окисление биологическое). Установлено, что метаболическим показателем в макрофагах является не абсолютное содержание АТФ, а скорость обновления. Количество АТФ в фагоцитирующих макрофагах частично поддерживается путем фосфорилирования АДФ за счет креатинфосфата (см. Креатин), которого в макрофагах в 3—5 раз больше, чем АТФ, и потребление существенно возрастает при фагоцитозе. Креатинфосфат в макрофагах служит, таким образом, важнейшим резервом и поставщиком химической энергии для фагоцитоза.
Фагоцитоз сопровождается метаболическим, или дыхательным, взрывом, проявляющимся повышением потребления кислорода и окисления глюкозы через гексозомонофосфатный шунт (см. Углеводный обмен). При этом образуются основные продукты восстановления кислорода — супероксидный анион и перекись водорода за счет окисления никотин-амидаденин-динуклеотидов и никотинамидаденин-динуклеотидфосфатов с помощью соответствующих НАДН- и НАДФН-оксидаз; накапливающиеся окисленные коферменты вызывают усиление гексозомонофос-фатного шунта за счет их восстановления с помощью глюкозо-6-фосфат-II 6-фосфоглюконат-дегидрогеназ.
гоциты имеют сложную систему для разрушения перекиси водорода. Эта система защищает компоненты клетки от разрушения и представлена каталазой, миелопероксидазой, глутатион-пероксидазой, восстановленным глутатионом. Дыхательный взрыв сопровождается усилением метаболизма углеводов, липидов, синтеза РНК, повышением уровня циклического гуанозинмонофосфата, снижением синтеза белка и транспорта аминокислот.
После завершения поглощения частицы возникшая фагосома и первичные лизосомы (см.), первичные азурофильные и вторичные специфические гранулы фагоцитов взаимно сближаются и сливаются, образуя фаголизосому. Этот процесс сопровождается исчезновением в фагоцитах изолированных гранул. Из лизосом в фагосому попадает большое количество гидролитических ферментов. Фагоцитоз также связан с секрецией из фагоцитов ряда ферментов — (З-глюкуронидазы, N-ацетил-Р-глюкозаминидазы, кислой и щелочной фосфатазы, катепсина, миелопероксидазы, лактоферрина, плазминогенного активатора. Подобная секреция сопряжена с активацией гексозомоно-фосфатного шунта и длится значительно дольше, чем непосредственно процесс фагоцитоза.
После проникновения бактерий внутрь фагоцитов начинает функционировать сложный микробоцидный механизм, представленный антимикробными системами, как требующими кислорода, так и не зависящими от него. Антимикробная система, требующая кислорода, функционирует в двух вариантах — с участием и без участия миелопероксидазы. Вариант с участием миелопероксидазы высокоактивен в отношении бактерий, грибков, мико-илазм и вирусов. Взаимодействие миелопероксидазы и перекиси водорода сопровождается образованием окислителей, окислением галоидов и галогенизацией, заключающейся в иодировании, хлорировании, бронировании различных бактериальных компонентов, что приводит к гибели бактерий. При описанных реакциях образуются бактерицидные ионы хлора, иода, хлорамины, нитриты, бактерицидные альдегиды, синглетный кислород, которые блокируют многие ферментные системы бактерий. Не зависящий от миелопероксидазы вариант аштшикробной системы фагоцитов вызывает образование токсичных для микробов промежуточных форм восстановленного кислорода — супероксидного аниона, перекиси водорода, гидроксильного радикала и синглетного кислорода. Наиболее активна из них перекись водорода.
К антимикробной системе фагоцитоза, не зависящей от кислорода, относят: лизоцим (см.), расщепляющий пептидогликаны клеточных стенок некоторых грамположительных бактерий до дисахаридов, состоящих из мураминовой кислоты и глюкозамина; лактоферрин, который в ненасыщенной железом форме оказывает микробостатическое действие в фагосомах за счет связывания железа, являющегося ростовым фактором для ряда из них; различные катионные белки. Определенное бактерицидное действие оказывает также формирующееся в фаголизосомах глубокое закисление до pH 6,5—3,75.
Закисление, кроме того, активирует лизосомальные гидролазы первичных лизосом, неактивные при слабощелочном pH.
Микробоцидные системы фагоцитов функционируют в кооперации. Они обладают различной потенцией, но все вместе оказывают взаимоперекрывающее действие, поэтому обладают высокой надежностью и эффективностью даже при дефектах фагоцитоза.
При нарушении хемотаксиса фагоцитоз бактерий подавлен, что способствует развитию и злокачественному течению ряда инфекционных болезней. Вещества, индуцирующие хемотаксис, называются хемоаттрактантами и подразделяются на несколько групп: 1) продукты специфических, в основном иммунологических реакций,— СЗа-, С5а-субкомпоненты комплемента, активированный комплекс G567, СЗ-конвертаза альтернативного пути активации комплемента, лимфокины (см. Медиаторы клеточного иммунитета), трансферфактор лимфоцитов, цитофильные антитела; 2) неспецифические эндогенные хемо-аттрактанты — продукты поврежденных клеток, калликреин (см. Кинины), плазминогенный активатор, фибринопептид В, гидролизованные или агрегированные IgG, коллаген, а- и Р-казеин молока, циклический аденозинмонофосфат и др.; 3) экзогенные хемоаттрактанты — фрагменты белка бактерий, содержащие N-формилметионин, пептиды, липиды или липопротеиды, выделяющиеся в процессе жизнедеятельности бактерий в организме.
На поверхности фагоцитов обнаружены специфические рецепторы для хемоаттрактантов — эйкозатетраеновой кислоты, синтетических формил-метионил-пептидов, С5а-субком-понента кохмплемента. По-видимому, число этих рецепторов неодинаково у разных типов фагоцитов, напр, циркулирующие нейтрофилы кролика в 8 раз слабее связывали хемотаксические пептиды, чем перитонеальные нейтрофилы. Доказана реакция сократительной системы клетки на действие хемоаттрактантов. Ее ориентация на градиент хемоаттрактантов обусловлена работой микротрубочек, выполняющих роль цитоскелета клетки,— они поддерживают поляризованную вытянутую на градиент хемоаттрактантов форму клетки. Однако непосредственно движение фагоцита осуществляет система микрофиламентов. Предполагают, что белки крови — альбумин и IgG являются регуляторами локомоторной функции фагоцитов. Активация фагоцитов хемоаттрактантами во многом сопровождается теми же изменениями, которые происходят при фагоцитозе — метаболическим взрывом, секрецией из клеток ферментов и др. Определенная регулирующая роль принадлежит циклическим нуклеотидам: циклический аденозинмонофосфат подавляет, а циклический гуанозинмоно-фосфат стимулирует хемотаксис.
Способы и методические подходы к оценке фагоцитоза разнообразны и зависят от конкретных задач исследования. Они позволяют определить эффективность процессов поглощения частиц, гибели и переваривания живых микроорганизмов и метаболические изменения фагоцитов. Важные данные о фагоцитозе могут быть также получены при исследовании хемотаксиса и опсонизации.
Для оценки фагоцитоза используют различные микроорганизмы — стафилококки (см.), эшерихии (см.), сальмонеллы (см. Сальмонелла) и др. Используют как живые, так и убитые микробы, но поскольку живые бактерии нередко выделяют токсические продукты, подавляющие фагоцитоз, лучше использовать убитые.
Фагоцитоз усиливается в присутствии сыворотки, опсонизирующей бактерии. Для усиления и стандартизации фагоцитоза используют предопсонизацию, то есть предварительную (до фагоцитоза) обработку микроба опсонинами — специфическими антителами — либо свежей сывороткой, в которой микробы активируют систему комплемента и адсорбируют появляющиеся субкомпоненты комплемента, облегчающие фагоцитоз. Однако в экспериментах с живыми микробами применяют лишь те, которые не убиваются опсонизирующей сывороткой. Скорость фагоцитоза анализируют при совместном инкубировании фагоцитов и живых бактерий. Через разные промежутки времени забирают пробы, с помощью дифференциального центрифугирования освобождаются от фагоцитов и надосадочную жидкость сеют на чашки с агаром, что позволяет определить уменьшение числа живых бактерий в процессе фагоцитоза. При работе с грибками рода Candida препарат просчитывают в камере Горяева, определяя при этом число внеклеточно расположенных грибков.
Для анализа фагоцитоза путем определения процента фагоцитов, поглотивших бактерии (фагоцитарный индекс Гамбургера), или среднего числа бактерий, поглощенных одним фагоцитом (фагоцитарное число Райга), скорости фагоцитоза используют частицы латекса, крахмала, зимозана, кармина, угля и др. Предложен метод исследования фагоцитоза, при котором используют капельки парафинового масла, содержащего специальный краситель и стабилизированного белком. Поглощенный материал определяют спектрофотометрически (см. С пектрофотометрия). Также используют частицы или микробы, меченные радиоактивными изотопами (см. Меченые соединения). Метод характеризуется быстротой выполнения, однако не позволяет полностью избавиться от прилипших бактерий, что завышает показатели фагоцитоза. Другой вариант состоит в добавлении к среде с фагоцитами и частицами меченых сывороточных белков, которые при фагоцитозе попадают в фагосому, что позволяет оценить количественно интенсивность фагоцитоза. Применяют также ксеногенные интактные или сингенные поврежденные или опсонизированные эритроциты, анализируя их поглощение визуально или по выходу гемоглобина.
При исследовании поглощения живых бактерий, особенно с последующим учетом количества убитых бактерий необходимо удалить с поверхности фагоцитов прилипшие микробы. Для этого применяют различные антибиотики, убивающие внеклеточные бактерии, но не проникающие в фагоциты, специальные препараты (фенилбутазан), прерывающие в определенные моменты фагоцитоза и внутриклеточную инактивацию микробов. Разработан метод, позволяющий различать прилипшие и поглощенные убитые грибки рода Candida по окраске препарата трипановым синим.
Гибель и переваривание поглощенных микробов выявляют путем инкубирования суспензии фагоцитов с микробами, последующего отмывания фагоцитов of прилипших микробных клеток, подсчета живых микробов, оставшихся в пробах фагоцитов, забираемых в различные сроки инкубации. Число живых бактерий определяют серийными посевами из проб фагоцитов на чашки Петри с агаром. Число живых грибков подсчитывают в лизате фагоцитов после инкубации с помощью окрашивания метиленовым синим. Внутриклеточное переваривание бактерий изучают также с помощью включения в них 3Н-уридина. Для этого культуру фагоцитов, поглотивших бактерии, обрабатывают актиномицином D, добавляя в среду 3Н-уридин. Метка, включаясь в живые внутриклеточные бактерии, не попадает в убитые и фагоциты.
Анализ повреждающего действия фагоцитов на микробы можно проводить по степени окрашивания поглощенных микробов красителями или по окраске метиленовым синим фаголизосом фагоцитов. Завершенность фагоцитоза оценивают по отношению среднего числа убитых микробов к живым или числа фагоцитов с переваренными микробами к общему числу фагоцитирующих фагоцитов, а также по проценту разрушенных микробов от числа фагоцитированных или по среднему числу убитых микробов на один фагоцит. Выраженность метаболических изменений при фагоцитозе анализируют по потреблению кислорода, хемилюминесценции, окислению глюкозы, иодированию и др.
Фагоциты играют ключевую роль в формировании противомикробного иммунитета (см. Иммунитет), обусловленного как специфическими, так и неспецифическими факторами защиты. Несмотря на то, что специфический иммунитет опосредуется специфическими Т-клетками, а также специфическими антителами, опсонизирующими бактерии и усиливающими фагоцитоз, элиминация патогенных бактерий осуществляется неспецифически — фагоцитами, активированными лимфокинами специфических Т-лимфоцитов. Активированные фагоциты значительно эффективнее убивают бактерии, что показал еще И. И. Мечников. Естественная невосприимчивость к возбудителям инфекционных болезней также обусловлена в основном фагоцитарными клетками. Ключевая роль принадлежит им и в детоксикации бактериальных токсинов, нейтрализованных антителами.
Макрофаги, перерабатывая антиген и представляя его лимфоцитам, участвуя в межклеточной кооперации, активации и супрессии пролиферации лимфоцитов, являются необходимым звеном в формировании иммунологической толерантности (см. Толерантность иммунологическая) и трансплантационного иммунитета (см. Иммунитет трансплантационный). Макрофаги участвуют в противоопухолевом иммунитете (см. Иммунитет противоопухолевый), оказывая цитостати-ческое и цитотоксическое действие на опухолевые клетки.
Повреждения фагоцитов различными иммуносупрессорами, бло-каторами (см. Иммунитет, Йммуподепрессивные вещества), ионизирующим излучением (см.) вызывают резкое подавление противомикробной устойчивости организма. При воздействии на животных большими дозами ионизирующего излучения фагоцитарная активность может практически исчезнуть. Нормализуется фагоцитарная активность у животных, как правило, после 20-го дня. У кроликов, облученных в дозе 600 рад (6 Гр), она восстанавливается только через 40 дней. Между дозой ионизирующего излучения и степенью подавления фагоцитоза существует корреляция. Дозы 10—75 рад (0,1 — 0,75 Гр) усиливают фагоцитоз гранулоцитов, а 350—600 рад (3,5—6 Гр)—резко его угнетают, причем снижается завершенность фагоцитоз, в 3—4 раза подавляется подвижность фагоцитов, а также уменьшается абсолютное их число. Эти же закономерности характерны для макрофагов, число и переваривающая способность которых при облучении также резко снижаются.
Выявлены болезни, сопровождающиеся первичными (врожденными) или вторичными (приобретенными) дефектами фагоцитоза. К ним относится так называемая хроническая гранулематозная болезнь, возникающая у детей, в фагоцитах которых из-за дефекта оксидаз нарушено образование перекисей и надперекпсей и, следовательно, процесс инактивации микробов. Сниженная способность к уничтожению бактерий выявлена у людей, нейтрофилы которых синтезируют недостаточное количество миелопероксидазы, глюкозо-б-фосфат-дегидрогеназы, пируваткиназы. Замедленная гибель микробов обнаружена у больных с синдромом Чедиака — Хигаси (см. Тромбоцитопатии), в нейтрофилах которых нарушено выделение в фагосому лизосомальных ферментов из-за дефекта системы микротрубочек. Описано нарушение процесса полимеризации актина, ведущее к замедлению поглощения частиц нейтрофилами и их подвижности. Больные с указанными дефектами фагоцитов часто страдают тяжелыми бактериальными и грибковыми инфекциями.
Первичные нарушения фагоцитоза наблюдаются и на уровне опсонинов, например, при врожденном дефиците СЗ- и С5-компонентов комплемента, который может привести к развитию рецидивирующих инфекций с поражением легких, костей, кожи.
Вторичные дефекты фагоцитоза описаны при заболеваниях соединительной ткани, почек, нарушении питания, вирусных и рецидивирующих бактериальных инфекциях.
Библиогр.: Берман В. М. и Слав-с к а я E. М, Завершенный фагоцитоз, Журн. микр., эпид. и иммун., № 3, с. 8, 1958; П о д о п р и г о р а Г. И. и Андреев В. Н. Современные методы изучения фагоцитарной активности лейкоцитов in vitro, там же, № 1, е. 19, 1976; X р а м-цов А. В. и Земсков В. М. Роль плазматической мембраны в активации лизосомальных ферментов, Докл. АН СССР, т. 271, № 1, с. 241, 1983; Handbook of experimental immunology, ed. by D. M. Weir, v. 2—3, Oxford a. o., 1979; Handbook of experimental pharmacology, ed. by J. R. Vane a. S. H. Ferreira, v. 50, pt 1, В. a. o., 1978; KlebanoffS. J. a. Clark R. A. The neutrophil, function and clinical disorders, Amsterdam a. o., 1978; Mononuclear phagocytes, Functional aspects, ed. by R. van Furth, pt 1 — 2, Hague a. o., 1980; The reticuloendothelial system, a comprehensive treatise, v. 1 — Morphology, ed. by H. Friedman a. o., N. Y.— L., 1980.
В. М. Земсков.
Источник: xn--90aw5c.xn--c1avg
Не все лейкоциты, вышедшие в очаг воспаления, способны к фагоцитозу. Такая способность свойственна нейтрофилам, моноцитам, макрофагам и эозинофилам, которые причисляют ктак называемым профессиональным, илиоблигатным (обязательным), фагоцитам.
В процессе фагоцитоза различают несколько стадий:
1) стадию прилипания (или прикрепления) фагоцита к объекту,
2) стадию поглощения объекта и
3) стадию внутриклеточного разрушения поглощенного объекта. Прилипание фагоцитов к объекту в отдельных случаях обусловлено
существованием на мембране фагоцитов рецепторов для молекул, входящих в состав микробной стенки (например, для углевода зимозана), или для молекул, появляющихся на поверхности собственных погибающих клеток. Однако в большинстве случаев прилипание фагоцитов к проникшим в организм микроорганизмам осуществляется при участии так называемых опсонинов — сывороточных факторов, которые попадают в очаг воспаления в составе воспалительного экссудата. Опсонины соединяются с поверхностью клетки микроорганизма, после чего к ней легко прилипает мембрана фагоцита. Главными опсонинами являются иммуноглобулины и фрагмент СЗЬ-комплемента. Свойствами опсонинов обладают также некоторые плазменные белки (например, С-реактивный белок) и лизоцим.
Феномен опсонизации можно объяснить тем, что молекулы опсонинов располагают по меньшей мере двумя участками, один из которых связывается с поверхностью атакуемой частички, а другой — с мембраной фагоцита, соединяя таким образом обе поверхности друг с другом. Иммуноглобулины класса в, например, связываются своими РаЬ-фрагментами с антигенами микробной поверхности, тогда какРс-фрагменты этих антител — с поверхностной мембраной фагоцитов, на которой имеются рецепторы для Рс-фрагментов !даниона, «отбирая» электрон от восстановленного пиридинового нуклеотида НАДФН:
оксидаза
202 + НАДФН -> 202- + НАДФ+ + Н + .
Расходуемые во время «респираторного взрыва» запасы НАДФН начинают немедленно восполняться усиленным окислением глюкозы через гексозомонофосфатный шунт.
Большая часть образующихся при восстановлении 02 супероксидных анионов 02_ подвергается дисмутации до Н202:
202" + 2Н+ 02 + Н202.
Некоторая часть молекул Н202 взаимодействует в присутствии железа или меди с супероксидным анионом с образованием чрезвычайно активного гидроксильного радикала ОН :
Цитоплазматическая НАДФ-оксидаза активируется в месте контакта фагоцита с микробом, а образование супероксидных анионов происходит на внешней стороне мембраны лейкоцитов, вне внутренней среды клетки. Процесс продолжается и после завершения образования фагосомы, вследствие чего внутри нее создается высокая концентрация бактерицидных радикалов. Проникающие внутрь цитоплазмы фагоцита радикалы нейтрализуются ферментами супероксиддисмутазой и каталазой.
Система образования бактерицидных метаболитов кислорода действует во всех профессиональных фагоцитах. В нейтрофилах совместно с ней действует еще одна мощная бактерицидная система — система миелолероксидазы (сходная с ней лероксидазная система имеется также у эозинофилов, но ее нет у моноцитов и макрофагов).
Миелолероксидаза — фермент, содержащийся в азурофильных гранулах нейтрофилов, катализирует реакцию между ионом галогена (обычно хлора) и перекисью водорода, что приводит к образованию хлорноватистой кислоты (гипохлоритного аниона ОС1~):
миелопероксидаза С1- + Н202 *ОС1~ + Н20.
Г ипохлорит оказывает выраженное бактерицидное действие сам по себе. Кроме того, он может реагировать с аммонием или аминами, образуя бактерицидные хлорамины.
Независящий от кислорода бактерицидный механизм связан с дегрануляцией — поступлением внутрь фагосомы бактерицидных веществ, которые содержатся во внутриклеточных гранулах фагоцитов.
Когда образование фагосомы завершается, к ней вплотную приближаются гранулы цитоплазмы фагоцитов. Мембрана гранул сливается с мембраной фагосомы, и содержимое гранул вливается внутрь фагосомы. Полагают, что стимулом к дегрануляции является увеличение цитозольного Са2+, концентрация которого возрастает особенно сильно вблизи фагосомы, где располагаются органеллы, накапливающие кальций.
Цитоплазматические гранулы всех облигатных фагоцитов содержат большое количество биологически активных веществ, способныхубивать и переваривать микроорганизмы и другие поглощенные фагоцитами объекты. В нейтрофилах, например, имеется 3 типа гранул:
— секреторные пузырьки;
— первичные (азурофильные);
— вторичные (специфические) гранулы.
Наиболее легко мобилизуемые секреторные пузырьки облегчают выход нейтрофилов из сосудов, их миграцию в тканях. Уничтожают и разрушают поглощенные частицы вещества азурофильных и специфических гранул. В азурофильных гранулах, помимо уже упомянутой миелопероксидазы, содержатся действующие независимо от кислорода низкомолекулярные бактерицидные пептиды дефенсины, слабое бактерицидное вещество лизоцим и множество разрушающих ферментов; в специфических гранулах лизоцим и белки, останавливающие размножение микроорганизмов, в частности, лактоферрин, связывающий необходимое для жизнедеятельности микроорганизмов железо.
На внутренней мембране специфических и азурофильных гранул находится протонный насос, который переносит водородные ионы из цитоплазмы фагоцита внутрь фагосомы. В результате рН среды в фагосоме понижается до 4—5, что вызывает гибель многих находящихся внутри фагосомы микроорганизмов. После того как микроорганизмы погибают, они разрушаются внутри фагосомы с помощью кислых гидролаз азурофильных гранул.
К числу важных бактерицидных факторов, действующих в активированных макрофагах, следует отнести и продукцию оксида азота (N0), которая осуществляется с помощью индуцибильной МО-синтазы. Фермент этот активируется у-интерфероном, фактором некроза опухолей, ИЛ-1-бета и другими воспалительными цитокинами. N0 действует цитостатически на опухолевые клетки, бактерии, паразиты, вирусы, ингибируя активность многих ферментов, участвующих в синтезе белков и нуклеиновых кислот. Оксид азота может соединяться с 02~, образуя пероксинитрит, который распадается на цитотоксические свободные радикалы ОН* и N0".
Не все живые микроорганизмы гибнут внутри фагоцитов. Некоторые, например, возбудители туберкулеза сохраняются, оказываясь при этом «отгороженными» мембраной и цитоплазмой фагоцитов от противомикробных лекарств.
Активированные хемоаттрактантами фагоциты способны высвобождать содержимое своих гранул не только внутрь фагосомы, но и во внеклеточное пространство. Это происходит во время так называемого незавершенного фагоцитоза — в тех случаях, когда потем или иным причинам фагоцит не может поглотить атакуемый объект, например, если размеры последнего значительно превышают размеры самого фагоцита или если объектом фагоцитоза являются комплексы антиген-антитело, находящиеся на плоской поверхности сосудистого эндотелия. При этом содержимое гранул и продуцируемые фагоцитами активные метаболиты кислорода воздействуют и на объект атаки, и на ткани организма хозяина.
Повреждение тканей хозяина токсичными продуктами фагоцитов становится возможным не только в результате незавершенного фагоцитоза, но и после гибели лейкоцитов или вследствие разрушения мембраны фагосомы самими поглощенными частичками, например частичками кремния или кристаллами мочевой кислоты.
Источник: xn--80ahc0abogjs.com