Иммунный фагоцитоз
Иммунитет (от лат. immunitas – «избавление», «освобождение от чего-либо») – это невосприимчивость организма к различным инфекционным агентам, а также продуктам их жизнедеятельности, веществам и тканям, которые обладают чужеродными антигенными свойствами (например, ядам животного и растительного происхождения). Однажды переболев, наш организм запоминает возбудителя болезни, поэтому в следующий раз заболевание протекает быстрее и без осложнений. Но часто после длительных заболеваний, оперативных вмешательств, при неблагоприятной экологической обстановке и в состоянии стресса иммунная система может давать сбои. Снижение иммунитета проявляется частыми и длительными простудами, хроническими инфекционными заболеваниями (ангиной, фурункулезом, гайморитом, кишечными инфекциями), постоянной повышенной температурой и т. д.
Если обобщить все вышеизложенное, то можно сказать, что иммунитет является способом защиты организма от живых тел и веществ, которые несут в себе признаки генетически чужой информации.
иболее древний и стабильный механизм взаимодействия ткани с любыми внешними повреждающими факторами среды (антигенами) – это фагоцитоз. Фагоцитоз в организме осуществляется специальными клетками – макрофагами, микрофагами и моноцитами (клетками-предшественниками макрофагов). Это сложный многоступенчатый процесс захвата и уничтожения всех попавших в ткани чужеродных для них микрообъектов, не трогая собственные ткани и клетки. Фагоциты, перемещаясь в межклеточной жидкости ткани, при встрече с антигеном захватывают его и переваривают до того, как он контактирует с клеткой. Этот механизм защиты был открыт И. М. Мечниковым в 1883 г. и был положен в основу разработанной им теории фагоцитной защиты организма от болезнетворных микробов. Установлено широкое участие макрофагов в различных иммунологических процессах. Кроме защитных реакций против различных инфекций, макрофаги участвуют в противоопухолевом иммунитете, распознавании антигена, регуляции иммунных процессов и осуществлении иммунного надзора, в распознавании и разрушении единичных измененных клеток собственного организма, в том числе опухолевых, в регенерации различных тканей и в воспалительных реакциях. Макрофаги также вырабатывают различные вещества, оказывающие противоантигенное воздействие. Фагоцитоз включает несколько стадий:
1) направленное движение фагоцита к чужеродному для ткани объекту;
2) прикрепление фагоцита к нему;
3) распознавание микроба или антигена;
4) поглощение его клеткой фагоцита (собственно фагоцитоз);
5) умерщвление микроба с помощью ферментов, выделяемых клеткой;
6) переваривание микроба.
Но в некоторых случаях фагоцит не может умертвить определенные виды микроорганизмов, которые даже способны размножаться в нем. Именно поэтому фагоцитоз не всегда может обеспечить защиту организма от повреждения.
Данный текст является ознакомительным фрагментом.
Источник: med.wikireading.ru
Что такое фагоцитоз?
Фагоцитоз — это процесс, при котором клетка связывается с необходимой частицей на поверхности, а затем обволакивает и погружает ее в внутрь. Процесс фагоцитоза часто происходит, когда клетка пытается уничтожить что-то, например вирус или инфицированную клетку, и часто используется клетками иммунной системы.
Фагоцитоз не произойдет, если клетка не находится в физическом контакте с частицей, которую она хочет поглотить. Рецепторы клеточной поверхности, используемые для фагоцитоза, зависят от типа клетки. Это самые распространенные из них:
- Рецепторы опсонинов: используются для связывания бактерий или других частиц, которые были покрыты иммуноглобулиновыми G (или IgG) антителами иммунной системой. Иммунная система покрывает потенциальные угрозы в антителах, чтобы другие клетки знали, что их нужно уничтожить. Также, иммунная система может использовать группу сложных белков для маркировки бактерий, называемых системой комплемента. Система комплемента — еще один способ иммунной системы уничтожать патогены и угрозы для организма.
- Рецепторы мусорщики: связываются с молекулами, которые продуцируются бактериями. Большинство бактерий и клеток производят матрицу протеинов, окружающих себя (называемую «внеклеточным матриксом»). Матрикс является идеальным способом для иммунной системы идентифицировать чужеродные виды в организме, поскольку клетки человека не продуцируют одну и ту же белковую матрицу.
- Толл-подобные рецепторы: рецепторы, названные в честь аналогичного рецептора у плодовых мух, кодируемых геном Toll, которые связываются с определенными молекулами, продуцируемыми бактериями. Толл-подобные рецепторы являются ключевой частью врожденной иммунной системы, так как будучи связанными с бактериальным возбудителем, они распознают специфические бактерии и активируют иммунный ответ. Существует множество различных типов Толл-подобных рецепторов, продуцируемых организмом, все из которых связывают разные молекулы.
- Антитела: некоторые иммунные клетки образуют антитела, связывающие с конкретными антигенами. Это процесс, сходный тому, как подобные рецепторы распознают и идентифицируют, какой тип бактерий заражает хозяина. Антигены — это молекулы, действующие как патогенная «визитная карточка», потому что они помогают иммунной системе понять с какой угрозой она имеет дело.
Как происходит фагоцитоз?
Чтобы осуществить процесс фагоцитоза, клетки должны выполнить несколько последовательных действий. Имейте в виду, что различные типы клеток выполняют фагоцитоз по разному.
- Вирус и клетка должны вступить в контакт друг с другом. Иногда иммунная клетка случайно попадает в вирус в кровотоке. В других случаях клетки перемещаются посредством процесса, называемого «хемотаксис». Хемотаксис означает движение микроорганизма или клетки в ответ на химический стимул. Многие клетки иммунной системы движутся в ответ на цитокины, небольшие белки, используемые специально для передачи сигналов в клетке. Цитокины сигнализируют клеткам перемещаться в определенную область тела, где обнаружена частица (в нашем случае, вирус). Это характерно для инфекций определенной области (например, рана кожи, пораженная бактериями).
- Вирус связывается с рецепторами на клеточной поверхности макрофага. Помните, что разные типы клеток экспрессируют разные рецепторы. Некоторые рецепторы являются общими, а это означает, что они могут идентифицировать самопроизвольную молекулу по сравнению с потенциальной угрозой, в то время как, другие очень специфичны, например, схожие с подобными рецепторами или антителами. Макрофаг не инициирует фагоцитоз без успешного связывания рецепторов клеточной поверхности.
- Вирусы также могут иметь поверхностные рецепторы, специфичные для вирусов на макрофаге. Вирусы должны получить доступ к цитоплазме или ядру клетки-хозяина, чтобы реплицировать и вызывать инфекцию, поэтому они применяют свои поверхностные рецепторы для взаимодействия с клетками иммунной системы и используют иммунный ответ для входа в клетку. Иногда, когда вирус и клетка-хозяин взаимодействуют, клетка-хозяин может успешно уничтожить вирус и остановить распространение инфекции. В других случаях клетка-хозяин поглощает вирус, который начинает реплицироватся. Как только это произойдет, инфицированная клетка идентифицируется и уничтожается другими клетками иммунной системы, чтобы остановить вирусную репликацию и распространение инфекции.
- Макрофаг начинает вращаться вокруг вируса, поглощая его в карман. Вместо того, чтобы перемещать большой элемент через плазматическую мембрану, который может повредить ее, фагоцитоз использует инвагинацию, чтобы захватить частицу внутрь, обволакивая ее вокруг. Инвагинация — это действие сгибания внутрь себя, чтобы сформировать полость или мешочек. Клетка захватывает вирус внутрь, создавая карманное углубление без повреждения плазматической мембраны. Помните, что клетки являются достаточно гибкими и текучими.
- Захваченный вирус полностью закрывается в виде пузырьковой структуры, называемой «фагосом», внутри цитоплазмы. Губы кармана, образованные в результате инвагинации, стягивают друг к другу, чтобы закрыть зазор. Это действие создает фагосому, где плазменная мембрана перемещается вокруг частицы, безопасно помещая ее внутри клетки.
- Фагосомы сливаются с лизосомой, становясь «фаголисосомой». Лизосомы также являются пузырчатыми структурами, подобными фагосомам, которые обрабатывают отходы внутри клетки. Для лучшего понимание функций лизосомы, приставка «Лизис» означает разделение или растворение. Без слияния с лизосомой, фагосома не способна ничего сделать с содержимым внутри.
- Фаголисосома понижает pH, чтобы разрушить свое содержимое. Лизосома или фаголисосома способны разрушать вещество внутри себя, резко снижая рН внутренней среды. Снижение рН делает окружающую среду в фаголисосоме очень кислой. Это эффективный способ убить или нейтрализовать все, что находится внутри фаголизосомы, чтобы не допустить заражение клетки. Некоторые вирусы фактически используют пониженный рН, чтобы вырваться из фаголисосомы и начать реплицировать внутри клетки. Например, грипп использует снижение рН для активации конформационного изменения, что позволяет ему выйти в цитоплазму.
- После того, как содержимое было нейтрализовано, фаголизосома образует остаточное тело, которое содержит отходы из фаголисосомы. Остаточное тело в конечном итоге выводится из клетки.
Фагоцитоз и иммунная система
Фагоцитоз является важной составляющей иммунной системы. Несколько типов клеток иммунной системы выполняют фагоцитоз, такие как нейтрофилы, макрофаги, дендритные клетки и В-лимфоциты. Действие фагоцитирующих патогенных или посторонних частиц позволяет клеткам иммунной системы знать, с чем они борются. Зная врага, клетки иммунной системы могут специально нацеливаться на похожие частицы, циркулирующие в организме.
Другой функцией фагоцитоза в иммунной системе является поглощение и уничтожение патогенов (таких как вирусы или бактерии) и инфицированных клеток. Уничтожая инфицированные клетки, иммунная система ограничивает скорость распространения и размножения инфекции. Ранее мы упоминали, что фаголисосома создает кислотную среду для уничтожения или нейтрализации своего содержимого. Клетки иммунной системы, которые выполняют фагоцитоз, могут также использовать другие механизмы для уничтожения патогенов внутри фаголисомы, таких как:
- Кислородные радикалы: высокореактивные молекулы, которые реагируют с белками, липидами и другими биологическими молекулами. Во время физиологического стресса количество кислородных радикалов в клетке может резко увеличиваться, вызывая окислительный стресс, способный разрушать клеточные структуры.
- Оксид азота: реакционноспособное вещество, подобное кислородным радикалам, которое реагирует с супероксидом, чтобы создать дополнительные молекулы, повреждающие различные типы биологических молекул.
- Антимикробные белки: белки, которые специфически повреждают или убивают бактерии. Примеры антимикробных белков включают протеазы, убивающие различные бактерии, уничтожая основные белки и лизоцим, атакующий клеточные стенки грамположительных бактерий.
- Антимикробные пептиды: схожи с антимикробными белками, поскольку также атакуют и убивают бактерии. Некоторые антимикробные пептиды, такие как дефенсины, атакуют мембраны бактериальных клеток.
- Связывающие белки: являются важными игроками врожденной иммунной системы, так как конкурируют с белками или ионами, которые в противном случае могут оказаться полезны для бактерий или вирусной репликации. Лактоферрин — связывающий белок, обнаруженный в слизистых оболочках, и связывает ионы железа, необходимые для роста бактерий.
Источник: NatWorld.info
Что же такое фагоцитоз?
В биологии есть термин «эндоцитоз». Процесс поглощения клеткой частицы, молекулы, другой клетки или бактерии. Если поглощается большая и твердая частица, то эндоцитоз и называют фагоцитозом.
Макрофаг vs микроб. Кто такой макрофаг?
Мир в котором мы живем — довольно грязное место. Так как и все в природе стремится к хаосу, так и в нашей жизни все стремится замусориться. Нужно постоянно следить за тем, чтобы в нашем доме всегда все было чисто и вещи лежали на своем месте.
Подобная ситуация происходит и в нашем теле.
стоянно происходит рождение и гибель новых клеток, каждый день и час в нашем организме в одной из клеток происходит генетический сбой — она становится раковой. В кишечнике проживают бактерии, постоянно проникающие в печень по воротной вене. Вирусы, бактерии, простейшие, старающиеся превратить наше тело в питательную среду…
Наша иммунная система работает постоянно, постоянно поддерживая порядок. Неотъемлемая часть этой системы — макрофаг.
Это амебоподобный организм (как слизеподобный добряк в «Охотниках за приведениями»). Задача макрофага — очистить организм от микроскопического мусора и бактерий. Родина макрофагов — костный мозг, предшественник — белая кровяная клетка — моноцит.
Живут макрофаги около полутора месяцев, в течение этого времени они патрулируют организм (в анализе крови смотрим сегментоядерные нейтрофилы, попадая в ткани, они становятся макрофагами).
Макрофаг — это большая лейкоцитарная клетка, которая является важной частью нашей иммунной системы. Слово «макрофаг» буквально означает «большой пожиратель».
Это амебоподобный организм, и его задача — очистить наш организм от микроскопических мусора и захватчиков. Макрофаг обладает способностью находить и «съедать» частицы, такие как бактерии, вирусы, грибы и паразиты.
Еще один увлекательный аспект макрофага — знать, какие клетки уничтожать, а какие оставить в покое. Здоровые клетки организма имеют рецепторы, которые дают сигнал «не ешь меня». Лимфоциты хелперы (помощники) вырабатывают антитела, которые фиксируются на возбудителе. Это уже другой сигнал для макрофага: «съешь меня».
Этапы фагоцитоза
Рассмотрим этот процесс на примере лейкоцитов (нейтрофилы — самые многочисленные из них), как клеток иммунной системы, поглощающих вредоносную бактерию. Ну, во-первых, лейкоцит должен четко понимать, что перед ним чужеродный организм. Процесс распознавания довольно сложен.
Иммунная клетка определяет высвобождаемые бактерией молекулы как сигнал к действию. Затем лейкоцит должен зацепиться, прилипнуть к бактерии. Для этого на его поверхности есть специальные рецепторы, при помощи которых происходит прилипание к чужеродной клетке (это может быть не только бактерия, но и своя клетка, которая не отвечает на команды — например раковая).
После прилипания мембрана разбухает наружу и как бы обволакивает бактериальную клетку. В результате, непрошенный гость оказывается как бы в мыльном пузыре — фагосоме.
Внутрь фагосомы клетка-фагоцит выделяет ферменты, которые разрушают клеточную стенку бактерии, разрушая ее.
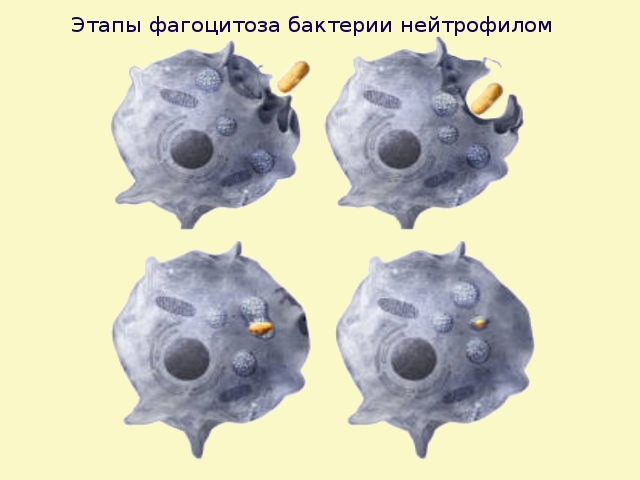
Рассмотрим по порядку.
1. Хемотаксис. А нюх как у собаки… Как макрофаг находит чужеродный объект? Неужели нужно все клетки (как человек по комнате, ночью, на ощупь) нужно «потрогать» рецепторами?
Нет. Хемотаксис — это направленное движение относительно объекта, в зависимости от химических веществ, которые выделяет этот самый объект. Про отрицательный хемотаксис написано было еще в учебнике зоологии: бросался кристаллик соли в воду и амеба старалась уползти от такого соседства подальше. С макрофагами хемотаксис положительный. Ползет, реагируя на химические вещества, выделяемые чужеродными организмами. Привлекают также вещества — цитокины, выделяемые своими же клетками: зовут подомогу. Туберкулезная палочка, к примеру, токсинов не выделяет («не пахнет»), поэтому иммунная система выявляет их не сразу.
Первыми в очаг воспаления мигрируют нейтрофилы из крови, существенно позже поступает «большой пожиратель». По скорости хемотаксиса эти клетки идентичны, но макрофаги активируются заметно позднее.
2. Адгезия макрофагов к объекту. Или «прилипание». На поверхности как здоровых, так и патологических клеток и микробов есть определенный набор химических молекул, которые сигнализируют макрофагу: «съешь меня» или «не ешь меня».
Распознавание осуществляется специальными рецепторами. И хотя макрофаги способны фагоцитировать неживые клетки (кусочки угля, асбеста, стекла), фагоцитарный процесс активируется после команды других клеток — Т-хелперов.
Именно Т-хелперы (вид лимфоцитов) «подсвечивают» то, что нужно скушать: на «неподготовленный» объект налипают специфические белки — опсонины. На «запах» опсонинов и идет макрофаг.
3. В том месте, где произошел контакт с микробом, активируется мембрана клетки. Она как бы вминается внутрь.
4. Формирование фагосомы. Фагосома — это полость, в котором оказывается объект поглощения. Своеобразный «желудок», в котором под действием ферментов происходит расщепление чужеродного организма.
В лизисе (расщеплении) участвует перекись водорода (прекращайте постоянно лить на рану перекись, таким образом повреждаются и здоровые клетки!), закись азота, лизоцим. Различного рода ферменты — протеазы, липазы.
Самый ударный фермент лизосом — эластаза.
5. Выброс перевариваемых остатков.
Profit! Go to step №1!
Это в идеальных условиях. В реальности все происходит намного интереснее. Сам механизм иммунного ответа макроорганизма (нас с вами) и микро- (все то живое, что можно увидеть в микроскоп) — это результат гонки вооружений, продолжающейся миллионы лет.
Перемирия в этом противостоянии не планируется и договора по ограничению оружия никто подписывать не станет. Кто кого перехитрит.
Задача микроба: внедриться, размножиться и распространиться. А эволюция постаралась, чтобы было чем эти планы реализовывать. Поэтому как со стороны микро-, так и макроорганизма накопился богатый арсенал приспособлений.
Есть возбудители (такие как микобактерия туберкулеза или гонококк), для которых быть проглоченным макрофагом — это неотъемлемый этап развития.
А где лучше всего спрятаться от иммунной системы? Конечно внутри представителя этой иммунной системы!
Когда не все так просто: незавершенный фагоцитоз
Есть микроорганизмы, для которых нападение на них макрофагов не является какой-то проблемой. Даже напротив — это для них важный этап в развитии. Как уже говорилось, макрофаг поглощает микроб, формируя фагосому. А вот тут и происходит сбой. Ферменты, участвующие в расщеплении всего, что поглотил макрофаг, концентрируются в другом «мыльном пузыре» — лизосоме.
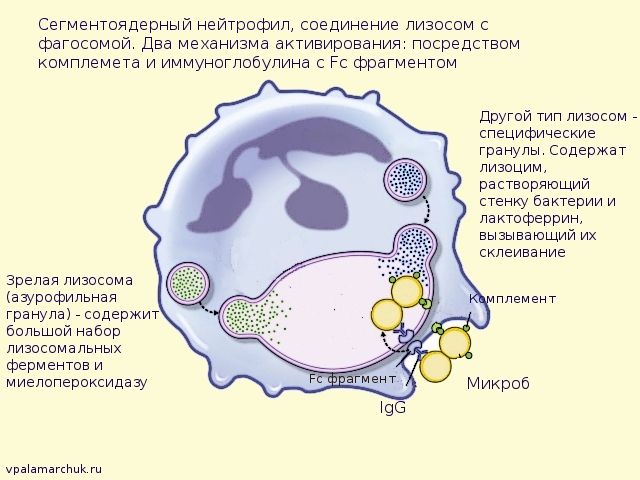
В норме лизосома сливается с фагосомой. В фагосоме создается кислая среда, снижается pH. В кислой среде начинают действовать ферменты, расщепляющие бактерию.
А вот листерия, к примеру выделяет вещества, препятствующие присоединению липосомы (содержащей ферменты) с фагосомой. Блокада фагосомно-лизосомального слияния также характерна для вируса гриппа и токсоплазм. Не может макрофаг «переварить» и возбудителя гонококковой инфекции. Гонококк (стафилококки, кстати, тоже) довольно устойчив к лизосомальным ферментам. А риккетсии разрушают фагосому и могут свободно плавать с цитоплазме фагоцита.
Как же можно справиться с тем, что не получается переварить и уничтожить?
Прежде чем продолжить рассказ, стоит поговорить о том, как сам механизм фагоцитоза изучался. Точнее от том, благодаря кому. Диктиостеллиум.
Именно этому микроорганизму принадлежит самая главная роль в исследовании фагоцитоза. Клеточный слизевик. Хотел написать, что это одноклеточный организм, но это не совсем так… Но и не многоклеточный тоже.
Этот амебоподобный организм был описан в 1935 году. В связи с тем, что очень легко выращивается в лаборатории, стал самым изучаемым микроорганизмом. Механизм фагоцитоза очень древний, у слизевика и у наших с вами макрофагов он очень схож. Обитает во влажном листовом опаде, питается слизевик бактериями. Еще уникальная особенность — у диктиостелиума три «пола», причем для полового размножения достаточно двух из трех в любых сочетаниях. Большую часть жизни диктиостелиум живет в форме одиночных амеб, питаясь бактериями листовой подстилки.
А вот теперь самое интересное. Помните фильм про трансформеров, когда несколько роботов собиралось в одного огромного?
Так вот эти амебы при нехватке пищи образуют клеточные агрегаты, причем размеры такого клеточного образования для микромира огромны — до 1 см. Этот макроорганизм способен ползать и впоследствии формирует «плодовое тело».
Слизевики перед тем как сформировать многоклеточный организм (псевдоплазмодий), поглощают бактерии, но не переваривают их. Более того, на новом месте дают этим бактериям размножится. Такие вот одноклеточные садовники.
Макрофаги нашего организма тоже способны к созданию такого многоклеточного образования. Этого «монстра» называют клеткой Пирогова-Лангханса. Ранее эти многоядерные клетки выявлялись как иммунный ответ на внедрение туберкулезной палочки.
Когда пациенту с длительно продолжающимся кашлем рекомендуют сдать анализ мокроты, то в заключении пишется «КУМ не обнаружены». КУМ — это кислотоустойчивые микобактерии. Туберкулезную палочку клетки нашей иммунной системы полноценно фагоцитировать не могут.
Когда происходит контакт макроорганизма с микобактерией туберкулеза, то первыми в борьбу вступают нейтрофилы. И погибают все. Микобактерия оказывается им не по зубам. Затем в бой идет «старший брат» — макрофаг. Макрофаг поглощает бактерии одну за другой, но полноценно переварить их не может. Бактерия устойчива к кислой среде фагосомы, влияет она и на фагосомно-лизосомальное слияние.
Бороться иммунной системе с возбудителем туберкулеза предельно сложно (почему клиника во многом зависит от количества бактерий, попавших в организм). Чтобы ограничить распространение инфекции, «наевшиеся» микобактериями макрофаги начинают объединяться в большую многоклеточную структуру — клетку Пирогова-Лангханса. Поначалу такую микроскопическую находку приписывали воспалению при туберкулезе, но затем выявились и другие заболевания (например, актиномикоз).
Вот про такой воспалительный процесс и говорят: специфический. Ну а что же организму делать с туберкулезной палочкой, которая ну никак умирать не хочет? Вокруг зоны специфического воспаления формируется своеобразный саркофаг. Сначала состоит из волокнистого белка — фибрина, затем кальцифицируется. Очаг Гона в легких — нередкая находка на флюорографии. Полностью выздороветь от туберкулеза нельзя. Человек остается навсегда инфицированным (но клинически абсолютно здоровым).
БЦЖ — прививка от туберкулеза. Содержит убитые бактерии, чтобы познакомить иммунные клетки с антигенами возбудителя. Гарантированно защитить прививка не может (понятно, почему), но эффективность иммунного ответа повышается. Повторюсь, все зависит от количества бактерий и состояния организма.
Как сон влияет на фагоцитарную активность
Одна бессонная ночь — это конечно нехорошо, но в большинстве случаев не вызывает каких-либо последствий.
Другое дело — бесчисленные бессонные ночи. В одном из исследований, опубликованных в журнале «Neuroscience» был оценен биологический эффект лишения сна лабораторных мышей. Было выяснено, что мозг при длительной нехватке сна причиняет себе ущерб. Лабораторных животных разделили на четыре группы. Одна группа — «хорошо отдохнувшие», мышей второй группы периодически будили, в третьей группе животные не спали несколько дней. После чего ученые изучали активность мозга у каждой группы. У мышей, длительно лишенных сна было выявлено повышение активности фагоцитоза. Фагоциты — это клетки-уборщики, необходимые мозгу для очищения от побочных продуктов нейронной активности в течение дня.
После длительного отсутствия сна мозг включает «овердрайв», что может быть очень вредным. Не стоит паниковать, если ваш режим сна и бодрствования не в идеальной форме, но постарайтесь высыпаться.
Фагоцитоз и гипергликемия
Почему хирурги часто назначают при гнойно-воспалительных процессах анализ крови с определением уровня глюкозы?
Почему у больных с сахарным диабетом инфекционные заболевания протекают тяжелее? Один из факторов: быстрые углеводы влияют на активность макрофагов.
Людям давали стограммовые порции углеводов из глюкозы, фруктозы, сахарозы, меда. Затем брали венозную кровь через 1,2,3 и 5 часов после приема пищи. К крови добавляли суспензию, содержащую эпидермальный стафилококк (Staphylococcus epidermidis).
В дальнейшем проводилось исследование активности макрофагов. Установлено, что быстроусвояемые углеводы угнетают фагоцитарную активность макрофагов.
Так что очень важно следить за уровнем глюкозы, тем более больных с сахарным диабетом, проходящих лечение гнойно-воcпалительных процессов.
В заключение
И хотя фагоцитоз — самый древний способ защиты от чужеродных организмов, значения он не утратил. Этот механизм является ключевым в борьбе со стафилококковой инфекцией.
Источник: vpalamarchuk.ru
Автор статьи Зыбина А.М.
Благодаря наличию иммунной системы организм защищен от большинства болезнетворных организмов (вирусов, бактерий, грибков, простейших, гельминтов и т. д.) и токсических продуктов их жизнедеятельности. Таким образом, иммунитет направлен на защиту организма, поддержание его целостности и индивидуальности.
Иммунитет можно разделить на клеточный и гуморальный. Клеточный иммунитет обеспечивается лейкоцитами при прямом их контакте с патогеном (фагоцитоз, повреждение патогена и т. д.). Гуморальный иммунитет обеспечивают белковые факторы, вырабатываемые клетками. К ним относят антитела и систему комплемента.

Рис. 1. Виды иммунитета.
По функциям иммунитет делят на врожденный и приобретенный. Врожденный иммунитет включает особенности индивидуума или вида, которые обеспечивают защиту от патогенов. Для проникновения вирусов и бактерий в организм и в клетки, необходимо наличие специальных белков на мембране. Такие белки чаще всего видоспецифичны, поэтому большинство болезней, от которых страдают животные, человеку не страшны. Даже внутри одного вида, существуют индивидуальные отличия белков, которые могут сделать часть популяции невосприимчивой к заболеванию.
Приобретенный активный иммунитет возникает при контакте с патогеном и последующей выработке антител. Он может произойти естественным путем (болезнь) искусственным (вакцина). В любом случае остаются клетки памяти и повторный контакт с патогеном уже не будет вызывать болезнь. Также антитела можно получить пассивно: с молоком матери или в виде сыворотки. Они защищают организм до тех пор, пока циркулируют в крови. Клетки памяти при этом не сохраняются и при повторном контакте с патогеном возможно заражение.
Иммунитет обеспечивают белые кровяные тельца – лейкоциты. Все они образуются в красном костном мозге. Лейкоциты принято делить на гранулоциты и агранулоциты.
К гранулоцитам относят нейтрофилы, базофилы и эозинофилы. Все они содержат большое количество гранул в цитоплазме, в которых запасены вещества, необходимые для борьбы с патогенами. Название гранулоцитов связано с красителями, которыми окрашиваются гранулы (гематоксилин – основный, эозин — кислый). Кроме того, они способны к фагоцитозу небольших частиц.
Нейтрофилы (рис. 2 а, г) составляют 93-96% всех лейкоцитов крови. Они имеют сегментированное (3-5 сегмента) ядро и окрашиваются и гематоксилином, и эозином. Они способны как к фагоцитозу небольших частиц, так и к образованию активных форм кислорода. Нейтрофилы могут жить и бороться с патогенами даже в анаэробных условиях. Они локализуются в крови и очагах воспаления, участвуют в образовании гноя. Эффективны против грибка, бактерий и протистов.
Эозинофилы (рис. 2 б, д) имеют сегментированное ядро (2 сегмента) и окрашиваются эозином. Они обеспечивают противогельминтный иммунитет (выделяют токсичные вещества и активные формы кислорода из гранул рядом с паразитом). Также они эффективно защищают организм от простейших. Способны к рециркуляции, то есть возвращению в кровь из тканей.

Рис. 2. Фотографии (а-в) и схематичное строение (г-е) нейтрофила (а, г), эозинофила (б, д) и базофила (в, е).
Базофилы (рис. 2 в, е) составляют 0,5-1% лейкоцитов крови. Они имеют S-образное ядро и их цитоплазма плотно набита гранулами, которые окрашиваются гематоксилином и содержат много гепарина и гистамина. Базофилы способны встраивать в мембрану IgE, благодаря этому специфически связываться и атаковать патоген. Все эти признаки характерны и для тучных клеток, из-за чего ранее базофилы считались их предшественниками. Однако, в настоящее время установлено, что тучные клетки имеют иное происхождение. Базофилы участвуют в реализации противогельминтного ответа. Они выделяют медиаторы воспаления и увеличивают проницаемость сосудов, что дополнительно привлекает другие иммунные клетки. Участвуют в аллергических реакциях немедленного типа.
Агранулоциты делятся на моноциты и лимфоциты.

Рис. 3. Фотография (а) и схематичное строение (б) моноцитов.
Моноциты (рис. 3) самые активные лейкоциты крови. Имеют клетку с крупным бобовидным ядром. Переходя в ткани, превращаются в макрофагов — профессиональных фагоцитов. Макрофаги способны поглощать даже очень крупные частицы. Мембрана этих клеток содержит Toll-подобные рецепторы, позволяющие распознавать и уничтожать консервативные структуры мембраны и клеточной стенки микроорганизмов. Если же макрофаги не способны поглотить чужеродную частицу, они облепляют ее со всех сторон и сливаются, изолируя частицу от организма. Макрофаги поглощают не только патогены, но и остатки мертвых клеток организма. Кроме того, они являются антиген-презентирующими клетками.
Лимфоциты имеют разнообразные функции. Выделяют T- и В-лимфоциты. Оба типа лимфоцитов образуются в красном костном мозге. Однако, их созревание проходит в разных местах: Т-лимфоцитов в тимусе, В-лимфоцитов – в красном костном мозге. Т-лимфоциты подразделяют на Т-киллеров, Т-хелперов. Также к лимфоцитам относят натуральных (естественных) киллеров. Как и все иммунные клетки, они образуются в красном костном мозге, однако, место их созревания до сих пор находится под вопросом. Созревание лимфоцитов проходит в детском возрасте, после чего все лимфоциты преимущественно локализуются в лимфатических узлах и в селезенке.
В-лимфоциты обеспечивают гуморальный приобретенный иммунитет и являются источником антител нашего организма. Антитела (иммуноглобулины, Ig) — белковые соединения плазмы крови (γ-глобулины), образующиеся в ответ на введение в организм человека бактерий, вирусов, белковых токсинов и других антигенов. Связываясь активными участками (центрами) с бактериями или вирусами, антитела препятствуют их размножению или нейтрализуют выделяемые ими токсические вещества. Кроме того, антитела являются своеобразной «меткой» для иммунных клеток о том, что частицу, к которой они присоединились, необходимо поглотить. При этом антитела распознают только чужеродные организму макромолекулы.
Антитела состоят из двух идентичных тяжёлых цепей (H-цепи) и из двух идентичных лёгких цепей (L-цепей) (рис. 4а). К тяжёлым цепям ковалентно присоединены олигосахариды. Каждая цепь имеет конститутивные (Fc) и вариабельные (Fab) фрагменты.
Конститутивный фрагмент консервативен и необходим для взаимодействия антитела с иммунными клетками. Базофилы и тучные клетки встраивают готовые антитела в мембрану и используют их как рецептор, что позволяет им быстро и бурно реагировать на патоген при его связывании мембранным антителом. В-лимфоциты встраивают в собственную мембрану антитела, той специфичности, которую производят сами. При связывании патогена с мембранным иммуноглобулином, становится возможна активация В-лимфоцита. При присоединении свободных (не встроенных в мембрану) антител к патогену, макрофаги и другие иммунные клетки могут провзаимодействовать с конститутивным фрагментом антитела. Это послужит сигналом к уничтожению помеченной молекулы или организма.
Вариабельный фрагмент антитела индивидуален для каждого В-лимфоцита. Именно этот участок (идиотоп) связывается с патогеном. Причем антитела разных В-лимфоцитов могут присоединяться к различным участкам одного и того же патогена, антитела одного В-лимфоцита связывают всегда один участок (эпитоп) (рис. 4 б). Благодаря вариабельности этих фрагментов, в организме одного человека может существовать до 108 вариантов антител.
Поскольку образование Fab фрагмента носит случайный характер у каждого В-лимфоцита, в период созревания в красном костном мозге они проходят селекцию. Как уже упоминалось ранее, эти клетки встраивают иммуноглобулины в мембрану и используют как рецептор. B-клетки, иммуноглобулиновые рецепторы которых способны взаимодействовать с собственными антигенами, либо погибают в результате апоптоза, либо приходят в состояние ареактивности (анергии). Таким образом, сохраняют активность только клетки, которые не реагируют на собственные антигены.

Рис. 4. Строение антитела (а) и его связывание с различными эпитопами антигена (б).
Тем не менее для активации зрелого В-лимфоцита одного контакта (связывание с рецептором) с патогеном недостаточно. Должна произойти презентация антигена.
Презентацию антигена осуществляют специальные антиген-презентирующие клетки (АПК), к которым относятся макрофаги и дендритные клетки (рис. 5), при этом В-лимфоцит должен получить сигнал к активации от Т-хелпера. Взаимодействие клеток происходит через ряд мембранных белков. Помимо иммуноглобулина, в нем участвуют главный комплекс гистосовместимости, Т-клеточный рецептор и ряд корецепторов.

Рис. 5. Взаимодействие между антиген-презентирующей (дендритной) клеткой и лимфоцитом.
Все клетки организма имеют на поверхности специальные гликопротеины – главный комплекс гистосовместимости (ГКГ, major histocompatibility complex, MHC, HLA). Этот гликопротеин существует в двух вариантах. ГКГ II имеют АПК и В-лимфоциты, ГКГ I – все остальные, в том числе и соматические, клетки. Этот комплекс индивидуален и насчитывает примерно 2000 аллельных генов. Внутри каждой клетки происходит постоянное обновление белков и других полимеров. Старые молекулы разрушаются и их фрагменты «выкладываются» на поверхность ГКГ. Иммунные клетки в процессе созревания «учатся» распознавать свой ГКГ и белки, которые на нем находятся. Таким образом, ГКГ являются «паспортом» клетки и показывают не только ее принадлежность данному организму, но и что происходит внутри клетки.
Т-лимфоциты обнаруживают патоген с помощью своих Т-клеточных рецепторов (ТКР, T—cell receptor, TCR). Это мембранный белок, ответственный за распознавание процессированных антигенов, связанных с молекулами главного комплекса гистосовместимости (рис. 6). Этот рецептор, как и антитела, имеет конститутивный и вариабельный участки. Конститутивным участком он связан с мембраной Т-лимфоцитов, вариабельный участок необходим для распознания ГКГ, антигена, и он индивидуален для каждого Т-лимфоцита.

Рис. 6. Взаимодействие Т-клеточного рецептора и главного комплекса гистосовместимости.
Для нормальной работы Т-лимфоцитов, при созревании в тимусе они проходят сложный двухэтапный отбор. На первом этапе выживают только те Т-лимфоциты, которые остаются способны связываться с ГКГ вариабельным участком ТКР (положительный отбор). На втором – уничтожаются Т-лимфоциты, которые активируются в ответ на собственные антигены, «выложенные» на ГКГ. Параллельно с этим, идет дифференцировка на Т-киллеры и Т-хелперы. Т-киллеры должны взаимодействовать с ГКГ I, в качестве корецептора такого взаимодействия выступает мембранный белок CD4, он и является маркером Т-киллеров. Т-хелперы должны связываться с ГКГ II, в качестве корецептора и маркера выступает белок CD8.
Если отбор Т- и В-лимфоцитов прошел недостаточно строго, и остались клетки, реагирующие на собственные антигены организма, то иммунитет может начать атаковать собственные клетки, что приведет к возникновению аутоиммунных заболеваний.
Презентация антигена В-лимфоцитам – это сложный процесс, в котором принимают участие Т-хелперы и АПК. В-лимфоцит, не взаимодействовавший со своим антигеном называется наивным. Если антиген взаимодействует с мембранным антителом В-лимфоцита, то происходит интернализация антитела с антигеном, антиген разрушается на фрагменты, и они выкладываются на ГКГ II. В это время, макрофаг или дендритная клетка также должны захватить антиген. Они его переваривают и выкладывают на ГКГ II. Т-хелпер должен провзаимодействовать с ГКГ II на поверхности АПК, после чего происходит его активация. Только после этого, Т-лимфоцит может провзаимодействовать с ГКГ II на поверхности В-лимфоцита, который активируется и превращается в плазматическую клетку. Плазматическая клетка пролиферирует и создает клонов, которые синтезируют антитела той же специфичности, что и исходный лимфоцит. Таким образом, происходит усиление иммунного ответа. Стоит отметить, что один патоген имеет много эпитопов, вследствие чего активируется множество В-лимфоцитов с различной специфичностью. Часть В-лимфоцитов, после контакта с патогеном, превращается в клетки памяти, которые сохраняются после болезни, и их активация происходит гораздо быстрее при повторном контакте с антигеном.

Рис. 7. Презентация антигена. Сверху: чужеродный антиген (1) захватывает и поглощает антиген-презентирующая клетка (2), которая его расщепляет и частично экспонирует на своей поверхности в комплексе с молекулами ГКГ II (3). Внизу весь чужеродный антиген связывается поверхностными антителами (5) В-лимфоцита (6), также поглощается и процессируется им (7), после чего часть чужеродной молекулы презентируются в комплексе с молекулами ГКГ II (8). После контакта (10) с Т-лимфоцитом (хелпером, 4), уже активированным антиген-презентирующей клеткой (2), В-лимфоцит начинает секретировать антитела в кровь (9).
Т-киллеры отвечают за клеточный иммунитет. Они играют важную роль в защите организма против вирусов и опухолей. Т-киллеры взаимодействуют с ГКГ I всех клеток и уничтожают клетку в случаях обнаружения чужого ГКГ или фрагмента чужого антигена на ГКГ. Таким образом, они уничтожают раковые клетки и внутриклеточных паразитов. Т-киллеры играют важную роль при трансплантации органов, ведь именно эти клетки атакуют чужеродные ткани пересаженного органа. Поэтому при трансплантации стараются подобрать донора органов, клетки которых имеют максимально похожий ГКГ на ГКГ пациента.
Т-киллеры взаимодействуют с клеткой через ГКГ, и, если он отсутствует, то клетка остается невидимой для этой системы. Поэтому, клетки без ГКГ уничтожаются натуральными киллерами. Таким образом, они обеспечивают противоопухолевую защиту.
Помимо лимфоцитов, в плазме крови присутствуют белки, способные распознавать клеточную стенку бактерий и самособираться в пору, вследствие чего нарушается ионный баланс клетки, и она погибает. Такие белки относятся к системе комплемента. Они синтезируются печенью и относятся к группе глобулинов.
Наличие на поверхности антигена антител или белков системы комплемента является сигналом для макрофагов к фагоцитозу чужеродной частицы.
Проявления иммунитета разнообразны и включает множество клеток и белков. Она обеспечивает эффективную защиту организма от различного рода заражений. Однако, приобретенный иммунитет – это эволюционно новая система, которая присутствует только у позвоночных. Именно поэтому нередки случаи некорректной работы иммунитета, что может привести к различным патологиям, например, аллергиям, опухолям и аутоиммунным заболеваниям.
Источник: biocpm.ru
Фагоцитоз филогенетически является наиболее древним защитным процессом, осуществляемым специализированными клетками иммунной системы (Мечников 1883, 1892; Greenberg, 1999). Именно И. И. Мечниковым впервые в сравнительных морфофизиологических исследованиях была доказана ключевая роль этого механизма иммунной защиты в формировании резистентности животных к инфекции. К профессиональным фагоцитам у позвоночных животных в первую очередь относятся нейтрофилы (полиморфноядерные лейкоциты, микрофаги) и моноциты/макрофаги (моноядерные, мононуклеарные фагоциты). Эти клетки морфофизиологически и биохимически приспособлены к осуществлению поглощения и инактивации микробных тел и частиц, превышающих размеры диаметром 0.5 мкм (размер наименьших бактерий группы Mycoplasma). Отличие фагоцитоза от других форм эндоцитарных реакций клеток предполагает обязательное участие в этом процессе актинового цитоскелета, который в форме микрофиламентов пронизывает псевдоподии, осуществляющие захват микроорганизмов и частиц. Фагоцитоз требует для своего протекания определенных температурных условуй (t > +13—18 °С) и не происходит при более низких температурах у позвоночных животных. Наряду с нейтрофилами и моноцитами/макрофагами в фагоцитозе принимают участие незрелые дендритные клетки, эозинофилы, тучные клетки, эпителиальные клетки, тромбоциты и даже некоторые лимфоциты.
Контакт фагоцита с микроорганизмом инициирует клеточные реакции, связанные с цитоплазматической мембраной, цитоскелетом, активацией механизмов убивания (киллинга) патогенов, продукцией цитокинов, хемокинов и молекул, играющих ключевую роль в представлении антигенов (Underhill, Ozinsky, 2002).
Рецепторы фагоцитоза
|
| Клетки | Рецептор | Мишень | Лиганд |
| Макрофаги | MARCO | Е. co/і, S. aureus | Неидентифи-
цирован |
| » | MER | Апоптические
тимоциты |
? Gas6Apoc- фатидил- серин |
| Многие
клетки |
PSR | Апоптические
клетки |
Фосфати-
дилсерин |
| Макрофаги | CD36 | Апоптические
нейтрофилы |
Фосфати-
дилсерин тромбо спондин |
| » | CD14 | Pseudomonas
aeruginosa апоптические клетки |
?лпс
неиденти- фицирован |
| Многие | pi-интегрины | Yersinia spp. | Инвазии |
| клетки | |||
| Макрофаги | опфЗ | Апоптические
клетки |
? тромбоспондин |
| Дендритные
клетки, эпители- |
софЗ | То же | Неиденти-
фици- рован |
| альные
клетки |
|||
| Эпителиаль- | Е-кадхерин | Listeria spp. | 1п1А |
| ные клетки | |||
| То же | Met | То же | 1п1В |
Основные стадии фагоцитоза: хемотаксис, контакт фагоцита с микробом, поглощение (интернализация) микроорганизмов (фагоцитоз в узком смысле слова), инактивация (киллинг) и последующее переваривание патогенов в вакуолярном аппарате фагоцитов (завершение фагоцитоза). Наряду с этими функциональными проявлениями фагоцитоз, как правило, сопровождается секреторными реакциями фагоцитов, особенно моноцитов/ макрофагов и дендритных клеток, в ходе которых выделяются разнообразные физиологически активные вещества, обеспечивающие протективный характер течения и завершения всего процесса в целом.
В распознавании, контакте и поглощении микробов фагоцитами участвуют разнообразные рецепторы (табл. 7) (Greenberg, 78
Grinstein, 2002). С помощью современных молекулярно-генетических методов установлено, что при фагоцитозе частиц латекса макрофагами мыши в фагоцитах наблюдаются изменения в экспрессии более 200 генов, а при фагоцитозе Mycobacterium tuberculosis — около 600 (Ehrt et al., 2001). Все это свидетельствует о сложном и комплексном характере структурно-функциональных изменений в макрофагах, сопряженных с фагоцитарным процессом. Понимание их молекулярной основы обеспечит в перспективе создание фармакологических средств, направленно регулирующих процесс фагоцитоза. Многообразие рецепторов обеспечивает эффективность распознавания патогенов («несвоего») и является необходимым условием для последующей прицельной инактивации инфекционных агентов. В одной из современных концепций врожденного иммунитета совокупность этих рецепторов принято обозначать как систему рецепторов (молекул), распознающих патогенассоциированные молекулярные паттерны (Janeway, 1992, 2002). ‘
Целая группа локализованных на поверхности клеток рецепторов обеспечивает протекание фагоцитарного процесса. Часть из них (например, рецепторы формилметиониловых пептидов и С5а) ответственна за хемотаксическую фазу фагоцитарного процесса.
Источник: medic.news