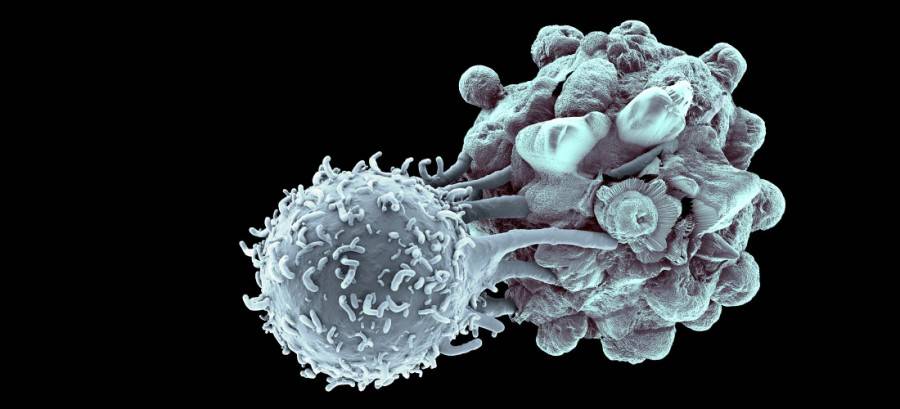
Стадии апоптоза

Биологическая клетка – это сложный и крайне интересный объект, по сути своей она является целым организмом, который рождается, дышит, питается, размножается и умирает. Но это не удивительно, ведь огромная часть живых существ на нашей планете состоят только из одной клетки. После поста об антиоксидантах и активных формах кислорода, мне захотелось написать про такой мрачный, но нужный процесс как запрограммированная смерть клеток – по научному апоптоз. Стоит отличать апоптоз от некроза, который является гибелью клеток в результате травмы и повреждения. Основное отличие – при апоптозе, которые не происходит случайно, из остатков клеток образуются апоптические тела, которые поедаются вызванными для этого фагоцитами, что препятствует воспалению и отравлению соседних клеток, а при некрозе происходит отмирание клеток и целых тканей, сопровождающееся сильным воспалением.
Интересный факт, что термин «апоптоз» означал опадание лепестков и листьев у растений, что, на мой взгляд, не совсем верно, так как при апоптозе остатки клетки утилизируются собственным организмом, а при опадании листьев они просто отваливаются и уже перерабатываются другими организмами. Хотя оба процесса носят запрограммированный характер. Но это всего лишь философско-лингвистические рассуждения.
Наши клетки – своеобразные ипохондрики и могут покончить с собой по любой причине: перегрев, радиационное облучение, гипоксия и многое другое. В целом клетки на столько склонны к самоубийству, что они все время получают сигнал от других клеток : «Живи-живи-живи» и прерывание этого сигнала сразу приводит к сильной депрессии с последующим намыливанием веревки апоптозу. Забавно, что из таких вот клеток складывается организм с весьма ощутимым инстинктом самосохранения… . Во истину, природа полна парадоксов.
Условно можно выделить три стадии апоптоза: инициация или получение сигнала, эффекторная стадия, в которой запускаются процессы деградации и, собственно, процесс разрушения и деградация – формирование апоптических тел с последующим поеданием макрофагами.
Выделяют 2 пути инициации: митохондриальный и внешний сигнал.
Митохондрии – энергетические станции нашего организма, там собственно и происходит процесс клеточного дыхания с превращением кислорода в воду. В школьных учебниках митохондрии изображались как такие вытянутые овалы разбросанные по всех клетке. Но это не совсем так. Если посмотреть на срез клетки, то вы действительно увидите такую картину, но при трехмерной реконструкции клеток по этим тонким срезам ученые обнаружили, что митохондирия в клетке всего одна, но она имеет сложную изогнутую структуру, поэтому на срезах мы видим различные ее выросты.
Митохондрии окружены двумя клеточными мембранами и между ними находятся белки апоптоза или апоптические белки, которые вырываются на свободу при разрыве внешней мембраны или формировании в ней пор. Собственно это и является ключевой фазой начала апоптоза. Освободившиеся белки через ряд биохимических реакций активируют каспазы — ферменты, которые разрушают другие белки. Каспазы начинаю крушить все вокруг себя, разрушая все основные клеточные структуры. В процессе разрушения митохондриальной мембраны не только высвобождаются белки, но и вода начинает активно поступать в митохондрию, вызывая ее разбухание.
Второй путь начала апоптоза – сигнальный. На поверхности клеток есть рецепторы клеточной гибели, специальные лиганды, продуцируемые другими клетками (частенько это бывают активированные макрофаги, которые позже и подъедают остатки), связываются с этими лигандами и активируют их. Рецепторы представляют собой большую молекулу, которая сидит в клеточной мембране и выступает с обоих сторон: внутрь клетки и наружу. С наружной стороны садится лиганд и по всему рецептору передается сигнал на внутреннюю сторону. Далее запускается цепь биохимических реакций, в результате которой, как и в митохондриальном пути, активируются каспазы.
На второй стадии апоптоза – эффекторной, уже не так важно как клетка получила сигнал. На этой стадии внутри начинается настоящий апокалипсис и главную роль в нем играют каспазы. Второй важный элемент этой стадии – флавопротеин AIF, который выходит из митохондрий и активируют эндонуклеазы – белки, которые разрушают ДНК клетки. Фактически, после этой стации клетка представляет собой город после ядерной бомбежки.
Во время разрушения митохондриальной мембраны также высвобождается весь энергетический комплекс, который провоцируют образование активных форм кислорода внутри клетки. Свободные радикалы запускают цепные реакции, которые способствуют разрушению содержимого клетки. В этот момент их уже нельзя сдержать антиоксидантами.
После этого начинается третья и последняя стадия – деградация. Клетка теряет свою форму и сжимается из-за разрушения клеточного скелета. Далее начинается фрагментация клетки на мелкие части, которые представляют собой клеточную мембрану с остатками внутри – эти образования получили название – апоптические тела. Вокруг умирающей клетки уже дежурят макрофаги, готовые набросится на останки. В процессе клетки, на поверхности мембраны появляются сигнальные белки, которые привлекают голодных макрофагов и вот, они уже поглощают останки погибшего сородича.
Пишу это, а сама думаю, что это все мне напоминает какую-то сцену из популярных ныне зомбо‑апокалипсисов. Прямо страшно стало. Один кровоподтек и на тебя набросятся и сожрут. Бр-р.
Но и у клеток есть антидепрессанты, которые держат эти процессы под контролем не давая среагировать на малейший стресс – это ингибиторы апоптических белков. Но, как только мембрана митохондрий начинает выпускать предшественников апокалипсиса, на волю вырывается и белок SMAC, который деактивируют эти ингибиторы и они становятся бесполезны. После этой стадии апоптоз уже сложно остановить.
Не стоит думать, что апоптоз – исключительно мрачно-негативное явление нашего организма. С помощью апоптоза поддерживается правильное количество и соотношение различных клеток в организме. Апоптоз играет далеко не последнюю роль в нашем развитии: например, разделение пальцев на руках и ногах является следствием запрогроммированной гибели клеток. При прорезании зубов у детей еще до того, как появится зуб начинается процесс гибели клеток десны, чтобы зубу было легко выйти. Хвост у головастиков также не отваливается с появлением ног, а деградирует с помощью того же явления.
Апоптоз незаменим при предотвращении развития раковых опухолей. Во время нашей обычной жизни огромное количество клеток в организме претерпевают патологические изменения и перерождаются в потенциально раковые клетки. Соседние клетки, как и бабушки на скамейки около подъезда, внимательно следят за своими соседями и при неадекватном поведении посылают клетке сигнал апоптоза еще до того, как она размножится и станет опасна. Собственно по этой причине за последние 20 лет сильно возрос интерес к апоптозу, как средству для предотвращения и борьбы со злокачественными опухолями.
Источник: sunely-tales.livejournal.com
Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации и фрагментации хроматина, уплотнении цитоплазматической мембраны без выхода содержимого клетки в окружающую среду. (Попков В.М., Чеснокова Н.П., Барсуков В.Ю., 2011).
Апоптоз играет жизненно важную роль в процессе эмбрионального и онтогенетического развития, имеет место при различных морфогенетических процессах, обеспечивает поддержание клеточного гомеостаза как в лимофоидной ткани, так и в других пролиферирующих тканях. Нарушение апоптоза в эмбриогенезе может приводить к внутриутробной гибели плода, врожденным уродствам или различным заболеваниям, в том числе и злокачественным новообразованиям.
Различают два типа гибели клетки: апоптоз и некроз. Принципиальные различия заключаются в следующем: некроз является результатом незапланированного события и происходит спонтанно, апоптоз формируется как четко — регулируемый, генетически-детерминируемый процесс элиминации клетки. Отличительной морфологической чертой апоптоза является коллапс ядра. Хроматин становится суперконденсированным в форме полумесяца по периферии ядра, в этот момент начинается фрагментация ДНК. Характерными признаками апоптоза, позволяющими отличить его от некроза, являются:
а) переход фосфатидилсерина из внутреннего монослоя цитоплазматической мембраны в наружный монослой; выход цитохрома С из межмембранного пространства митохондрий в цитоплазму
б) активация цистеиновых протеиназ (каспаз)
в) образование активных форм кислорода
г) сморщивание (blebbing) цитоплазматической мембраны
д) последующий распад ядра на части
е) фрагментация клеток на везикулы с внутриклеточным содержимым — апоптотические тельца
ж) апоптотические тела захватываются фагоцитирующими клетками микроокружения, как в случае некроза. При развитии апоптоза выброса клеточного содержимого не происходит, воспаление не возникает. Некроз распространяется обычно на группы клеток, в то время как апоптоз носит селективный характер в отношении отдельных клеток (Дмитриева Л.А., Максимовский Ю.М., 2009).
Стадии апоптоза
Стадия инициации. На этой стадии патогенный агент либо сам является информационным сигналом, либо обусловливает генерацию сигнала в клетке и его проведение к внутриклеточным регуляторным структурам и молекулам. Инициирующие апоптоз стимулы могут быть трансмембранными или внутриклеточными. Трансмембранные сигналы подразделяют на отрицательные и положительные.
рицательные сигналы обусловливают отсутствие или прекращение воздействия на клетку различных факторов роста, регулирующих деление и созревание клетки. Положительные сигналы генерируют запуск программы апоптоза. Так, связывание TNFα (FasL) с его мембранным рецептором CD95 (Fas) активирует программу смерти клетки. Среди внутриклеточных стимулов апоптоза зарегистрированы избыток Н+, свободные радикалы липидов и других веществ, повышенная температура, внутриклеточные вирусы и гормоны, реализующие свой эффект через ядерные рецепторы (например, глюкокортикоиды).
Стадия программирования. На этой стадии специализированные белки либо реализуют сигнал к апоптозу путём активации исполнительной функции, либо блокируют потенциально летальный сигнал. Выделяют два варианта реализации стадий программирования: 1) путём прямой активации эффекторных каспаз и эндонуклеаз (минуя геном клетки) и 2) опосредованной через геном передачи сигнала на эффекторные каспазы и эндонуклеазы. Прямая передача сигнала осуществляется через адапторные белки, гранзимы и цитохром С. Опосредованная передача сигнала подразумевает репрессию генов, кодирующих ингибиторы апоптоза, и активацию генов, кодирующих промоторы апоптоза.
Стадия реализации программы состоит в собственно гибели клетки, осуществляемой посредством активации протеолитического и нуклеолитического каскадов.
Непосредственными исполнителями процесса «умертвления» клетки являются Ca2+,Mg2+ -зависимые эндонуклеазы и эффекторные каспазы. В результате разрушения белков и хроматина в процессе апоптоза клетка подвергается деструкции, когда в ней формируются и отпочковываются фрагменты клетки, содержащие остатки органелл, цитоплазмы, хроматина и цитолеммы, то есть апоптозные тельца.
Стадия удаления фрагментов погибших клеток. На поверхности апоптозных телец экспрессируются лиганды, с которыми взаимодействуют рецепторы фагоцитирующих клеток. Фагоциты быстро обнаруживают, поглощают и разрушают апоптозные тельца. Благодаря этому содержимое разрушенной клетки не попадает в межклеточное пространство. (Лихтенштейн А.В., Шапот В.С., 1998).
Одно из апоптотических событий реализуется в ядре клетки и заключается в фрагментации ДНК. Деградация ДНК является терминальной фазой апоптоза, связанной с проявлением активности различных эндонуклеаз, последние обусловливают либо появление крупных фрагментов ДНК, или развитие межнуклеосомальной деградации ДНК. Считают, что этот тип деградации обеспечивается активацией Са2+, Mg2+-зависимой эндонуклеазы.
Исследования последних лет привели к формированию принципиально новых представлений о механизме гибели клеток, имеющих повреждения ДНК, как о процессе, осуществляемом в соответствии с определенной генетической программой. В индукции этой программы при наличии повреждений в ДНК клетки важная роль принадлежит белку р53. Этот белок с молекулярной массой 53 кД, локализован в ядре клетки и является одним из транскрипционных факторов.
вышенная экспрессия этого белка приводит к репрессии ряда генов, регулирующих транскрипцию и причастных к задержке клеток в фазе клеточного цикла G1. Если же активность репарационных систем недостаточна и повреждения ДНК сохраняются, то в таких клетках индуцируется программируемая клеточная гибель, или апоптоз, что приводит к защите организма от присутствия клеток с поврежденной ДНК, т.е. мутантных и способных к злокачественной трансформации.
Таким образом, при действии генотоксических агентов р53 не только увеличивает время репарации ДНК. но также защищает организм от клеток с опасными мутациями. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Механизмы индукции апоптоза
Регуляция апоптоза обеспечивается гормонами, цитокинами и в значительной мере особенностями генома. Ослабление или устранение гормональных влияний на клетки- мишени приводит, как правило, к индукции апоптоза.
Цитокины — это обширная группа белков, регулирующих пролиферацию и дифференцировку клеток при связывании со специфическими рецепторами на клетках мишенях. Цитокины подразделяются на 3 большие группы: ростовые, семейство Фактора некроза опухоли и спиральные цитокины. Эффект цитокинов на клетки неоднозначен в связи с гетерогенностью их структуры и функции: для одних клеток ряд цитокинов выступают в роли индукторов апоптоза, а для других — в роли ингибиторов апоптоза. Это зависит от типа клетки, от стадии ее дифференцировки, от функционального состояния клетки. (Goodwin P.J., Ennis M., Pritchard K.I., 2002).
Наиболее хорошо изучена последовательность событий, приводящих клетку к апоптозу в результате взаимодействия белков из семейства TNFα со специфическими рецепторами. Ярким представителем этой группы белков является система Fas/Fas-L. Следует отметить, что для этой системы не известны другие функции, кроме как индукции апоптоза клетки. Взаимодействие Fas с Fas-L (лиганд) или с моноклональными антителами приводит к апоптозу клетки. При связывании лиганда с рецептором происходит олигомеризация цитоплазматических белков: (1) DD (домен смерти), относящийся к рецептору, (2) адапторного белка — FADD (Fas-ассоциированный домен смерти), содержащий DED — эффекторный домен смерти и (3) прокаспазы-8. (Паукова В.С., Пальцева М.А., Улумбекова Э.Г., 2015).
Важная роль в регуляции апоптоза клеток иммунной системы принадлежит другим цитокинам -интерлейкинам, интерферонам. Было обнаружено, что интерлейкины являются индукторами апоптоза как в здоровых, так и в малигнизированных клетках и клеточных линиях. Однако не только роль индукторов апоптоза свойственна интерлейкинам, не менее выраженный эффект цитокинов наблюдается в предотвращении апоптоза. При этом один и тот же IL может быть как индуктором апоптоза, так и его ингибитором. Так, например, IL 1 является индуктором апоптоза для клеток мышиной тимомы в случаях ингибирования размножения клеток и ингибитором апоптоза для этих же клеток в случаях их интенсивного размножения. Неоднозначна и роль интерферонов по влиянию на клетки. В одних случаях IFN вызывает апоптоз (клетки костного мозга), в других — является ингибитором апоптогенного сигнала (периферические моноциты человека).
Таким образом, апоптоз является тем механизмом, который обуславливает элиминацию клеток с определенной специфичностью рецепторов. (Миронова С.П., Котельников Г.П., 2013).
В настоящее время складывается впечатление о центральной роли протеаз в запуске и развитии процесса апоптоза. Причем, по-видимому, при апоптозе, в отличие от физиологического ответа клетки, действуют свои, характерные только для апоптоза, специализированные необратимые реакции протеолиза, катализируемые специфическими протеазами, относящихся к классу цистеиновых протеаз.
Роль наследственных факторов в регуляции апоптоза
Выяснение роли белков семейства Вс1-2 занимает центральное место в изучении регуляции процесса апоптоза. К настоящему времени известно, что белки этого семейства относятся либо к индукторам апоптоза (Bad, Bax, Bcl-Xs, Bik, Bid, Bak), либо к ингибиторам (Bcl-2, Bcl-XL). Белки семейства Bcl-2 находятся в постоянном динамическом равновесии, образуя гомо- и гетеродимеры, что в конечном счете влияет на развитие апоптоза клеток. Поэтому считается, что соотношение активных форм этих белков определяют реостат жизни и смерти клетки. (Попков В.М., Чеснокова Н.П., Захарова Н.Б., 2016).
Таким образом, апоптоз является общебиологическим механизмом, ответственным за поддержание постоянства численности клеточных популяций, а также формообразование и выбраковку дефектных клеток. Нарушение регуляции апоптоза приводит к возникновению различных заболеваний, связанных с усилением или, наоборот, ингибированием апоптоза. Следовательно, изучение механизмов регуляции различных этапов данного процесса позволит определенным образом воздействовать на его отдельные этапы с целью их регуляции или коррекции. В настоящее время общепринято: если клетка погибает от апоптоза — подразумевается возможность терапевтического вмешательства, если вследствие некроза — нет. На основе знаний о программированной гибели клетки используется широкий ряд препаратов с целью регуляции этого процесса в различных типах клеток.
Многообещающими являются также подходы, связанные с регуляцией апоптоз- специфических генов и реализующиеся, в частности, в генной терапии — одной из самых перспективных областей современной медицины — при лечении заболеваний, вызванных нарушением функционирования отдельных генов. (Макаренко Н.И., Поддубная И.В., Подрегульский К.Э., 2006).
Источник: medconfer.com
Апоптоз — это генетически регулируемая программа клеточной гибели, которая имеет определенные морфологические критерии и биохимические маркеры. Эта программа очень важна для нормального развития многоклеточного организма, сохранения нормального числа полноценных и своевременного удаления поврежденных клеток.
Термин «апоптоз» (гр. аро — полное, ptosis — падение, утрата) предложил в 1972 году J. F. Kerr, заимствовав его у Гиппократа, назвавшего так осенний листопад.
Известно, что действие сильных повреждающих факторов вызывает некроз клетки. Гибель клетки в этом случае обусловлена избыточной внешней энергией (физической, химической или биологической), нарушающей ее внутриклеточный энергетический баланс и приводящей к потере структурной целостности.
В последние годы растет интерес к запрограммированной гибели клеток — апоптозу. Важно понимать, что фактор, вызывающий апоптоз, не обладает достаточной энергией для непосредственного повреждения клетки. Он лишь включает ее собственные механизмы самоуничтожения, т.е. апоптоз реализуется за счет внутренней энергии клетки и является таким же неотъемлемым свойством живого, как рост, пролиферация и размножение.
Возможности регуляции клеточной жизни всегда вызывали большой интерес биологов и врачей. Если процессы пролиферации являются достаточно изученными, то точка зрения на регуляцию разрушения (умирания) клеток пока еще не оформлена в окончательном виде в то же время при многих состояниях нарушения именно этой программы становятся определяющими для течения заболевания.
Апоптоз имеет четко выраженные и довольно хорошо изученные морфологические критерии: уменьшение размеров, сморщивание клетки, конденсация и фрагментация ядра, разрушение цитоскелета при сохранении целостности клеточной мембраны.
Апоптотические тельца
Когда процесс внутренней деградации завершен, клетка представляет собой совокупность фрагментов цитоплазмы, окруженных мембранами (т. н. апоптотические тельца). Изоляция внутриклеточного содержимого элементами цитолеммы является главной причиной отсутствия асептического воспаления при апоптозе. Таким образом, гибель клетки путем апоптоза (в отличие от некротической) переносится организмом относительно «безболезненно». В последующем апоптотические тельца фагоцитируются макрофагами, где макромолекулы погибшей клетки расщепляются до мономеров.
Сегодня установлено множество факторов, способных индуцировать апоптоз клетки. С другой стороны, некоторые воздействия могут повысить устойчивость к запрограммированной гибели (табл. 1).
|
I. Ингибиторы апоптоза |
|
Физиологические ингибиторы |
|
|
Гены вирусов |
|
|
Фармакологические агенты |
|
|
II. Индукторы апоптоза |
|
Физиологические активаторы |
|
|
Агенты, вызывающие повреждение |
|
|
Агенты, связанные с лечением каких-либо заболеваний |
|
|
Токсины |
|
В иммунной системе апоптоз выполняет по крайней мере две функции. Во-первых, апоптоз это эффекторный механизм иммунных реакций. Вторая функция апоптоза — регуляция иммунного ответа.
Эффекторный механизм иммунных реакций
см. Клеточная цитотоксичность
Регуляция иммунного ответа
Апоптоз иммунокомпетентных клеток является неотъемлемым компонентом иммунных реакций. Установлено, что селекция антигенспецифических Т- и В-лимфоцитов сопровождается массовой гибелью активированных, но антигеннеспецифических лимфоцитов. С другой стороны, результатом иммунного ответа является накопление избыточного количества антигенспецифических Т- и В-клеток, что ведет к нарушению генетически детерминированного баланса клеток макроорганизма. Выравнивание клеточного баланса после удаления патогена обусловлено именно запрограммированной гибелью большей части антигенспецифических лимфоцитов.
Цитоплазматический апоптоз
Как уже указывалось, апоптоз является внутренним свойством клетки, своеобразной ее реакцией на различные внешние раздражители. Поэтому неудивительно, что в любой клетке человеческого организма функционирует целая система цитоплазматического апоптоза (рис. 32), Информация о структуре компонентов этой системы содержится в геноме и передается от поколения к поколению. Указанную систему цитоплазматического апоптоза условно можно разделить на три части. Первая — это совокупность мембранных рецепторов, способных воспринимать проапоптотические сигналы из внутренней среды организма. Вторая — это комплекс цитоплазматических посредников, передающих воспринятый рецептором сигнал внутрь клетки к эффекторному звену. Третья — это эффекторное звено апоптоза, т.е. те компоненты, активация которых приводит к непосредственной гибели клетки.
Рецепторы апоптоза
Сегодня открыт целый ряд рецепторов, воспринимающих проапоптотические сигналы. Это Fas (CD95), TNF-R1 (рецептор 1-го типа к ФНО-α), DR3 (WS1-1), DR4 (TRAIL-рецептор 1), DR5 (1 RAIL-рецептор 2), DR6. Хотя указанные рецепторы приводят к одному и тому же биологическому эффекту, они относятся к разным семействам и поэтому отличаются по структуре. Так, Fas и TNF-R принадлежат к семейству рецепторов к ФF10, а молекулы DR — к антигенам гистосовместимости. Общность их биологического действия обусловлена природой молекул, связанных с цитоплазматической частью рецептора. Такие молекулы получили название доменов смерти Именно они и приводят к активации апоптоза. Наиболее изученными доменами смерти являются молекулы FADD и TRADD.
Ферменты апоптоза
Цитоплазматическими посредниками в системе апоптоза являются специальные ферменты, каспазы. Каспазы способны к последовательной активации друг друга, поэтому образуют своеобразный внутриклеточный каскад, включаемый доменами смерти. Домены смерти находятся на внутренней поверхности цитолеммы в неактивном состоянии. При активации рецептора, с которым функционально связан тот или иной домен, происходит изменение конформации обеих структур. Вследствие этого высвобождается активный центр домена, и он приобретает возможность взаимодействовать с каспазой 8 — инициатором всего каспазного каскада. Конечным компонентом этого каскада является каспаза 7. Именно этот фермент активирует латентную эндонуклеазу, оказывающую непосредственный повреждающий эффект на генетический материал клетки (разрывает ДНК в межнуклеосомных участках). Таким образом, эффекторным звеном системы апоптоза является латентная эндонуклеаза.
Митохондриальный апоптоз
Кроме цитоплазматических, в клетке содержится комплекс митохондриальных посредников апоптоза. Известно, что разрушение митохондриального аппарата приводит к неминуемой гибели клетки, поскольку последняя лишена энергетического обеспечения Для предотвращения некроза при повреждении митохондрий активируются указанные белки, обуславливающие более экономную апоптотическую гибель нежизнеспособной клетки. Таким образом, каскад апоптоза может реализовываться как по цитоплазматическому, так и по митохондриальному пути.
см. Регуляция апоптоза
Источник: wiki-med.com
| Животные | Растения |
|---|---|
| ДНК фрагментируется на участки длиной примерно 180 пар оснований. | Длина фрагментов ДНК варьирует от 140 до 50 000 пар нуклеотидов. Фрагментация ДНК не наблюдается в трахеидах, древесинных и лубяных волокнах. |
| Ca2+-зависимые эндонуклеазы участвуют во фрагментации ДНК. Почти во всех случаях (за исключением одного случая у C. elegans) нуклеазы является продуктом самой погибающей клетки. | Нуклеазы встречаются в некоторых погибающих клетках растений, но пока не получены прямые доказательства их участия в программируемой клеточной смерти. Растительные нуклеазы могут быть Ca2+ или Zn2+-зависимые. Некоторые нуклеазы активируются как Ca2+, так и Zn2+. Нуклеазы могут синтезироваться самой погибающей клеткой или транспортироваться из соседних. |
| В процессе апоптоза происходит накопление фосфатидилсерина на внешней стороне клеточной мембраны. Наличие фосфатидилсерина может быть обнаружено за счёт связывания аннексина V. | Наличие фосфатидилсерина (за счёт связывания аннексина V) пока обнаружено только в протопласте табака, подвергнутого абиотическому стрессу. |
| Конденсация, усадка и фрагментация цитоплазмы всегда заметны. | У растений отмечается конденсация и усадка цитоплазмы, но без фрагментации. |
| Клетки сжимаются, сокращаются в размерах. | Клетки большинства типов тканей сжимаются, «усыхают» в процессе гибели. Исключение составляют трахеиды, древесинные и лубяные волокна. |
| Процесс апоптоза представляет собой комплекс хорошо организованных и отлаженных механизмов с участием эффекторов, адаптеров, регуляторов и сигналов. | Механизм программируемой клеточной гибели пока остаётся недостаточно исследованным. Выявлены эффекторы, сигнальные и некоторые регуляторные молекулы. Не известны адаптеры. |
| Экспрессированные и активированные эффекторные каспазы (цистеиновые протеазы) и гранзимы избирательно расщепляют целевые белки в области аспартатных остатков. | Экспрессия цистеиновых протеаз наблюдается в некоторых случаях, но не исключительно в процессе клеточной гибели. Субстраты для некоторых цистеиновых протеаз не определены. Специфика каспаз также не известна. Гомология каспазам животных очень низкая. |
| Погибающие клетки захватываются и элиминируются путём фагоцитоза соседними клетками или макрофагами. | После гибели растительной клетки сохраняется её клеточная стенка. Трахеиды, древесинные и лубяные волокна вообще начинают функционировать только после отмирания клеточного содержимого. Цитоплазма гибнущей клетки почти всегда элиминируется путём аутофагии в вакуолях, и, вероятно, в лизосомах. |
| Антиапоптозный белок Bcl-xL подавляет апоптоз, по крайней мере, в некоторых клетках. | Bcl-xL не подавляет апоптоз, связанный с гиперчувствительным ответом. |
| Активные формы кислорода, такие как O2 и H2O2, могут выступать в качестве сигнальных молекул, активирующих апоптоз. | O2 и H2O2 вовлечены в процесс клеточной гибели, особенно при гиперчувствительном ответе на биотический или абиотический стресс. Однако окончательных доказательств их участия в процессе гибели пока нет. |
| Увеличение концентрации Ca2+ в цитозоле может запустить апоптоз путём активирации эндонуклеаз и каспаз. | Увеличение концентрации Ca2+ в цитозоле может запустить ПКС путём активирации эндонуклеаз. Данные об Ca2+-зависимой активации протеинкиназ не получены. |
| Достоверно установлена роль митохондрий в процессе апоптоза. | Роль (если таковая имеется) митохондрий в ПКС является обоснованной. Существуют один или два доклада о причастности митохондрий к ПКС. |
| Клеточная мембрана подвергается блеббингу (пузырению). | Нет данных о блеббинге (пузырении) клеточной мембраны. |
| Сохраняется обычный уровень фосфорилирования/дефосфорилирования белков. | Фосфорилирование/дефосфорилирование белков зафиксировано только в клетках подвергнутых гипоксии и вовлечённых в гиперчувстительный ответ, а также в алейроновых клетках. |
| Исключение факторов роста способствует гибели клеток. | Существуют противоречивые данные о влиянии отсутствия факторов роста на гибель клеток. |
| Наблюдается конденсация хроматина в процессе апоптоза. | Конденсация хроматина при ПКС наблюдается не во всех типах клеток. |
| Расщепление и фрагментация ДНК наблюдается в опытах с применением ДНК-электрофореза с окрашиванием TUNEL-методом. Расщепление ДНК происходит в линкерных участках между нуклеосомами, и приводит к образованию олигонуклеосомных фрагментов. | Не во всех типах клеток расщепление и фрагментация ДНК наблюдается в опытах с применением ДНК-электрофореза с окрашиванием TUNEL-методом. |
| Типичные апоптозные тельца содержат часть цитоплазмы клетки и фрагменты ДНК. | Нет данных о формировании апоптозных тел. |
| Стрессовые белки не синтезируются в процессе клеточной гибели. | Стрессовые белки, такие как гидроксипролин, глицин, арабиногалактан, часто синтезируются и становятся неотъемлемыми компонентами клеточной стенки в некоторых типах погибающих клеток. |
Источник: ru.wikipedia.org