Свойства митохондрий
Митохондрии (от греч. Mitos — нить и chondron — зерно) относятся к енергопродукцийнои системы клетки и к мембранного типа органелл. Выявлено, что ферменты цикла Кребса и дыхательной цепи окислительного фосфорилирования
локализуются в митохондриях. Митохондрии присутствуют во всех эукариотических клетках, за исключением отдельных видов амеб и зрелых эритроцитов животных. Гомологами митохондрий у прокариот является мезосомы (от греч. Mesos — средний и soma — тело) — складчатые выпячивания клеточной мембраны.
Строение митохондрий. Различают удлиненные (овальные или цилиндрические), иногда разветвленные митохондрии длиной 3-7 мкм и толщиной 0,2-1 мкм и круглые (шарообразные) диаметром 0,2-1 мкм.
Электронномикроскопически обнаружено, что митохондрия сверху окружена гладкой мембраной, под ней находится складчатая, которая образует кристи (гребни), содержание митохондрии носит название матрикса (рис. 2.23). На нефиксированных электронно препаратах с обеих сторон крист обнаружены мелкие грибовидные тельца, головки которых имеют около 9 нм в диаметре, а ножки 3-4 нм толщиной. Эти тельца названы оксисомамы, содержат ферменты, участвующие в окислительном фосфорилировании, т.е. в присоединении фосфатных остатков в аденозиндифосфата (АДФ) с образованием АТФ (аденозинтрифосфосфату или аденозинтрифосфорной кислоты).
Функции митохондрий. Митохондрии участвуют в энергетических процессах клетки, они содержат ферменты, связанные с образованием энергии и клеточным дыханием. Иными словами, митохондрия является своеобразной биохимической Минифабрика, которая трансформирует (преобразовывает, а не производит) энергию органических соединений (например, жирных кислот) на прикладное энергию, биологически помещенную в АТФ (» миниакумулятор «).
Митохондрии постоянно движутся, совершая вращательные движения, благодаря которым они перемещаются, приближаясь к структурам, используют много энергии. Эта энергия должна быть биологически прикладного, то есть такой, которую легко можно использовать для нужд клетки, лучшей является химическая энергия аккумулированная в АТФ. В отдельных клетках движение митохондрий ограничен только определенным пространством, например, в волокнах поперечнопосмугованих мышц между миофибриллами.
В митохондриях энергетический процесс начинается в матриксе, где происходит расщепление пирувата в цикле трикарбоновых кислот. Во время этого процесса освобождаются атомы водорода.
анспорт атомов водорода осуществляется по цепи НАДН à ФАДН2 à КоQН2, в котором выделяется его кинетическая энергия в виде теплоты. Далее атом водорода диссоциирует на протон и электрон), которые акцептуются коферментом никотинамид (НАД). Поэтому электроны водорода передаются по цепи дыхательных ферментов — флавопротеидов и цитохромов, высвобождают свою кинетическую энергию, а в конце соединяются с протонами и образуют молекулы воды. Энергия, которая при этом освобождается, используется в нескольких точках дыхательной цепи для осуществления реакции фосфорилирования — синтеза АТФ, то есть присоединения фосфатной группы к АДФ. Это происходит на внутренней мембране митохондрий. Электрохимический потенциал, возникающий в результате работы цепи переноса электронов, обеспечивает транспорт внутрь митохондрии ионов К +, Са2 +, Mg2 +.
Таким образом, реакция окисления (переноса электронов) сопряженная (тесно связана) с реакциями фосфорилирования, когда 55 % энергии идет на синтез АТФ, а 45 % рассеивается в виде тепловой энергии. При инфекционных заболеваниях, действия неблагоприятных физико — химических факторов (температуры, радиации и т.п.), эти процессы разъединяются, больше энергии излучается в виде тепловой, и поэтому повышается температура в клетке и в организме. Кроме того, митохондрии участвуют в регуляции обмена воды, депонировании ионов кальция, продукции предшественников стероидных гормонов.
Локализация митохондрий. Митохондрии могут быть рассеяны по всей цитоплазме или сосредоточены в участках, где возникает наибольшая потребность в АТФ. Часто митохондрии размещены равномерно по цитоплазме (например, в печеночных клетках). Отмечена особая локализация митохондрий в поперечнопосмугованих мышцах — вдоль миофибрилл, в хвосте сперматозоида — у его основания, в искореженных канальцах почки — в складках плазмолеммы на базальном полюсе клеток, в нервной системе — в области синапсов, в париетальных клетках желез желудка — плотно у агранулярного эндоплазматической сети.
Количество митохондрий в клетках различных типов бывает разной и зависит от энергетических потребностей клетки. Так, в печеночных клетках насчитывают до 500 мелких митохондрий, тогда как в малых лимфоцитах крови их всего несколько. Количество крист в митохондриях также связана с энергетическими потребностями клетки, в частности в мышечных клетках митохондрии содержат очень большое количество крист. При повышенной функции клетки митохондрии приобретают более овальной или удлиненной формы и количество крист в них растет.
Обновление митохондрий. Митохондрии относятся к саморепликуючих (способных к размножению) органелл. Обновление митохондрий происходит в течение всего клеточного цикла. Например, в клетках печени они заменяются новыми через около 10 дней. Наиболее вероятным путем воспроизведения митохондрий считают их разделение: посередине митохондрии появляется перетяжка или возникает перегородка, после чего органеллы распадаются на две новые митохондрии.
Источник: worldofscience.ru
Что такое митохондрия
Митохондрия – мембранная закрытая органелла, ответственная за преобразование из жиров и углеводов (глюкозы) в пригодные для использования организмом формы энергии. [р, р]
Самой основной функцией митохондрий является производство АТФ, основного источника энергии для всех клеток. АТФ (ATP, аденозинтрифосфа́т или аденозинтрифосфорная кислота) используется для всех функций клетки, и мы должны съесть пищу, чтобы пополнить запасы АТФ. [Р]

Митохондрии используют кислород для производства АТФ в процессе, известном как аэробное или клеточное дыхание. В этой реакции используется кислород и производится углекислый газ, который мы выдыхаем через легкие. [Р]
Количество митохондрий в клетке меняет с каждым типом клетки. В зависимости от энергетических потребностей клетки происходит увеличение числа митохондрий, например в мышечных клетках количество митохондрий будет расти. Это позволяет вырабатывать и использовать больше энергии в наиболее активных клетках. [Р]
Помимо производства энергии митохондрии играют важную роль в контроле над уровнями кальция, помогая сбалансировать энергетическую потребность и производство этой энергии в клетке. [Р]
Она также отвечает за инициирование разрушения старых и поврежденных клеток, процесса, называемый апоптозом. Это необходимо, чтобы освободить место для роста и регенерации клеток после травм и для предотвращения возникновения и роста раковых клеток. [р, р, р]
Продукты, возникающие в процессе деятельности митохондрий, накапливаются и производят свободные радикалы. Это вызывает окислительный стресс в организме, который является основной причиной практически всех возрастных заболеваний. [Р]

Неправильная (нарушенная) работа митохондрий приводит к нарастанию отходов и уменьшает возможность избавления от “плохих” клеток. Это может привести к возникновению злокачественной опухоли. [Р]
Сегодня митохондрии являются мишенью ряда новых перспективных методов лечения рака, сердечной недостаточности, резистентности к инсулину и нарушений в работе мозга. [Р]
Поскольку энергия занимает центральное место в жизни, улучшение функции митохондрий напрямую связано с нашим физическим и психическим здоровьем.
Происхождение митохондрий
Некоторые из первых живых организмов на Земле были одноклеточными прокариотическими организмами, как современные бактерии. Люди – это эукариотические организмы, что означает, что мы составлены из эукариотических клеток. Предполагается, что эукариоты произошли от прокариотических клеток. [р, р].
Прокариоты отличаются от эукариот несколькими особенностями: [Р]
- Прокариоты не имеют внутренних отсеков (органелл).
- ДНК у них круговая, а не линейная, как у эукариот.
- Прокариоты не имеют ядра, и поэтому их ДНК свободно плавает в центре клетки, в то время как эукариотическая ДНК упакована в ядро каждой клетки.
- Прокариотическая ДНК проще, чем эукариотическая ДНК.
- Прокариоты тиражируются путем расщепления пополам и получения 2-х одинаковых копий (бинарное деление).

Благодаря своими сходствами, митохондрии, как считается, произошли от древних прокариотических клеток , таких как бактерии. [р, р]
Митохондрии похожи на древние бактерии:
- Конструктивно митохондрия напоминает бактерию.
- Она состоит из двойной мембраны, через которую синтезируется АТФ, подобно бактериальной продукции АТФ.
- Она имеет собственную кольцевую ДНК.
- Последовательность митохондриальной ДНК сильно напоминает последовательность ДНК у современных прокариот (риккетсии prowazekii).
- Как и прокариотические организмы, митохондрия может воспроизвести себя внутри клетки путем бинарного деления.
Сегодня наиболее широко развита теория, которая объясняет эти особенности с помощью теории эндосимбиоза (endosymbiotic). Эта теория предполагает, что древние прокариотические организмы, которые производили энергию с использованием кислорода, случайно слились с эукариотическими клетками, которые не используют кислород. Две клетки получили взаимную выгоду от совместной работы, как индивидуальной единицы (эндосимбионты). [р, р]
Способность использовать кислород для получения энергии оказалась благоприятной для выживания обеих клеток. Со временем совместные клетки превратились в современные эукариотические организмы. Митохондрия считается остатком исходных прокариотических организмов. [Р]
Митохондриальная ДНК
Большинство генома человека, который является ДНК человека, упаковано в 23 пары хромосом в ядре клетки. Помимо ядерной ДНК, человеческие клетки также несут определенный набор из 37 генов, которых только нашли в митохондриях. [Р]
Митохондриальная ДНК (мтДНК) – в основном, содержит только кольцевые молекулы ДНК. Каждая митохондрия несет от 2 до 10 копий этих молекул. [Р]

Митохондриальная ДНК кодирует белки, необходимые для митохондриальной функции. [Р] 23 пары хромосом в ядре наследуются от обоих родителей после прохождения рекомбинации, что делает вас уникальным. [Р] С другой стороны, митохондриальная ДНК может передаваться по наследству только по материнской линии. Отцовская мтДНК разрушается после того, как сперматозоид проникает в яйцеклетку. [Р]
Функции митохондрий
Митохондрия отвечает за преобразование жиров и углеводов в АТФ – топливо клетки. Кроме того, митохондрии могут вызывать гибель клетки, когда это необходимо, контролировать уровень кальция и разрушать молекулы на углеродной основе. [р, р]
Побочные продукты нормальной работы митохондрии накапливаются и производят свободные радикалы. Это приводит к окислительному (оксидативному) стрессу, который является основной причиной почти всех серьезных возрастных заболеваний. [Р]
Митохондрии являются электростанциями клетки
Наиболее значительную роль, которую играют митохондрии – это производство АТФ. Серия биохимических реакций внутри и вне митохондрий приводит к продукции АТФ через вызванный процесс оксидативного фосфорилирования. Такая нормальная клеточная функция требуют получения пищи и кислорода для производства энергии. [Р]
Жиры, углеводы и белки обеспечивают организм различным количеством АТФ при расщеплении [Р].
Углеводы, которые преобразуются в молекулы глюкозы, являются самыми быстрыми, чтобы генерировать 34-38 молекул АТФ из каждой молекулы глюкозы. Для нашего тела это предпочтительная форма энергии. [Р]
Жиры начинают использоваться для выработки энергии, когда уровни глюкозы снижаются. Одна молекула пальмитиновой кислоты, входящая в насыщенные жиры, может производить 130 молекул АТФ. Однако, расщепление жиров (липолиз) – это гораздо более сложный процесс, и может занять до 72 часов для переваривания после приема жирной пищи. [Р]

Белки начинают использоваться для получения энергии, только когда организм не имеет запасов на глюкозы, ни жира. [Р]
Существует 3 стадии клеточного дыхания [Р]: гликолиз, цикл Кребса, и окислительного фосфорилирования.
Митохондрии могут вызвать смерть клеток
Митохондрии играют важную роль в инициации клеточной смерти, когда клетка повреждена или старая. Это полезно для нашего организма, чтобы сосредоточиться на выработке энергии для клеток и тканей, которые имеют более высокие потребности в энергии. Клеточная смерть также предотвращает распространение мутировавших и дефектных клеток. Процесс клеточного самоубийства называется апоптозом, который во многом основан на выпуске белков “самоубийц” из митохондрий. [р, р]
Когда митохондрии повреждены, то могут сами себя уничтожить с помощью процесса, называемого – митофагия (mitophagy), когда происходит выборочное разрушение митохондрий. [Р]
Электрон-транспортной цепи, найденные во внутренней мембране митохондрий, часто проявляют утечку свободных радикалов, или активных форм кислорода (АФК). Это может приводить к окислительному стрессу в клетках. Свободные радикалы реагируют со многими другими веществами в клетке, что приводит к повреждения ДНК и разрушению многих жизненно важных белков. [р, р]
Рост окислительного стресса связан с более чем 200 заболеваниями человека. Апоптоз, или запрограммированная смерть клетки, предотвращает накопление свободных радикалов. Митохондрии могут реагировать на апоптотические сигналы внутри (внутренний путь) и снаружи клетки (внешний путь). [р, р]
Помимо свободных радикалов, некоторые белки могут связываться с рецепторами на поверхности клетки и инициировать апоптоз. Эти сигналы смерти, и они высвобождаются в ответ на мутации ДНК, воздействие радиации, или от недостатка питательных веществ. [Р, Р]
Когда сигналы смерти связываются с их приемным устройствам на клетке, то они стимулируют начало нескольких химических реакций, которые приводят к изменениям в митохондриальной мембране. Это стимулирует движение белков в матриксе митохондрий, высвобождение белка, называемого цитохромом С, от внутренней мембраны. [р, р]
Цитохром С является одним из белков в транспортной цепи электронов. Когда он выходит из митохондрий, то клетка должна запустить апоптоз. Это является определяющим фактором клеточной гибели. [р, р]
Митохондрии играют роль в разрушении органических молекул
Митохондрии содержат ферменты, которые разрушают много различных молекул, используемых в дальнейшем для получения энергии в клеточном дыхании. Эти ферменты также производят промежуточные молекулы, которые состоят только из одного атома углерода. Эти молекулы на 1-углеродной основе обладают высокой реакционной способностью и могут конфликтовать с естественной клеточной активностью. [р, р]
Внутри митохондрий такие молекулы из 1-го углерода превращаются в различные аминокислоты, необходимые для производства АТФ и белков. Витамины В9, В12, В6 и В2 обеспечивают углерод, необходимый для проведения этих реакций. Недостаток в организме витаминов группы В связан с возрастными заболеваниями, такими, как болезнь Альцгеймера, сердечно-сосудистых заболевания и рак. [р, р]
Производство «heme» (гема), структурного ядра гемоглобина, находящегося в эритроцитах, является примером одного важного вещества из 1-го углерода, вырабатываемого в митохондриях. Гемоглобин – это железо-содержащий белок, который транспортирует кислород по всему телу. [Р]
Такие 1-углеродные молекулы экспортируются из митохондрий для того, чтобы участвовать в производстве некоторых из строительных блоков ДНК. Это происходит в желеобразной жидкости (цитоплазме), которая заполняет внутренность клетки, и откуда различные вещества могут перемещаться во все части клетки по мере необходимости, или экспортироваться в другие ткани. [Р]
Митохондрия регулирует уровень кальция в клетке
Митохондрии контролируют уровни кальция в клетке для того, чтобы координировать продукцию энергии вместе со спросом на эту энергию. Уровень кальция в клетке повышается для активации практически любого биохимического пути. Активация клеток, в свою очередь, требует энергии, поэтому митохондрии придется увеличить производства АТФ. [Р]
Когда кальций поступает в клетку, то концентрация кальция увеличивается вне митохондриальной матрицы. Это создает градиент концентрации, который управляет подачей кальция в матрицу. [Р] В клетках ткани мышц поступление кальция приводит к увеличению производства митохондрий. Подобное позволяет усилить снабжение энергией и удовлетворить спрос энергии в этой ткани. [Р]
Признаки нарушения работы митохондрий
- Вы чувствуете себя слишком уставшими [Р]
- Вы не можете тренироваться в течение длительного периода времени [Р]
- Вы чувствуете одышку, особенно во время физической нагрузки [р, р]
- У вас плохой рост костей и их здоровье [Р]
- Вы с трудом контролирует свои движения, равновесие и координацию [Р]
- Вам тяжело ходить или говорить [Р]
- У вас есть мышечная слабость и боль [Р]
- У вас есть заболевания сердечной мышцы (кардиомиопатия) [Р]
- У вас есть кишки и пищеварительные проблемы [Р]
- У вас есть заболевания печени и почек [Р]
- Вы имеете обвислые веки, снижение зрения и другие проблемы с глазами [Р]
- У вас сахарный диабет и другие гормональные расстройства [р, р]
- У вас проблемы со слухом [Р]
- У вас увеличивается количество случаев мигрени, инсультов и судорог [р, р]
- У вас есть трудности с запоминанием [Р]
- У вас задержка в развитии [Р]
- У вас есть рецидивирующие инфекции [р, р]
- Вы аутист [Р]
Заболевания, связанные с нарушением работы митохондрий

Рак и нарушение в работе митохондрий
Раковые клетки требуют от митохондрий питания для роста опухолей. Раковые клетки также увеличивают количество своих митохондрий, чтобы обеспечить потребность в этой энергии. [Р]
С другой стороны, раковые клетки увеличивают объем работы митохондрий, в которых начинают скапливаться свободные радикалы. Окислительный стресс увеличивается в раковых клетках, и от него повреждаются окружающие ткани. [Р]
Одним из признаков рака является способность клеток избегать программируемой клеточной смерти (апоптоза). В нормальных здоровых клетках митохондрия вызвала бы этот процесс смерти, если бы клетка воспроизводила слишком много энергии или делала это слишком быстро. Однако, в раковых клетках, происходит избегание апоптоза путем увеличения разрушения митохондрий, которые собрали много свободных радикалов. Раковые клетки также включают антиоксидантные пути, которые защищают их и не вызывают гибель. [р, р]
Митохондрии в раковых клетках имеют более низкие уровни белков, которые способствуют клеточной смерти (BAX/BAK) и/или более высокие уровни белков, которые предотвращают гибель клеток (BCL-2/BCL-XL). [р, р]
Раковые клетки также умеют производить энергию разными способами, через процесс, известный как эффект Варбурга. Производство энергии в большинстве таких клеток происходит без кислорода, через гликолиз. И этот процесс может идти без участия митохондрий, чтобы избежать апоптоза. [р, р] Аэробное дыхание через цикл Кребса и окислительное фосфорилирование все еще происходят в раковых клетках, но в меньшей степени.
Болезнь Альцгеймера, болезнь Паркинсона, боковой амиотрофический склероз и нарушения в работе митохондрий
Митохондриальная дисфункция является важной причиной связанных с возрастом нейродегенеративных заболеваний, таких как болезнь Альцгеймера, бокового амиотрофического склероза и болезни Паркинсона. Накопление свободных радикалов с возрастом наносит повреждения в ДНК. В митохондриях накапливаются дефектные белки, которые вызывают снижение производства энергии, и в конечном итоге, гибель клеток. [Р]
Болезнь Альцгеймера
- Белок бета-амилоида накапливается вокруг наружной митохондриальной мембраны.
- Такое увеличение количества белка уменьшает продукцию АТФ и увеличивает оксидативный стресс, что в конечном счете приводит к смерти клетки.
- Бета-амилоид увеличивает производство митохондриального белка.
- Митохондриальные энзимы снижают свою работу, приводя к уменьшенным уровням ATФ.
- Митохондрии внутри клетки претерпевают структурные изменения. Вместо того, чтобы существовать в длинных трубках, митохондрии разделены на маленькие части внутри клетки (деление). Это усиливает общую дисфункцию клеток головного мозга у пациентов с болезнью Альцгеймера. [Р]
Болезнь Паркинсона
- Отличительной чертой болезни Паркинсона является накопление альфа-синуклеинового белка, что приводит к гибели клеток и потере нейронов.
- Пациенты с болезнью Паркинсона аккумулируют этот протеин в митохондриях, что способствует увеличенному оксидативному стрессу и уменьшению производства энергии.
- Parkin protein (E3 ubiquitin ligase) и pink1 protein ответственны за маркировку поврежденных митохондрий для их разрушения. У пациентов с болезнью Паркинсона содержатся низкие уровни этих белков.
- Поврежденные, слабо работающие митохондрии не деградируют и остаются в клетке.
- Альфа-синуклеин продолжает накапливаться, что приводит к нейродегенерации. [Р]
Диабет и нарушение работы митохондрий
Неправильная работа митохондрий обнаруживается у пациентов с диабетом 1-го типа и с диабетом 2-го типа. В клетках пациентов с диабетом обнаруживаются низкие уровни глюкозы. [р, р]
Митохондрии разбиваются на небольшие фрагментированные сети (увеличенное деление, уменьшенное слияние) по всей клетке. Это обнаруживается как в случае диабета 1-го типа, так и 2-го типа. [Р]
Диабет 2 типа вызван резистентностью к инсулину в клетках, снижая количество глюкозы, доступной для дыхания. Это уменьшает выработку АТФ и, таким образом, энергию, доступную для клеток. [Р]

Неизвестно, является ли митохондриальная дисфункция причиной резистентности к инсулину или ее симптомом. Некоторые данные указывают на митохондрии, как на причину инсулинорезистентности, а не на симптом. [Р]
У пациентов с сахарным диабетом 2-го типа обнаруживаются пониженные уровни митохондриальных белков, ответственных за выработку энергии. [р, р]
Сердечная недостаточность и нарушение работы митохондрий
Клетки сердца в значительной степени полагаются на митохондрии, чтобы питать себя энергией. Митохондриальная дисфункция является причиной сердечной недостаточности из-за нарастания окислительного стресса. [Р]
У пациентов с сердечной недостаточностью снижается активность митохондрий. Они проявляют более низкую активность в транспортных цепях электронов. Это вызвано потерей кислорода в митохондриях [Р]. Это приводит к накоплению электронов, которые производят свободные радикалы. [Р]
Синдром хронической усталости и нарушение работы митохондрий
Синдром хронической усталости – это пожизненное нарушение в организме, характеризующееся длительными (>6 месяцев) симптомами сильной усталости, которые могут снизить жизнедеятельность организма более чем на 50%.
Пациенты с хронической усталостью страдают от множества других симптомов, включая [Р]:
- Тревога
- Депрессия
- Головная боль
- Мышечная боль
- Нарушение работы мозга
Хотя когда-то считалось, что это заболевание больше психологического характера, но сегодня есть все больше доказательств, что митохондриальная дисфункция является одной из основных причин этого расстройства. [Р]
Многочисленные клинические испытания были проведены и дали смешанные результаты. Синдром хронической усталости может быть вызван одной или несколькими из следующих митохондриальной патологии [Р]:
- Уменьшенное количество митохондрий
- Более низкие уровни L-карнитина, ALCAR, убихинона или CoQ10
- Снижение активности белка в транспортной цепи электронов (окислительное фосфорилирование)
- Снижение производства АТФ
Ряд других исследований указали, что структура митохондрий и их работы были без существенных различий нормальных и больных пациентов. Необходимы дополнительные исследования для выяснения причин этого заболевания, и выявление роли митохондриальной дисфункции.
Источник: kodelife.ru
Митохондрии – маленькие труженики или большие начальники?
Если вы думаете, что самая важная для нас история совместной жизни начинается во время свадьбы, то это совсем не так. Самая важная история совместной жизни каждого человека началась более миллиарда лет назад, когда наши далекие одноклеточные предки вынуждены были подписать «брачный контракт» с теми, кого мы сейчас называем митохондрии (см. теория симбиогенеза).
Митохондрии имеют две мембраны (внутреннюю и внешнюю) и собственный наследственный материал в виде ДНК (рис.1). На внутренней мембране митохондрий находится система окислительного фосфорилирования, работа которой обеспечивает окисление энергетических субстратов с образованием АТФ.
Рис. 1. Схематическое строение митохондрии
В брачном контракте клетки и митохондрии нет пункта «в болезни и здравии», — и хорошо. Если митохондрия становится старой, клетка может ее убить в процессе митофагии, а митохондрии, в свою очередь, регулируют процесс апоптоза у недееспособных и старых клеток. Если процесс обоюдного контроля качества нарушается, запускаются механизмы старения. Нарушаются механизмы апоптоза, увеличивается количество свободных радикалов, не контролируемых митохондрией. Это вызывает системное воспаление, повреждение ДНК клетки. Таким образом, есть сильная взаимосвязь между МХ дисфункцией, возраст-зависимыми заболеваниями, старением организма и метаболическими дисфункциями [1]. Метаболическая дисфункция – неизменный всадник апокалипсиса старения.
«Как белка в колесе» — динамика митохондрий
Не вся вина за метаболические нарушения лежит на нашем переедании. Метаболические нарушения связывают, в первую очередь, с неспособностью митохондрий справиться с питательными веществами. Митохондриям в клетке приходится нелегко. Мы «кормим» свои клетки то слишком много, то слишком мало, а предъявляем им «заявку» выдать энергию в виде АТФ, количество которой точно должно соответствовать нашим потребностям. Для того чтобы регулярно «выкручиваться» из этой ситуации митохондрии и правда используют некоторые «движения» — деление (fission) и слияние (fusion). Эти «митодвижения» объединяют под названием «динамика митохондрий». Баланс между делением и слиянием митохондрий — центральный механизм биоэнергетической адаптации к метаболическим потребностям клетки [2, 3].
Больше всего митохондрий находится в тканях с высокими энергетическими потребностями, — мышцы, печень, бурая жировая ткань, мозг. Неудивительно, что и динамика митохондрий в этих тканях изучена лучше.
Итак, если в клетку какой-либо из этих тканей (кроме некоторых нейронов в мозге, об этом потом) поступает большое количество питательных веществ (поступление превышает затраты), то митохондрии находятся в разделенном (фрагментированном) состоянии. Если клетка находится в состоянии голода (поступления меньше затрат), то происходит слияние митохондрий и они находятся в соединенном состоянии. [3,4]. Так поддерживается гомеостаз клетки (рис.2).

Рис. 2 Регулирование морфологии и биоэнергетической эффективности митохондрий в ответ на избыточное или недостаточное поступление питательных веществ [из 2]
Клеточный метаболический гомеостаз зависит от баланса между потреблением питательных веществ и их расходом. Перемены в поставке питательных веществ приводит к клеточным адаптациям для восстановления баланса. Избыток питания приводит к фрагментации митохондриальной сети, что вызывает снижение биоэнергетической эффективности митохондрий. Это позволит избежать потерь энергии. Напротив, при метаболическом голоде митохондрии удлиняются, чтобы увеличить свою биоэнергетическую эффективность.
В чем хитрость этих движений? Если клетка находится в состоянии голода, то слияние митохондрий позволяет увеличить их биоэнергетическую эффективность (количество АТР, которое создается на молекулу питательного вещества). Если же в клетку поступает избыток питательных веществ, то их можно либо 1) запасти, либо 2)рассеять эту энергию в виде тепла. Задача митохондрий в этом случае, — рассеять больше энергии в виде тепла, запасти меньше в виде АТФ (накопление NADH и АФК приведет к окислительному стрессу). Фрагментация митохондрий позволяет им снизить биоэнергетическую эффективность, главным механизмом снижения которой считается «утечка» протонов.
Так что, мы ходим на работу, а жизнь митохондрий постоянно протекает в режиме цикла деления и слияния (рис 3).

Рис.3 Баланс энергопотребления и энерогообеспечения связан с соответствующими изменениями архитектуры митохондрий и их биоэнергетической эффективностью [из 3]
Физиологические процессы, связанные с увеличением спроса на энергию и снижением энергопоставок, (например, острый стресс, голодание и фаза G1/S) характеризуются удлинением митохондрий и дыханием, связанным с синтезом АТФ. С другой стороны, физиологические процессы, связанные с уменьшением спроса на энергию и увеличением ее поставок (высокий уровень питательных веществ, ожирение и диабет типа 2), связаны с фрагментацией митохондрий, выделением тепла или снижением функции митохондрий.
Здоровые циклы деления и слияния – залог метаболического здоровья клетки
Нормальный цикл деления митохондрий и их слияния является ключевым звеном контроля их качества. Почему? При делении митохондрий образуется две дочерние, одна из которых имеет более высокий мембранный потенциал и идет дальше в цикл слияния-деления, а другая, с более деполяризованной мембраной, остается отделенной до восстановления мембранного потенциала. Если потенциал восстанавливается, — она воссоединяется с митохондриальной сетью. Если она остается деполяризованной, то она элиминируется в процессе аутофагии, что является залогом качества пула митохондрий (рис.4).
Длительное ингибирование деления митохондрий (при длительном клеточном голодании) приводит к накоплению поврежденных митохондрий, которые не могут быть сегрегированы [3, 4].
С другой стороны, избыток питательных веществ приводит к ингибированию слияния митохондрий, что приводит к нарушению цикла митохондриальной динамики, увеличивает внутриклеточную митохондриальную гетерогенность. Да, при избытке еды фрагментация митохондрий протективна, однако длительная фрагментация, как и длительное слияние, вредна для контроля качества митохондрий. Не происходит селективного удаления, митохондриальная масса будет уменьшаться и состоять из небольших деполяризованных митохондрий.

Рис.4 Жизненный цикл митохондрий и его регулирование доступностью питательных веществ [из 3]
Митофузины – не просто какие-то белки
На молекулярном уровне слияние митохондрий является двухстадийным процессом, который требует координированного слияния внешней и внутренней мембран в ходе отдельных последовательных событий. У млекопитающих этот процесс регулируется тремя белками, которые относятся к GTPазам: Mfn1 и Mfn2 необходимы для слияния внешней мембраны, а ОРА1 – для слияния внутренней мембраны. Для деления нужны другие белки, — Fis1 и Drp1.
Роль белков-митофузинов была изучена в loss- and gain-of function studies. Мышки, мутантные по белкам-митофузинам, погибают еще в mid-gestation, потому что у них невозможным становится слияние митохондрий. Митофузины важны для процессов аутофагии и митофагии. Снижение экспрессии Mfn2 в кардиомиоцитах блокирует запуск процесса аутофагии, потому что блокируется слияние аутофагосом с лизосомами. Истощение Mfn2 приводит к снижению потенциала мембран митохондрий, для компенсации происходит снижение работы дыхательной цепи, возрастает поглощение глюкозы и снижается синтез гликогена. Клетка переходит на анаэробный глиоклиз, а это – путь к онкологическому перерождению клетки. Дефицит Mfn2 приводит к нейродегенеративным изменениям. Повышение экспрессии Mfn2 в скелетных мышцах повышает их чувствительность к инсулину.
Mfn1 выполняет сходные функции, однако, вероятно, в других тканях (экспрессия Mfn2 и Mfn1 различается в разных тканях) – Mfn1 экспрессируется в большей степени в сердце, печени, поджелудочной, яичках, а Mfn2 в сердце, скелетных мышцах, мозге, бурой жировой ткани.
Таким образом митофузины являются ключевыми регуляторами динамики митохондрий. Экспрессия митофузинов различна в различных органах, они обеспечвают биоэнергетическую эффективность и механизмы адаптации к доступности питательных веществ, а также от них зависит «судьба» клетки. Не удивительно, что митохондриальные fusion белки являются потенциальными таргетами фармакологических вмешательств [2, 5].
Гипоталамус, митохондрии, метаболическая дисфункция и старение
Динамика митохондрий важна во всех клетках. В бета-клетках поджелудочной железы митохондрии являются сенсорами питательных веществ и генераторами сигналов синтеза инсулина, в мышцах динамика митохондрий важна для регуляции метаболизма глюкозы и т.д. Однако человек не просто совокупность клеток разного типа, каждая из которых принимает самостоятельные решения. Организм – это система, у которой есть центральное регуляторное звено поддержания гомеостаза энергии и глюкозы. Этим главным регулятором является гипоталамус.
Гипоталамус расположен в промежуточном мозге и именно он обеспечивает взаимосвязь нервной и гуморальной систем регуляции. Нейроны гипоталамуса воспринимают, обрабатывают и реагируют на сигналы от жировой ткани (лептин), поджелудочной железы (инсулин), и прочие гормональные стимулы (грелин, холецистокинин, панкреатический полипептид и др.). Гипоталамус управляет деятельностью эндокринной системы человека благодаря тому, что его нейроны способны выделять нейроэндокринные трансмиттеры, стимулирующие или угнетающие выработку гормонов гипофизом. Иными словами, гипоталамус, масса которого не превышает 5 % мозга, является центром регуляции эндокринных функций и поддержания гомеостаза всего организма.
Еще Дильман (Дильман В. М «Большие биологические часы») указывал на ведущую роль гипоталамуса в планомерном развитии метаболической дисфункции, приводящей к ожирению, сахарному диабету, сердечно-сосудистым, онкологическим заболеваням и старению. Согласно сформированной Дильманом теории гиперадаптоза чувствительность рецепторов гипоталамуса к сигналам, поступающим от тканей организма (лептин, инсулин и др.) постепенно планомерно снижается с возрастом. Для того, чтобы вызывать его «ответ» нужно все больше и больше того или иного гормона, — больше инсулина, больше лептина. Развивается инсулин- и лептинрезистентность, метаболические заболевания, приводящие к старению и смерти.
В зависимости от выполняемых функций группы нейронов объединяют в ядра гипоталамуса. Одно из них – аркуатное (дугообразное) ядро является ключевым регулятором пищевого поведения и обмена веществ. В нем могут образовываться орексигенные нейропептиды (стимулируют аппетит) и анорексигенные (подавляют аппетит), относящиеся, соответственно к AgRP и POMC нейронам. Периферические сигналы (инсулин, грелин, лептин и др) влияют на экспрессию пептидов, стимулирующих либо подавляющих аппетит, что обеспечивает слаженность центральной регуляции (рис.5).

Рис. 5. Гипоталамический контроль метмболизма энергии. Мозг интегрирует метаболические сигналы (лептин, инсулин, грелин, PYY3-36) от периферических тканей, таких как поджелудочная железа, жировая ткань, желудок. В мозге специализированные нейронные сети координируют адаптивные изменения в поглощении и расходе пищи [из 5].
Так кто и как регулирует чувствительность нейронов гипоталамуса?
Изучение динамики митохондрий в тканях мозга показало, что динамика митохондрий играет существенную роль в способности нейронов гипоталамуса контролировать уровень глюкозы и гомеостаз энергии в организме [6,7,8].
В AgRP нейронах (hunger-promoting AgRP neurons), которые стимулируют аппетит и регулируют набор массы, голодание приводит к делению митохондрий, а high-fat feeding – к слиянию. То есть ответ митохондрий отличается от такового в большинстве других клеток.
Слияние МХ в этих нейронах регулирует электрическую активность в ответ на высокожировую диету, стимулируя выработку орексигенного пептида (AgRP пептида) оно необходимо для набора веса и отложения жира при избытке питательных веществ. Делеции Mfn1 и Mfn2 в этих нейронах приводили к меньшему набору веса у крыс за счет снижения уровня циркулирующего лептина.
РОМС нейроны (подавляют аппетит) имеют противоположную функцию, и динамика митохондрий в ответ на поступление питательных веществ у них иная. Снижение экспрессии митофузинов в этих нейронах приводит к нарушению связи митохондрий с ЭПС, а в результате – гиперфагия, лептинрезистентность и ожирение. При этом возрастало употребление пищи, а энергозатраты снижались.
Таким образом, ответ организма на высокожировую диету зависит от паттернов динамики митохондрий в нейронах гипоталамуса. Ремоделирование митохондрий в нейронах обеспечивает их ответ на поступление в организм питательных веществ, стимулирует выработку нейропептидов, которые будут либо стимулировать либо подавлять аппетит, влияя на метаболизм на уровне организма (Рис.6).

Рис.6. Метаболическая адаптация к стимулам окружающей среды [из 2]
В ответ на экзогенные стимулы Mfns вовлечены в трансдукцию метаболического сигналинга в разных органах, что обеспечивает поддержание гомеостаза энергии всего организма. В частности, в ответ на потребление пищи, изменения температуры, стресс или физические упражнения, бурая жировая ткань, мозг, сердце или скелетные мышцы адаптируют свой метаболизм для контроля питания, веса тела, сократительных функций, антиоксидантного ответа или чувствительности к инсулину.
Как повлиять на динамику митохондрий?
1. Питание и физические упражнения
Циклы питания Избыток пищи и высокожировая диета (HFD) ингибирует слияние митохондрий в клетках (в некоторых нейронах мозга механизм иной). Незавершенный цикл деления-слияния митохондрий нарушает процессы аутофагии → увеличивается внутриклеточная гетерогенность митохондрий → не происходит селективного удаления митохондрий → накапливаются митохондрии с дисфункцией.
Calorie restriction (fed/fasting cycle) стимулирует биоэнргетическую адаптацию, обеспечивая работу механизмов качества митохондрий.
2. Здоровые мембраны: стеариновая кислота, кардиолипин, фосфатидная кислота
От «здоровья» мембран митохондрий зависят все ключевые процессы, — аутофагия, митофагия, апоптоз, связь митохондрий с эндоплазматической сетью, динамика митохондрий. Мембраны клеточных органелл состоят из липидов и из белков. Ремоделирование этих мембран контролируется взаимодействиями между специфическими липидами и белками.
К насыщенным жирным кислотам относится пальмитиновая (С16) и стеариновая (С18). Показано, что употребление стеариновой кислоты (C18:0) стимулирует процесс слияния митохондрий. Действие ее связано с влиянием на митофузины. У мышей диетические добавки стеариновой кислоты могут частично восстанавливать митохондриальную дисфункцию, вызванную мутациями в генах Pink1 или parkin. В нейтрофилах людей, находящихся 2 дня на low-С18:0 диете, митохондрии находятся во фрагментированном состоянии (50% клеток имели фрагментированные МХ, 10 % соединенные МХ). Употребление стеариновой кислоты приводило у них к слиянию митохондрий через 3 часа [8]. Таким образом., стериновая кислота важна для поддержания циклов динамики митохондрий. Больше всего стеариновой кислоты находится в какао-бобах (31-34 %).
Фосфолипиды – основные компоненты мембран органелл. Они также регулируют динамику митохондрий, при этом их влияние различно [9].
Кардиолипин (СL) стимулирует деление митохондрий и слияние внутренних мембран.
Кардиолипин необходим для работы комплекса IV (цитрохром С оксидазы) электронтранспортной цепи. Кардиолипин находится практически исключительно во внутренней мембране митохондрий. С возрастом происходит снижение количества кардиолипина. Есть теория, что потеря функции кардиолипина связана с заменой насыщенных жирных кислот в его молекуле полиненасыщенными жирными кислотами. Для решения этого вопроса необходимо вводить в рацион насыщенные жиры, богатые, в первую очередь, стеариновой жирной кислотой.
Для повышения эффективности доставки насыщенных жирных кислот в мембрану возможно использование переносчиков. Например, – использование насыщенного фосфатидилхолина (дипальмитофосфатидилхолин и дисероилфосфатидилхолин), который, потенциально, сможет доставить насыщенные ЖК прямо в кардиолипин [10]. Холин, как переносчик, легко проходит через цитозоль и поступает в митохондрии.
Фосфатидная кислота (РА) ингибирует митохондриальное деление и стимулирует слияние внешних мембран (рис.7).

Рис.7 Регулирование слияния митохондрий фосфатидной кислотой (PA) и кардиолипином (CL) [из 9].
Во внешней мембране (ОМ) РА стимулирует митофузин-опосредованное (Mfn) слияние. Во внутренней мембране (IM) CL стимулирует Opa1-опосредованное слияние. Сокращения: ER — эндоплазматический ретикулум; MitoPLD,- митохондрия-локализованная фосфолипаза D.
3. Регуляция экспрессии митофузинов (белков, отвечающих за динамику митохондрий)
Все, о чем мы говорили выше (сalorie restriction, стеариновая кислота, фосфолипиды) действуют, влияя на экспрессию митофузинов.
Помимо этого, есть ряд препаратов, которые опосредованно могут влиять на динамику митохондрий. К ним можно отнести использование метформина.
Наиболее интересным является использование веществ, которые способны напрямую влиять на экспрессию митофузинов. Одним из потенциальных препаратов назван лефлюномид (leflunomide), который был одобрен FDA [5,11]. Он является индуктором экспрессии Mfn1 и Mfn2, а зарегистрирован был как препарат для лечения ревматоидного артрита.
Генная терапия митохондрий
Нарушение динамики митохондрий может быть связано с нарушением экспрессии белков, отвечающих за слияние и деление митохондрий. Помимо этого, нарушение функции этих белков может быть связано (и это и происходит чаще всего) с их мутациями. Тут есть два подхода к рассмотрению причинно-следственных взаимодействий нарушения функции митохондрий.
Ранее считалось, что образ жизни, в том числе переедание, приводит к образованию свободных радикалов, окислительному стрессу, мутациям митохондриального генома и, последовательно, нарушениям функциии митохондрий. Однако, в последнее время есть убедительные доказательства того, что мутации митохондриальной ДНК неизбежны, есть у всех (heteroplasmic DNA point mutations) и связаны с ошибками репликации, а не с оксидативными повреждениями, к которым митохондриальная ДНК довольно устойчива [12]. Уже на этапе оплодотворенной яйцеклетки часть наших митохондрий несут мутации. Со временем они делятся, мутантных митохондрий становится больше, они не могут нормально выполнять свою функцию.

Рис. 8 Клональное экспансия мутированных молекул мтДНК может приводить к митохондриальной дисфункции или может быть «спасено» компенсационным биогенезом [из 12].
Тут очень кстати можно было бы использовать редактирование генома митохондрий in vivo. Было показано, что для heteroplasmic DNA point mutations у мышей уже был достигнут значительный успех при помощи targeted zinc-finger nucleases (mtZFN) с доставкой при помощи аденовирусного вектора [13].
Перенос митохондрий
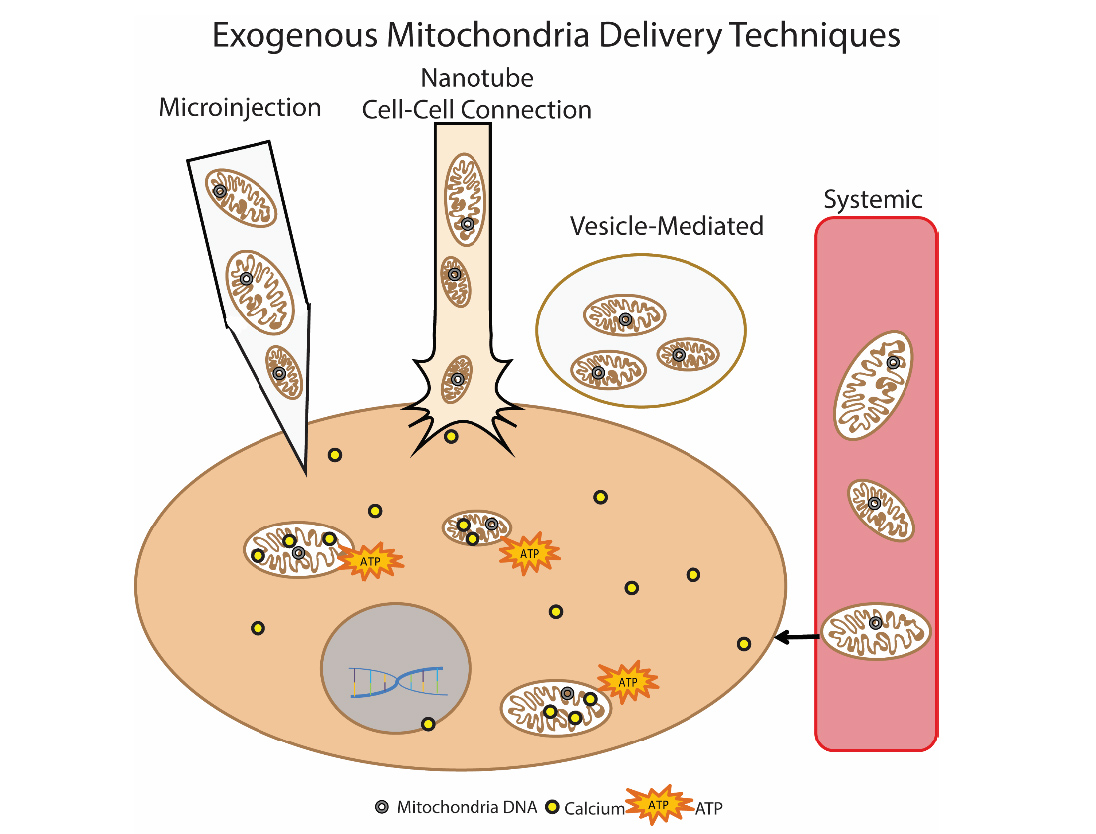
Другой многообещающий метод устранения дисфункции митохондрий – это трансплантация митохондрий. Суть этого подхода сводится к «замене» поврежденных митохондрий здоровыми экзогенными митохондриями. Впервые данный подход был использован клинически у детей с ишемией миокарда. Для трансплантации использовали аутологичные изолированные митохондрии, которые изолировали при прямой мышцы живота (делали биопсию, а затем готовили препарат), а затем вводили путем прямой инъекции [14]. Прорабатываются различные подходы введния митохондрий: прямое инъецирование изолированных митохондрий (локальное введение) и системное введение в кровоток, когда митохондрия сама «ищет» в какую клетку ей отправиться. Группы исследователей изучают возможность трансплантации митохондрий при болезни Паркинсона, ишемии печени, инсульте, митохондриальных заболеваниях [15].

Рис.9 Способы доставки экзогенных митохондрий в клетку
Автор Ольга Борисова
Источник: habr.com
Благодарности
Автор выражает благодарность студентке лечебного факультета Тверского государственного медицинского университета Виктории Исхаковой за помощь в адаптации рисунков.
Источник: biomolecula.ru