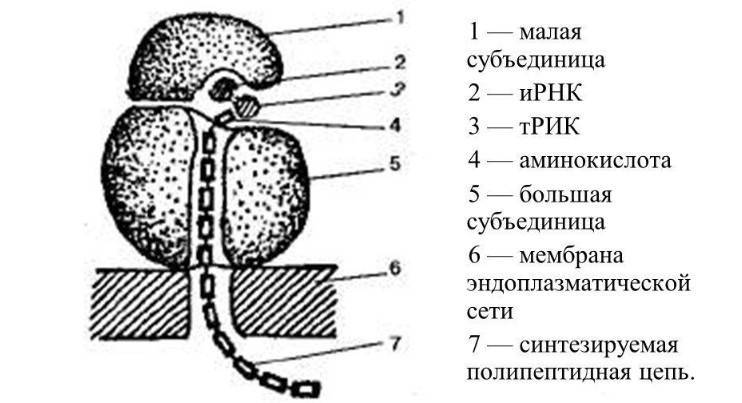
В рибосомах происходит синтез
Строение
Важнейшей органеллой клетки является ядро. Оно содержит генетическую информацию и ядрышко, где образуются рибосомы. Синтезированные рибосомы через поры ядерной мембраны попадают либо на эндоплазматическую сеть, либо в цитоплазму. В зависимости от расположения в эукариотической клетке выделяют два вида рибосом:
- связанные – располагаются на эндоплазматической сети (шероховатый вид);
- свободные – располагаются в цитозоле.
Гладкая ЭПС образуется после освобождения от рибосом. В растительных клетках гладкая ЭПС формирует провакуоли, из которых затем образуются вакуоли.

Рис. 1. Расположение рибосом в клетке.
Рибосомы – немембранные органеллы, имеющие округлую форму и состоящие из двух частей – субъединиц (большой и малой), каждая из которых представляет собой смесь рибосомальной РНК (рРНК) и белков. С химической точки зрения рибосома – нуклеопротеид, состоящий из нуклеиновых кислот и протеинов.

Рис. 2. Строение рибосом.
Различают четыре разновидности молекул РНК рибосомы:
- 18S-РНК – содержит 1900 нуклеотидов;
- 5S-РНК – содержит 120 нуклеотидов;
- 5,8S-РНК – состоит из 160 нуклеотидов;
- 28S-РНК – состоит из 4800 нуклеотидов.
Малая частица рибосомы образована 30-35 белками и 18S-РНК. В большую субчастицу входит 45-50 белков и 5S-, 5,8S-, 28S-РНК.
В нерабочем состоянии части рибосом разъединены. Они соединяются с помощью информационной (матричной) РНК, обхватывая её с двух сторон. При синтезе белка рибосомы объединяются, образуя комплексы – полисомы или полирибосомы, связанные мРНК и напоминающие бусины на нитке.
Синтез белка
Главная функция рРНК – синтез белка и аминокислот.
Биосинтез белков включает два процесса:
- транскрипцию;
- трансляцию.
Транскрипция происходит с участием ДНК. Генетическую информацию считывает фермент РНК-полимераза, образуя мРНК. Далее начинается процесс трансляции, происходящий на рибосомах.
Этот процесс разделяется на три этапа:
- инициацию – начало синтеза;
- элонгацию – биосинтез;
- терминацию – завершение синтеза, отделение рибосомы.
При инициации происходит сборка рибосомы. Контактные части субъединиц называются активными центрами, между которыми располагается:
- мРНК в качестве «шаблона» синтеза;
- тРНК, осуществляющая перенос аминокислот на синтезируемую цепь;
- синтезируемый пептид, состоящий из аминокислот.
В процессе элонгации происходит удлинение полипептидной цепи за счёт присоединения аминокислот. Цепь отсоединяется от рибосомы на стадии терминации благодаря стоп-кодону – единицы генетического кода, шифрующего прекращение синтеза белка.

Рис. 3. Общая схема синтеза белка на рибосоме.
Биосинтез требует энергетических затрат. При присоединении одной аминокислоты расходуется по две молекулы АТФ (аденозинтрифосфата) и ГТФ (гуанозинтрифосфата). Кроме того, ГТФ тратится на процессы инициации и терминации.
Источник: obrazovaka.ru
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.

Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
Выделяют 2 вида рибосом:
- Малые – находятся в прокариотических клетках, а также в хлоропластах и митохондриальном матриксе. Они не связаны с мембраной и имеют меньшие размеры (в диаметре до 15нм).
- Большие – находятся в эукариотических клетках, могут достигать в диаметре до 23нм, связываются с эндоплазматической сетью или крепятся к мембране ядра.

Строение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
Образование в клетке
Субъединицы рибосом формируются в ядрышке. Матрицей для синтеза рибосомальной РНК является ДНК. Для полного созревания они проходят несколько этапов:
- Эосома – первая фаза, при этом в ядрышке на ДНК синтезируется лишь рРНК;
- неосома – структура включающая не только рРНК, но и белки, после ряда модификаций выходит в цитоплазму;
- рибисома – зрелая органелла, состоящая из двух субъединиц.
| Функции элементов рибосом | ||
|---|---|---|
| Большая субъединица | Большая субъединица Треугольная, в диаметре 16нм, состоит из 3 молекул РНК и 33 белковых молекул Трансляция, декодирование генетической информации | Трансляция, декодирование генетической информации |
| Малая субъединица | Вогнутая, овальная, в диметре 14нм, состоит из 1 молекулы РНК и 21 белковых молекул | Объединение аминокислот, создание пептидных связей, синтез новых молекул белка |
Биосинтез белков на рибосомах
Трансляция или синтез белков на рибосомах с матрицы иРНК – конечный этап преобразования генетической информации в клетках. Во время трансляции информация, закодированная в нуклеиновых кислотах, переходит в белковые молекулы со строгой последовательностью аминокислот.
Трансляция – весьма непростой этап (в сравнении с репликацией и транскрипцией). Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции, новообразованная молекула иРНК, выходит из ядра в цитоплазму. Здесь после нескольких преобразований она соединяется с рибосомой. При этом аминокислоты приводятся в действие после взаимодействия с энергетическим субстратом – молекулой АТФ.
Аминокислоты и иРНК имеют разный химический состав и без постороннего участия не могут взаимодействовать между собой. Для преодоления этой несовместимости существует транспортная РНК. Под действием ферментов аминокислоты соединяются с тРНК. В таком виде они переносятся на рибосому и тРНК, с определенной аминокислотой, прикрепляется на иРНК в предназначенном месте. Далее рибосомальные ферменты формируют пептидную связь между присоединенной аминокислотой и строящимся полипептидом. После рибосома перемещается по цепи информационной РНК, оставляя участок для прикрепления следующей аминокислоты.
Рост полипептида идет до того момента, пока рибосома не встретит «стоп-кодон», который сигнализирует об окончании синтеза. Для освобождения новосинтезированного пептида от рибосомы включаются факторы терминации, окончательно завершающие биосинтез. К последней аминокислоте прикрепляется молекула воды, а рибосома распадается на две субъединицы.
Когда рибосома продвигается дальше по иРНК, она освобождает начальный отрезок цепи. К нему снова может присоединиться рибосома, которая начнет новый синтез. Таким образом, используя одну матрицу для биосинтеза, рибосомы создают одномоментно множество копий белка.
Роль рибосом в организме
- Рибосомы синтезируют белок для собственных нужд клетки и за ее пределы. Так в печени образуются плазменные факторы свертывания крови, плазмоциты продуцируют гамма-глобулины.
- Считывание закодированной информации с РНК, соединение аминокислот в запрограммированном порядке с образованием новых белковых молекул.
- Каталитическая функция – формирование пептидных связей, гидролиз ГТФ.
- Свои функции в клетке рибосомы выполняют более активно в виде полирибосом. Эти комплексы способны одновременно синтезировать несколько молекул белка.
Источник: animals-world.ru
Состав рибосомы[править | править код]
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК[править | править код]
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы[править | править код]
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы[править | править код]
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки[править | править код]
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты[править | править код]
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции[править | править код]
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы[править | править код]
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Литература[править | править код]
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Источник: ru.wikipedia.org
Строение рибосом
Рибосомы относятся к немембранным органоидам. Они очень мелкие (около 20 нм), но многочисленные (тысячи и даже миллионы на клетку), состоят из двух частей – субъединиц. В состав субчастиц входят рибосомальные РНК (рРНК) и рибосомные белки, т. е. рибосомы по химическому составу являются рибонуклеопротеидами. Однако в них также присутствует небольшое количество низкомолекулярных соединений. Из-за многочисленности рибосом, рРНК составляет более половины от всей РНК клетки.
Одну из субъединиц называют «малой», вторую – «большой».
В собранной из субъединиц рибосоме выделят два (по одним источникам) или три (по другим) участка, которые называют сайтами. Один из участков обозначают A (aminoacyl) и называют аминоацильным, второй — P (peptidyl) — пептидильный. Данные сайты являются основными каталитическими центрами протекающих на рибосомах реакций. Третий участок обозначают E (exit), через него освободившаяся от синтезируемого полипептида транспортная РНК (тРНК), покидает рибосому.
Кроме перечисленных сайтов на рибосомах есть другие участки, используемые для связывания различных ферментов.
Когда субъединицы диссоциированы (разъединены) специфичность сайтов теряется, т. е. они определяются сочетанием соответствующих областей обеих субъединиц.
Отличие рибосом прокариот и эукариот
Соотношение по массе белков и РНК в рибосоме примерно поровну. Однако у прокариот белков меньше (около 40%).
Размеры как самих рибосом, так и субъединиц выражают в скорости их седиментации (осаждения) при центрифугировании. При этом S обозначает константу Сведберга — единицу, характеризующую скорость оседания в центрифуге (чем больше S, тем быстрее частица осаждается, а значит тяжелее). У прокариот рибосомы имеют размер в 70S, а у эукариот — в 80S (т. е. они тяжелее и крупнее). При этом субъединицы прокариотических рибосом имеют значения 30S и 50S, а эукариотических — 40S и 60S. Размеры рибосом в митохондриях и хлоропластах эукариот сходны с прокариотическими (хотя имеют определенную вариабельность по размерам), что может указывать на их происхождение от древних прокариотических организмов.
У прокариот в состав большой субъединицы рибосом входит две молекулы рРНК и более 30 молекул белка, в состав малой — одна молекула рРНК и около 20 белков. У эукариот в субъединицах больше молекул белка, а также в большой субъединице три молекулы рРНК. Составляющие рибосому белки и молекулы рРНК обладают способностью к самосборке и в итоге образуют сложную трехмерную структуру. Структуру рРНК поддерживают ионы магния.
Синтез рРНК
У эукариот в состав рибосом входят 4 вида рРНК. При этом три образуются из одного транскрипта-предшественника — 45S рРНК. Он синтезируется в ядрышке (на петлях хромосом его формирующем) при помощи РНК-полимеразы-1. Гены рРНК имеют много копий (десятки и сотни) и обычно располагаются на концах разных пар хромосом. После синтеза 45S рРНК разрезается на 18S, 5.8S и 28S рРНК, каждая из которых подвергается тем или иным модификациям.
Четвертый вид рРНК синтезируется вне ядрышка с помощью фермента РНК-полимеразы-3. Это 5S РНК, которая после синтеза не нуждается в процессинге.
Третичная структура рРНК в составе рибосом очень сложная и компактная. Она служит каркасом для размещения рибосомных белков, которые выполняют вспомогательные функции для поддержания структуры и функциональности.
Функция рибосом
Функционально рибосомы являются местом связывания молекул, участвующих в синтезе (мРНК, тРНК, различные факторы). Именно в рибосоме молекулы могут занять друг по отношению к другу такое положение, которое позволит быстро протечь химической реакции реакции.
В эукариотических клетках рибосомы могут находиться свободно в цитоплазме или быть прикрепленными с помощью специальных белков к ЭПС (эндоплазматическая сеть, она же ЭР — эндоплазматический ретикулум).
В процессе трансляции рибосома перемещается по мРНК. Часто по одной нитевидной мРНК двигаются несколько (или множество) рибосом, образуя так называемую полисому (полирибосому).
Источник: biology.su
Рибосома — это маленькая электронно-плотная частица, образованная связанными между собой молекулами рРНК и белками, которые формируют сложное надмолекулярное соединение — рибонуклеопротеидный комплекс.
В рибосомах белки и молекулы рРНК находятся примерно в равных весовых отношениях. В состав цитоплазматических рибосом эукариот входят четыре молекулы рРНК, различающиеся по молекулярной массе. Количество органелл в клетке весьма разнообразно: тысячи и десятки тысяч. Рибосомы могут быть связаны с ЭПС или находиться в свободном состоянии.
Рибосома представляет собой сложное органическое соединение, формирующее компактную органеллу, способную считывать информацию с цепей иРНК и, используя ее, синтезировать полипептидные цепочки.
Рибосома расшифровывает информационный код, содержащийся в иРНК, который составлен четырьмя видами нуклеотидов. Три нуклеотида, располагаясь в различных последовательностях, несут информацию о двадцати аминокислотах. Рибосома, по сути дела, исполняет роль переводчика этой информации. Эта задача разрешается с помощью тРНК и ферментов, синтезирующих полипептидные цепочки. Такие ферменты называются аминоацил-тРНК-синтетазами. Число аминоацил-тРНК-синтетаз определяется разнообразием аминокислот, так как каждой аминокислоте соответствует свой фермент. Таким образом, в каждой рибосоме не менее 20 видов таких ферментов.
Рибосома состоит из большой и малой субъединиц. Каждая из субъединиц построена из рибонуклеопротеидного тяжа, где рРНК взаимодействует со специальными белками и образует тело рибосомы. Рибосомы образуются в ядрышке или матриксе митохондрий. Синтез полипептидных цепочек, осуществляемый рибосомами, называется трансляцией рРНК — это основа для формирования рибосом. Малая субъединица рибосомы образована одной молекулой рРНК и примерно 30 белками. В большую субъединицу встроена одна длинная рРНК и две коротких. С ними связаны 45 молекул белков.
тРНК — это небольшие молекулы, состоящие из 70…90 нуклеотидов, которые имеют форму листа клевера. тРНК доставляет аминокислоты к рибосомам. Каждая молекула тРНК имеет акцепторный конец, к которому присоединяется активированная аминокислота. Аминокислоты прикрепляются к последовательности трех нуклеотидов, комплементарных (соответствующих) нуклеотидам кодона в иPHК — антикодону.
Различают цитоплазматические (свободные и связанные) и митохондриальные рибосомы. Цитоплазматические и митохондриальные рибосомы значительно отличаются друг от друга по химическому составу, размерам и происхождению.
При электронной микроскопии обнаруживают как единичные рибосомы, так и их комплексы (полисомы). Вне синтеза субъединицы рибосом располагаются отдельно друг от друга. Субъединицы объединяются в момент трансляции информации с иРНК. При этом трансляция информации с одной молекулы иРНК осуществляют несколько рибосом (от 5…6 до нескольких десятков). Такие рибосомы чаще всего формируют так называемые полисомы — рыхлый конгломерат рибосом, располагающийся цепочкой по ходу иРНК. Это позволяет синтезировать с одной молекулы иРНК сразу несколько полипептидных цепочек.
Вне трансляции субъединицы рибосом могут распадаться и вновь объединяться. Этот процесс находится в динамическом равновесии. Процесс трансляции запускается со сборки активной рибосомы и обозначается как инициация трансляции. В собранной рибосоме имеются активные центры. Такие центры располагаются на контактирующих поверхностях обеих субъединиц. Между малой и большой субъединицами располагается серия углублений. В этих полостях находятся: иРНК, тРНК и синтезируемый пептид (пептидил-тРНК). Зоны, связанные с синтетическими процессами, формируют следующие активные центры:
- центр связывания иРНК (М-центр);
- пептидильный центр (П-центр), на котором происходит инициация и окончание считывания информации, а в процессе синтеза полипептида на нем находится полипептидная цепочка;
- аминокислотный центр (A-центр), место связывания с очередной тРНК;
- пептидилтрансферазный центр (ПТФ-центр). Здесь происходит катализ синтеза полипептида и синтезируемая молекула удлиняется на еще одну аминокислоту.
На малой субъединице расположен М-центр, основная часть A-центра и небольшой участок П-центра. На большой субъединице можно найти остальные части А- и П-центров, а также ПТФ-центр.
Трансляция начинается со стартового кодона — триплета аденин-урацил-гуанин, расположенного в 5′-конце иРНК. Он присоединяется к малой субъединице на уровне П-центра будущей рибосомы. Затем происходит объединение комплекса с большой субъединицей. Этот процесс активируют или, наоборот, блокируют белковые факторы. С момента формирования рибосома прерывисто, триплет за триплетом движется вдоль молекулы и РНК, что сопровождается ростом полипептидной цепочки. Число аминокислот в таком белке равно числу триплетов иРНК.
Процесс трансляции предполагает цикл близких событий и называется элонгацией — удлинение пептидной цепочки. Сигналом для прекращения трансляции служит появление в иРНК одного из «бессмысленных» кодонов (УАА, УАГ, УГА). Эти кодоны узнает один из двух факторов терминации. Они активируют гидролазную активность пептидилтрансферазного центра, что сопровождается отщеплением образованного полипептида, распадом рибосомы на субъединицы и прекращением синтеза.
Свободные рибосомы распределены в матриксе цитоплазмы. Они находятся либо в виде субъединиц и не участвуют в трансляции, либо «считывают» информацию, образуя полипептидные цепочки белков матрикса цитоплазмы и ядра, цитоскелета клетки и т. д.
Связанные рибосомы — это такие рибосомы, которые прикреплены к мембранам гр. ЭПС или к наружной мембране ядерной оболочки. Происходит это только в момент синтеза полипептидных цепочек белков, формирующих секреторные гранулы цитолеммы, лизосом, ЭПС, комплекса Гольджи и др.
Синтез белковых молекул происходит непрерывно и идет с большой скоростью: в одну минуту образуются от 50 до 60 тыс. пептидных связей. За одну секунду рибосома эукариот считывает информацию с 2…15 кодонов (триплетов) иРНК. Синтез одной молекулы крупного белка (глобулина) длится около 2 мин. У бактерий этот процесс идет гораздо быстрее.
Таким образом, рибосомы — это органеллы, обеспечивающие анаболические процессы в клетке, а именно синтез полипептидных цепочек белков.
В слабо специализированных и быстро растущих клетках в основном обнаруживают свободные рибосомы. В специализированных клетках рибосомы располагаются в составе гр. ЭПС. Содержание РНК и соответственно степень белковых синтезов соотносится с количеством рибосом. Это сопровождается склонностью к базофилии цитоплазмы, то есть способностью окрашиваться основными красителями.
В клетках некоторых типов цитоплазма более базофильна, чем в других. Базофилия может быть диффузной или локальной. С помощью электронной микроскопии установлено, что локальная базофилия создается гр. ЭПС, а именно прикрепленными к ее мембранам рибосомами. Примерами подобной, фокусной базофилии служат: цитоплазма нейрона, базальный полюс железистого эпителия концевых отделов экзокринной части поджелудочной железы, белковопродутдирующие клетки слюнных желез. Диффузная базофилия обусловлена свободными рибосомами. Базофилию выявляют и в случае накопления в цитоплазме включений или большого количества лизосом, имеющих кислое содержимое. В этих случаях видна базофильно окрашенная зернистость.
Источник: www.activestudy.info