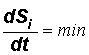
Термодинамика живых систем
|
 1. Термодинамика живых систем Состояние живых систем в любой момент времени (динамическое состояние) характерно тем, что элементы системы постоянно разрушаются и строятся заново. Этот процесс носит название биологического обновления. Для обновления элементов в живых системах требуется постоянный приток извне веществ и энергии, а также вывод во внешнюю среду тепла и продуктов распада. Это означает, что живые системы обязательно должны быть открытыми системами. Благодаря этому в них создается и поддерживается химическое и физическое неравновесие. Именно на этом неравновесии основана работоспособность живой системы, направленная на поддержание высокой упорядоченности своей структуры (а. значит, на сохранение жизни) и осуществление различных жизненных функций. Кроме того, живая система, благодаря свойству открытости, достигает стационарности, т.е. постоянства своего неравновесного состояния. I закон (начало) термодинамики. Первый закон термодинамики гласит: изменение энергии системы равно количеству тепла, полученному системой, плюс работа внешних сил, совершенная над системой DE = Q + А II закон (начало) термодинамики. Второй закон термодинамики утверждает, что в изолированной термодинамической системе энтропия никогда не может уменьшаться. Она равна нулю при обратимых процессах и может только увеличиваться при необратимых процессах. Переход системы из неравновесного состояния в равновесное необратим. Для организмов — гетеротрофов (питающихся только органической пищей) — энергия в виде химических связей и низкая энтропия поглощаемых высокоструктурированных органических веществ. В этом случае поглощаемые пищевые вещества обладают больше упорядоченностью (меньшей энтропией), чем выделяемые продукты обмена. Организмы гетеротрофы переносят упорядоченность (негэнтропию) из питательных веществ в самих себя. Для организмов — автотрофов (самостоятельно синтезирующих для себя питательные вещества из неорганических соединений с участием солнечного излучения) — энергия солнечного света, представляющего электромагнитное излучение с низкой энтропией. Таким образом, обмен веществ с точки зрения термодинамики необходим для противодействия увеличению энтропии, обусловленному необратимыми процессами в живой системе. 2.Управление и регулирование в живых системах 2.1 Чадами управления и регулирования Управление и регулирование — близкие понятия, однако, между ними есть определенная разница. Управление — функция организованных систем, обеспечивающая выполнение следующих задач: сохранение определенной структуры системы; поддержание режима деятельности системы; Эти задачи решаются с помощью регулирования. Регулирование — функция управляющих систем, обеспечивающая выполнение таких задач, как: поддержание постоянства регулируемой величины на некотором определенном уровне; изменение регулируемой величины по заданному закону (программное регулирование); изменение регулируемой величины в соответствии с ходом некоторого внешнего процесса (следящее регулирование). Гомеостазис. В целом регулирование направлено на поддержание гомеостазиса —относительно динамического постоянства характеристик внутренней среды организма. Уровни управления. В организме существует несколько уровней управления. Внутриклеточный механизм регуляции осуществляет биохимическую регуляцию в соответствии с генетической информацией, которая содержится на молекулярном уровне. Механизм тканевой регуляции — более высокий уровень регуляции, чем клеточный. Ткани взаимодействуют в рамках организма путем обмена определенными химическими веществами. Регулирует это взаимодействие еще один, более высокий уровень — железы внутренней секреции. Они вырабатывают гормоны, циркулирующие в крови, которые управляют организмом как целым. Высший уровень регуляции — центральная нервная система, которая присутствует у всех много клеточных организмов. Она воздействует на все другие уровни регуляции. Управление организмом имеет многоуровневый «иерархический» характер. На каждом уровне управление направлено на решение задач, присущих этому уровню. Главная же цель, общая для живой системы в целом ставится и решается на высшем уровне управления. Цели и задачи нижележащих уровней носят вспомогательную роль по отношению к общей цели. 2.2 Информационные связи внутри организма Гормональная связь. Гормон, то есть химический сигнал, по кровотоку посылает во все части организма, но только в определенные органы, способные принять данный сигнал, реагируют на него как приемники. Нервные связи (только у многоклеточных организмов). Информационным параметром нервных связей служит частота следования импульсов. Частота импульсов увеличивается при росте интенсивности стимула. Генетическая связь. Источником сообщения в этом случае является молекула дезоксирибонуклеиновой кислоты (ДНК). Функционирование этой связи будет рассмотрено позже. Таким образом, процесс управления в информационном смысле носит антиэнтропийный характер: получая информацию об окружающей среде, живая система уменьшает информационную энтропию внутри себя, использует получаемую информацию для поддержания своей организованности. 2.3 Цели и специфика управления в живых системах Цели управления в живых системах чрезвычайно разнообразны. В любой системе цель управления в общем виде заключается в достижении системой множества полезных для нее свойств при разнообразных внешних воздействиях. Биологической системой, которой присущи все свойства живого и все задачи управления, является организм, в том числе одноклеточный. Клетка, хотя и самоуправляемая, не является автономной системой, так как регуляция в клетке подчинена организму. Обратные связи. Важной стороной управления в живых системах является наличие обратных связей. Принцип обратных связей является одним из основных принципов самоуправления, саморегуляции и самоорганизации. Без наличия обратных связей процесс самоуправления невозможен. С помощью обратных связей сами отклонения объекта от заданного состояния формируют управляющие воздействия, которые приводят состояние объекта в заданное. Иными словами, обратная связь — это обратное воздействие результатов процесса на его протекание .Обратная связь может быть положительной и отрицательной. Положительная обратная связь — такая обратная связь, когда результаты процесса усиливают его. Если же результаты процесса ослабляют его действие, говорят об отрицательной обратной связи. Иерархия целей управления в живых системах. Рассмотрим наиболее общую цель всех живых систем — сохранение и продолжение жизни. Здесь цель достигается в следующем порядке: Цель I порядка — обеспечить существование систем (достигается поддержанием стационарного неравновесного состояния при котором прирост энтропии будет минимальным. Цель II порядка — обеспечить высокое качество существования системы — поддержание Гомеостазиса. Гомеостазис — необходимое условие высокого качества функционирования системы. Цель III порядка — достижение максимально высоких показателей существования системы (максимальная энергетическая эффективность и надежность). Контрольные вопросы 1. В чем заключается особенность применения II начала термодинамики к живым системам? 2. Что означает переход живой системы в равновесное состояние? 3. В чем суть теоремы Пригожина для открытых термодинамических систем при неизменных условиях? 4. Что извлекает организм из окружающей среды для того, чтобы энтропия системы не возрастала? 5. В чем состоит задача управления в живой системе? 6. Каким путем живая система решает задачу управления? 7. Какие функции организованных систем обеспечивает управление? 8. Какие функции организованных систем обеспечивает регулирование? 9. Дайте определение гомеостаза. то такое обратная связь? Поясните понятие положительной и отрицательной обратной связи. 10. Объясните иерархию целей управления в живых системах. |
Похожие:
 |
Клетка является единой структурно-функциональной единицей всех обитателей Земли |
 |
Цель работы: Исследовать воздействие тяжелых металлов на состояние живых систем и здоровье |
 |
… |
 |
|
 |
 |
… |
|
 |
«погода», «климат»; влияние климата, погоды на состояние живых организмов, здоровье людей |
 |
|
 |
Под качеством природной среды понимают такое состояние ее экологических систем, при котором постоянно обеспечиваются обменные процессы… |
 |
Режимы работы и правила эксплуатации электрического и электромеханического оборудования |
Разместите кнопку на своём сайте:
Источник: rpp.nashaucheba.ru
1. Термодинамика живых систем
Состояние живых систем в любой момент времени (динамическое состояние) характерно тем, что элементы системы постоянно разрушаются и строятся заново. Этот процесс носит название биологического обновления. Для обновления элементов в живых системах требуется постоянный приток извне веществ и энергии, а также вывод во внешнюю среду тепла и продуктов распада. Это означает, что живые системы обязательно должны быть открытыми системами. Благодаря этому в них создается и поддерживается химическое и физическое неравновесие. Именно на этом неравновесии основана работоспособность живой системы, направленная на поддержание высокой упорядоченности своей структуры (а. значит, на сохранение жизни) и осуществление различных жизненных функций. Кроме того, живая система, благодаря свойствуоткрытости, достигаетстационарности, т.е. постоянства своего неравновесного состояния.
В изолированной системе (такая система не обменивается с внешней средой веществом и энергией), находящейся в неравновесном состоянии происходят необратимые процессы, которые стремятся привести систему в равновесное состояние. Переход живо системы в такое состояние означает для нее смерть.
Таким образом, открытость – одно из важнейших свойств живых систем.
Весьма важным является вопрос о применимости законов термодинамики к живым системам.
К началу документа
I закон (начало) термодинамики.Первый закон термодинамики гласит: изменение энергии системы равно количеству тепла, полученному системой, плюс работа внешних сил, совершенная над системой
DE = Q + A
Для адиабатически изолированных (Q = 0, то есть обмена теплом с внешней средой не происходит) и замкнутых (А = 0, то есть внешние силы отсутствуют) систем DE = 0. Последнее утверждение является законом сохранения энергии: при всех изменениях, происходящих в адиабатически изолированных и замкнутых системах полная энергия системы остается постоянной.
Если рассматривать термодинамическую систему, состоящую только из живой системы, то закон сохранения энергии неприменим, так как живая система является открытой. Для термодинамической системы, включающей в себя живую систему и среду, с которой система обменивается энергией и веществом, закон сохранения энергии выполняется. Действительно, как показали опыты, общее количество энергии, которое получает организм за некоторый промежуток времени, вновь обнаруживается впоследствии в виде:
а) выделяемого тепла; б) в совершаемой внешней работе или выделяемых веществах; в) в виде теплоты сгорания веществ, синтезированных за этот промежуток времени за счет энергии, поступившей извне.
II закон (начало) термодинамики. Второй закон термодинамики утверждает, что в изолированной термодинамической системе энтропия никогда не может уменьшаться. Она равна нулю при обратимых процессах и может только увеличиваться при необратимых процессах, то естьDS ³ 0. Переход системы из неравновесного состояния в равновесное необратим, поэтому такжеDS ³ 0.
Здесь есть также определенная связь с упорядоченностью системы, а также с информацией (большая упорядоченность соответствует большему количеству информации). Можно говорить при этом о единстве природы информации и энтропии. Действительно, увеличение энтропии соответствует переходу системы из более упорядоченного в менее упорядоченное состояние. Такой переход сопровождается уменьшением информации, содержащейся в структуре системы. Беспорядок, неопределенность можно трактовать как недостаток информации. В свою очередь возрастание количества информации уменьшает неопределенность.
Вспомним физический смысл энтропии. Все процессы, самопроизвольно протекающие в природе, необратимы и способствуют переходу системы в равновесное состояние, которое всегда характеризуется тем, что:
а) в процессе этого перехода всегда безвозвратно выделяется некоторая энергия и для совершения полезной работы она использована быть не может; б) равновесном состоянии элементы системы характеризуются наименьшей упорядоченностью.
Отсюда следует, что энтропия является как мерой рассеяния энергии, так и, что сейчас для нас главное, мерой неупорядоченности системы.
Применение второго закона термодинамики к живым системам без учета того, что это открытые системы, приводит к противоречию. Действительно, энтропия должна всегда возрастать, то есть должна расти неупорядоченность живой системы. В то же время мы хорошо знаем, что все живые системы постоянно создают из беспорядка упорядоченность. В них создается и поддерживается физическое и химическое неравновесие, на котором основана работоспособность живых систем. В процессе развития каждого организма (ортогенеза), так же как и в процессе эволюционного развития (филогенеза) все время образуются новые структуры, и достигается состояние с более высокой упорядоченностью. А это означает, что энтропия (неупорядоченность) живой системы не должна возрастать. Таким образом, второй закон термодинамики, справедливый для изолированных систем, для живых систем, являющихся открытыми, неприменим.
Для открытых термодинамических систем изменение энтропии состоит из суммы DS = DSi + DSе гдеDSi – изменение энтропии в ходе процессов, происходящих в самой живой системе,DSe– изменение энтропии при обмене веществом и энергией с окружающей средой.
Согласно второму закону термодинамики величина DSi может быть только положительной или в предельном случае (обратимые процессы) равна нулю. ВеличинаdSe может быть положительной (DSe> 0, система получает энтропию) и отрицательной (DSe< 0, система отдает энтропию). При этом суммарное изменение энтропии может быть и отрицательным. ПриDSe< 0 и| DSe| > |DSi | :
DS = DSi + DSe < 0,
что означает увеличение упорядоченности в случае, когда систему покидает больше энтропии, чем возникает внутри ее в ходе необратимых процессов.
Рассмотрим производную энтропии по времени ![]() , которую называют скоростью изменения или производством энтропии. Из выражения дляDSследует, что производство энтропии открытой системы:
, которую называют скоростью изменения или производством энтропии. Из выражения дляDSследует, что производство энтропии открытой системы:
![]()
Для стационарного состояния, когда неравновесность во времени не изменяется, производство энтропии должно быть равно нулю(производная от постоянной величины):
![]()
Это означает, что
![]() ,
,
т.е. энтропия, возникающая в ходе процессов, происходящих внутри системы (dSi), должна полностью переходить во внешнюю среду.
К началу документа
Теорема Пригожина.Согласно теореме Пригожина, если открытую термодинамическую систему при неизменных во времени условиях предоставить самой себе, то прирост энтропии ![]() будет уменьшаться до тех пор, пока система не достигнет стационарного состояния динамического равновесия; в этом состоянии прирост энтропии будет минимальным, то есть
будет уменьшаться до тех пор, пока система не достигнет стационарного состояния динамического равновесия; в этом состоянии прирост энтропии будет минимальным, то есть .
.
Таким образом, мы можем сказать, что для открытой системы в стационарном состоянии производство энтропии минимально.
Для живых систем это означает следующее:
В течение времени жизни живой системы ее элементы постоянно подвергаются распаду. Энтропия этих процессов положительна (возникает неупорядоченность).
Для компенсации распада (компенсации неупорядоченности) должна совершаться внутренняя работа в форме процессов синтеза элементов взамен распавшихся. А это означает, что эта внутренняя работа является процессом с отрицательной энтропией (такие процессы называют негэнтропийными, а отрицательную энтропию –негэнтропией).
Негэйнтропийный процесс противодействует увеличению энтропии системы, которое связано с процессом распада и создает упорядоченность.
Источником энергии для совершения негэнтропийной внутренней работы являются:
Для организмов — гетеротрофов(питающихся только органической пищей) – энергия в виде химических связей и низкая энтропия поглощаемых высокоструктурированных органических веществ. В этом случае поглощаемые пищевые вещества обладают больше упорядоченностью (меньшей энтропией), чем выделяемые продукты обмена. Организмы гетеротрофы переносят упорядоченность (негэнтропию) из питательных веществ в самих себя.
Для организмов — автотрофов(самостоятельно синтезирующих для себя питательные вещества из неорганических соединений с участием солнечного излучения) – энергия солнечного света, представляющего электромагнитное излучение с низкой энтропией.
Таким образом, обмен веществ с точки зрения термодинамики необходим для противодействия увеличению энтропии, обусловленному необратимыми процессами в живой системе.
Если рассматривать систему «живой организм плюс среда», из которой берутся питательные вещества и в которую отдаются продукты обмена, то второй закон термодинамики справедлив: энтропия этой системы возрастает и никогда не уменьшается. Это означает, что живая система создает внутри себя упорядоченность за счет того, что она уменьшает упорядоченность в окружающей среде.
Итак, живая система является открытой системой, и ее энтропия не возрастает, как это имеет место в изолированной системе. Это означает, что живая система постоянно совершает работу, направленную на поддержание своей упорядоченности, и находится в неравновесном стационарном состоянии. Производство энтропии при этом (как следует из теоремы Пригожина) минимально.
Таким образом, с позиций термодинамики можно утверждать, что живым системам присущи процессы, уменьшающие энтропию систем и, следовательно, поддерживающие их организованность.
Следующий вопрос заключается в том, как реализуются процессы самоуправления и самоорганизации живых систем. Вопрос этот прежде всего связан с рассмотрением жизни как информационного процесса. Недаром кибернетика определена ее создателем Н. Винером как «наука об управлении и передачи информации в живых организмах и машинах».
Прежде всего, рассмотрим две важнейшие функции организованных и управляющих систем – управление и регулирование.
К началу документа
Источник: StudFiles.net
Все сказанное указывает на важную роль энтропии в биосистемах. Однако нужно отметить, что эта термодинамическая функция имеет несколько смысловых значений и не все они в равной мере приложимы к живым организмам. Рассмотрим их последовательно. Энтропия как мера рассеяния энергии при необратимых процессах. В этом аспекте данная функция полностью приложима к биосистемам. Чем больше возрастание энтропии при каком-либо процессе, тем больше рассеяние энергии и тем более необратим данный процесс. Энтропия как мера возможности процесса. В этом качестве энтропия выполняет важную роль, и приговор ее непререкаем. Самопроизвольно могут протекать только такие процессы, при которых эта функция или увеличивается (необратимые), или остается постоянной (обратимые). Процессы, при которых энтропия уменьшается, самопроизвольно протекать не могут, то есть термодинамически невозможны. Эта роль энтропии полностью приложима и к биологическим системам. Термодинамический энтропийный критерий и здесь однозначно определяет возможность протекания того или иного процесса. В этой связи утверждение, которое иногда приходится слышать, что ферменты делают возможными реакции, которые в данных условиях при их отсутствии невозможны, следует признать неверным. Ферменты лишь ускоряют во много раз те реакции, которые и без их участия могут протекать, но с очень низкой скоростью. Однако, говоря о роли энтропии как меры возможности процесса, необходимо отметить, что "мудрость живых систем" проявляется и здесь. Энергетический обмен у них организован таким образом, что они могут обходить энтропийный термодинамический критерий и в них протекают не только возможные, но и невозможные с термодинамической точки зрения реакции. Это все реакции, при которых энтропия уменьшается, а свободная энергия увеличивается, — биосинтез различных веществ, работа систем активного транспорта и т.д. Каким образом это удается делать биологическим объектам? Это оказывается возможным благодаря механизму так называемого энергетического сопряжения. Суть этого сопряжения состоит в том, что возможная с точки зрения энтропийного критерия реакция сопрягается с реакцией термодинамически невозможной и дает для нее энергию (рис. 3). Два условия необходимы для осуществления энергетического сопряжения: 1) свободная энергия, даваемая термодинамически возможной реакцией, должна превышать энергию, потребляемую реакцией термодинамически невозможной, то есть должен быть некоторый избыток энергии с учетом вероятных потерь при ее передаче; 2) обе сопрягаемые реакции должны иметь общий компонент. Такими компонентами в биологических системах могут быть фосфат, электрохимический градиент протона и др. Энергетическое сопряжение в биосистемах — это выдающееся изобретение природы. Оно осуществляется обычно при участии структурных элементов клетки. Наиболее ярким примером такого сопряжения являются процессы окислительного и фотосинтетического фосфорилирования, протекающие при участии соответственно сопрягающих митохондриальных и фотосинтетических мембран. Как известно, в ходе этих процессов за счет энергии переноса электронов по дыхательной или фотосинтетической цепи осуществляется синтез богатых энергией молекул АТФ (фосфорилирование АДФ), используемых для совершения самой разнообразной работы. Энтропия как мера упорядоченности системы. Мы уже говорили, что энтропия отражает ту часть энергии системы, которая деградировала, то есть равномерно рассеялась в виде тепла. Таким образом, чем меньше порядка в системе, то есть чем меньше градиенты энергии, тем больше ее энтропия. Особенно четко связь энтропии с упорядоченностью системы проявляется в формуле Планка-Больцмана, которая связывает энтропию с термодинамической вероятностью: S = k ln W, где S — энтропия, k — постоянная Больцмана, равная 1,38 " 10- 23 Дж " К-1, или 3,31 " 10- 24 энтропийных единиц (1 энтропийная единица равна 1 кал " град-1), и W — термодинамическая вероятность, то есть число способов, которыми достигается данное состояние. Она всегда больше единицы. В общем виде она равна: где (если речь идет о молекулах) N — общее число молекул, Ni — число молекул в i-м фазовом объеме. Допустим, у нас есть система, состоящая из трех отсеков. В системе находятся девять молекул. Полный беспорядок в такой системе будет тогда, когда молекулы распределены равномерно, то есть в каждом отсеке будет по три молекулы (рис. 4). Термодинамическая вероятность такой системы равна: Полный порядок в системе наблюдается при нахождении всех девяти молекул в одном из трех отсеков (рис. 4). Термодинамическая вероятность такой системы будет Таким образом, чем больше упорядоченность в данной системе, тем меньше ее термодинамическая вероятность, и, следовательно, тем меньше энтропия (см. формулу Планка-Больцмана). В какой мере энтропия как мера упорядоченности приложима к биосистемам. Ответ на этот вопрос в определенной степени дают расчеты Л.А. Блюменфельда [3], который вычислил, насколько меняется энтропия при образовании организма человека из элементов, его составляющих (мономеров, полимеров, клеток). Оказалось, что упорядоченность человеческого организма можно оценить приблизительно в 300 энтропийных единиц. Много это или мало? Чтобы ответить на этот вопрос, достаточно сказать, что настолько меняется энтропия стакана воды при ее испарении. С чем связан такой парадокс? Дело в том, что энтропия оценивает только физическую, энергетическую сторону упорядоченности. Она совершенно не затрагивает качественной ее стороны. Уникальность биологической структуры состоит не в том, сколько энергии в ней содержится и насколько изменилась энтропия при ее образовании, а в том, что эта структура имеет качественные особенности, позволяющие ей выполнять вполне определенные биологические функции. Увы, энтропию это вовсе не интересует. Таким образом, использование энтропии как меры упорядоченности в применении к биосистемам лишено смысла. ЗАКЛЮЧЕНИЕ У М.В. Волькенштейна в его книге "Энтропия и информация" [2] есть такие строки: Энергия — миров царица, Но черная за нею тень Непререкаемо влачится, Уравнивая ночь и день, Всему уничтожая цену, Все превращая в дымный мрак_ Ведь энтропия неизменно Изображалась только так. Но ныне понято, что тени Не будет, не было и нет, Что в смене звездных поколений Лишь энтропия — жизнь и свет. Мы не хотим включаться в спор о том, что важнее — энергия или энтропия. Будем считать свою задачу выполненной, если у читателя сложится представление о важности такой интересной термодинамической функции, как энтропия, и той роли, которую она играет в биосистемах.
Термодинамика живых систем Состояние живых систем в любой момент времени (динамическое состояние) характерно тем, что элементы системы постоянно разрушаются и строятся заново. Этот процесс носит название биологического обновления. Для обновления элементов в живых системах требуется постоянный приток извне веществ и энергии, а также вывод во внешнюю среду тепла и продуктов распада. Это означает, что живые системы обязательно должны быть открытыми системами. Благодаря этому в них создается и поддерживается химическое и физическое неравновесие. Именно на этом неравновесии основана работоспособность живой системы, направленная на поддержание высокой упорядоченности своей структуры, а, значит, на сохранение жизни и осуществление различных жизненных функций. Кроме того, живая система, благодаря свойству открытости, достигает стационарности, т.е. постоянства своего неравновесного состояния. В изолированной системе (такая система не обменивается с внешней средой веществом и энергией), находящейся в неравновесном состоянии, происходят необратимые процессы, которые стремятся привести систему в равновесное состояние. Переход живой системы в такое состояние означает для нее смерть. Таким образом, открытость – одно из важнейших свойств живых систем. Весьма важным является вопрос о применимости законов термодинамики к живым системам. I закон (начало) термодинамики. Первый закон термодинамики гласит: изменение энергии системы (dE) равно количеству тепла (Q), полученному системой, плюс работа внешних сил (A), совершенная над системой dE = Q + A Для адиабатически изолированных систем (Q = 0, то есть обмена теплом с внешней средой не происходит) и замкнутых (А = 0, то есть внешние силы отсутствуют) dE = 0. Последнее утверждение является законом сохранения энергии: при всех изменениях, происходящих в адиабатически изолированных и замкнутых системах, полная энергия системы остается постоянной. Если рассматривать термодинамическую систему, состоящую только из живой системы, то закон сохранения энергии неприменим, так как живая система является открытой. Для термодинамической системы, включающей в себя живую систему и среду, с которой система обменивается энергией и веществом, закон сохранения энергии выполняется. Действительно, как показали опыты, общее количество энергии, которое получает организм за некоторый промежуток времени, вновь обнаруживается впоследствии в виде: а) выделяемого тепла; б) совершаемой внешней работы или выделяемых веществ; в) теплоты сгорания веществ, синтезированных за этот промежуток времени за счет энергии, поступившей извне. II закон (начало) термодинамики.Второй закон термодинамики утверждает, что в изолированной термодинамической системе энтропия никогда не может уменьшаться. Она равна нулю при обратимых процессах и может только увеличиваться при необратимых процессах. Здесь есть также определенная связь с упорядоченностью системы, а также с информацией (большая упорядоченность соответствует большему количеству информации). Можно говорить при этом о единстве природы информации и энтропии. Действительно, увеличение энтропии соответствует переходу системы из более упорядоченного в менее упорядоченное состояние. Такой переход сопровождается уменьшением информации, содержащейся в структуре системы. Беспорядок, неопределенность можно трактовать как недостаток информации. В свою очередь возрастание количества информации уменьшает неопределенность. Вспомним физический смысл энтропии. Все процессы, самопроизвольно протекающие в природе, необратимы и способствуют переходу системы в равновесное состояние, которое всегда характеризуется тем, что: а) в процессе этого перехода всегда безвозвратно выделяется некоторая энергия, и для совершения полезной работы она использована быть не может; б) в равновесном состоянии элементы системы характеризуются наименьшей упорядочен-ностью. Отсюда следует, что энтропия является как мерой рассеяния энергии, так и мерой неупорядоченности системы. Применение второго закона термодинамики к живым системам без учета того, что это открытые системы, приводит к противоречию. Действительно, энтропия должна всегда возрастать, то есть должна расти неупорядоченность живой системы. В то же время мы хорошо знаем, что все живые системы постоянно создают из беспорядка упорядоченность. В них создается и поддерживается физическое и химическое неравновесие, на котором основана работоспособность живых систем. В процессе развития каждого организма (онтогенеза), так же как и в процессе эволюционного развития (филогенеза), все время образуются новые структуры, и достигается состояние с более высокой упорядоченностью. А это означает, что энтропия (неупорядоченность) живой системы не должна возрастать. Таким образом, второй закон термодинамики, справед-ливый для изолированных систем, для живых систем, являющихся открытыми, неприменим. В течение времени жизни живой системы ее элементы постоянно подвергаются распаду. Энтропия этих процессов положительна (возникает неупорядоченность). Для компенсации распада (компенсации неупорядоченности) должна совершаться внутренняя работа в форме процессов синтеза элементов взамен распавшихся. А это означает, что эта внутренняя работа является процессом с отрицательной энтропией (такие процессы называют негэнтропийными, а отрицательную энтропию – негэнтропией). Негэйнтропийный процесс проти-водействует увеличению энтропии системы, которое связано с процессом распада, и создает упорядоченность. Источником энергии для совершения негэнтропийной внутренней работы являются: Для организмов – гетеротрофов (питающихся только органической пищей) – энергия в виде химических связей и низкая энтропия поглощаемых высокоструктурированных органических веществ. В этом случае поглощаемые пищевые вещества обладают большей упорядоченностью (меньшей энтропией), чем выделяемые продукты обмена. Организмы гетеротрофы переносят упорядоченность (негэнтропию) из питательных веществ в самих себя. Для организмов – автотрофов (самостоятельно синтезирующих для себя питательные веще-ства из неорганических соединений с участием солнечного излучения) – энергия солнечного света, представляющего электромагнитное излучение с низкой энтропией. Таким образом, обмен веществ с точки зрения термодинамики необходим для противодей-ствия увеличению энтропии, обусловленному необратимыми процессами в живой системе. Если рассматривать систему «живой организм плюс среда», из которой берутся питательные вещества и в которую отдаются продукты обмена, то второй закон термодинамики справедлив: энтропия этой системы возрастает и никогда не уменьшается. Это означает, что живая система создает внутри себя упорядоченность за счет того, что она уменьшает упорядоченность в окружающей среде. Итак, живая система является открытой системой, и ее энтропия не возрастает, как это имеет место в изолированной системе. Это означает, что живая система постоянно совершает работу, направленную на поддержание своей упорядоченности, и находится в неравновесном стационарном состоянии. Производство энтропии при этом минимально. Таким образом, с позиций термодинамики можно утверждать, что живым системам присущи процессы, уменьшающие энтропию систем и, следовательно, поддерживающие их организованность. Следующий вопрос заключается в том, как реализуются процессы самоуправления и самоорганизации живых систем. Этот вопрос, прежде всего, связан с рассмотрением жизни как информационного процесса. Недаром кибернетика определена ее создателем Н. Винером как «наука об управлении и передачи информации в живых организмах и машинах».
|