
Каковы особенности строения и функций рибосом
Автор — Шувалова Маргарита
Рибосомы — это немембранные органоиды, которые выполняют в клетке важнейшую функцию — синтез белка. Именно в этих маленьких частицах происходит трансляция — «перевод» с языка генетического кода на язык последовательности аминокислот в белке. Давайте разберемся, как устроены рибосомы, откуда они берутся в клетке и какие еще интересные вещи в себе таят.
Рекомендовано для 10–11 классов.
Совет автора: перед прочтением статьи повторите, как в общих чертах идет процесс трансляции.
«Жизнь есть способ существования белковых тел…», — дает нам определение жизни известный классик. И действительно, белки выполняют в наших (да и во всех остальных) организмах практически все функции: структурную, каталитическую, транспортную и многие-многие другие. Пожалуй, белки не могут только хранить и передавать наследственную информацию, но даже к этим процессам они все равно «прикладывают руку».
лки, или протеины, — это полимеры, состоящие из мономеров — аминокислот. Белки синтезируются в ходе матричного синтеза, называемого трансляцией, который протекает на рибосомах*. Более подробно о самой трансляции вы узнаете из наших следующих статей, а пока сосредоточимся на главном действующем лице этого процесса — на рибосоме. Рибосомы по своей природе — это немембранные органоиды, состоящие из РНК и белка. Рибосомы есть во всех формах клеточной жизни и даже иногда встречаются у вирусов (!)**. Давайте подробнее поговорим о строении, образовании и разнообразии этих важнейших органоидов.
*Есть еще пептиды, которые синтезируются не в ходе трансляции и без участия рибосом. Такие пептиды называются «нерибосомальные», о некоторых из них мы рассказывали в предыдущей статье.
**«Вирусные» рибосомы — это, на самом деле, рибосомы клетки-хозяина, которые включились в вирусную частицу при ее выходе из клетки. По-видимому, вирусы никак не используют эти рибосомы — они остаются в качестве своеобразного сувенира от бывшего хозяина и в дальнейшем бесполезны (источник).
Сколько рибосом в клетке?
Органоиды, на которых протекает трансляция, — это необходимый компонент любой живой клетки. Чем «активнее» клетка, тем больше ей нужно синтезировать белка, и тем больше в ней рибосом. В клетке кишечной палочки (Escherichia coli) их насчитывают от нескольких тысяч до нескольких десятков тысяч в зависимости от фазы роста клеточной культуры и интенсивности клеточного деления. Если мы посмотрим на микрофотографию бактериальной клетки (рис.1), то увидим, что цитоплазма буквально «набита» рибосомами, из-за них она имеет зернистую структуру.
У млекопитающих количество рибосом еще более впечатляющее — в одной клетке их содержится порядка 10 миллионов!
Внешний вид рибосом
Под микроскопом рибосомы выглядят как компактные частички порядка 20–30 нм в диаметре (рис. 2).
Каждая рибосома состоит из двух частей — большой и малой субъединиц (рис.3). Они контактируют друг с другом определенным образом, и рибосома может работать только в таком «собранном» виде. По-отдельности субъединицы не могут выполнять свои функции в клетке.
Рибосомы прокариот и эукариот отличаются между собой. Первое отличие, которое мы рассмотрим, касается их массы (рис.3).
Прокариотическая рибосома (рис.3) имеет молекулярную массу 2,5 млн Дальтон (4,15х10^(-18) грамм). Исследования методом центрифугирования (рис.4) показали, что у целой рибосомы коэффициент седиментации — 70S (часто прокариотические рибосомы так и называют — 70S рибосомы). S — это Сведберг, единица коэффициента седиментации. Большая субъединица имеет коэффициент седиментации 50S, а малая — 30S.
! Обратите внимание. При соединении 50S субъединицы и 30S субъединицы константа седиментации целой прокариотической рибосомы получается не 80S, как можно было бы подумать, а 70S. Это происходит потому, что седиментация (осаждение) при центрифугировании зависит не только от массы, но и от формы частицы. Поэтому, когда две субъединицы объединяются в целую рибосому, происходит не просто суммирование их масс, но и появление новой формы, которую нельзя рассматривать как сумму составляющих ее частей. То же самое справедливо и для эукариотической рибосомы.
Эукариотическая рибосома (рис.3) имеет молекулярную массу 4,2 миллиона Дальтон (6,97х10^(-18) грамм). Константа седиментации целой рибосомы — 80S, большой субъединицы — 60S, малой субъединицы — 40S.
Как вы могли заметить из предыдущих рисунков, ни целая рибосома, ни её субъединицы не являются по форме шариками, а имеют сложную структуру. Давайте немного подробнее рассмотрим морфологию рибосомальных субъединиц (рис. 5).
Помимо формы и размера большая и малая субъединица отличаются своими функциями. Важнейшая функция большой субъединицы — образование пептидной связи (рис.6). Малая субъединица ответственна за правильное декодирование триплетов иРНК. Ни большая, ни малая субъединица не могут работать по отдельности, для трансляции обязательно требуется их объединение.
3D-моделирование позволило увидеть рибосомы в объёме. На этом сайте вы можете подробнее рассмотреть 3D структуру рибосомы и «поиграть» с ней: покрутить и посмотреть на нее с разных ракурсов, попробовать найти описанные части рибосомальных субъединиц и туннель для иРНК. Осторожно, это очень залипательное занятие! 🙂
Из каких молекул состоит рибосома
Рибосомы по своей природе являются нуклеопротеидами и состоят из РНК и белков.
Сначала рассмотрим рибонуклеиновый компонент рибосом. РНК, которая находится в рибосоме, называется рРНК, на её долю приходится примерно 80% от всей РНК в клетке. Рибосомальная РНК выполняет в рибосоме важнейшие функции, в том числе катализирует образование пептидной связи. Это может показаться очень странным, ведь обычно за катализ химических реакций в клетке отвечают ферменты — белки, а это другой класс соединений. Тот факт, что в рибосоме основную функцию выполняют именно РНК, является одним из аргументов в пользу гипотезы РНК-мира. Возможно, что рибосома изначально вообще состояла только из РНК, а белки присоединились к ней позднее в ходе эволюции (см. статью).
В рибосоме содержится несколько видов молекул рРНК. Молекулы рРНК у эукариот и прокариот гомологичны, то есть схожи между собой, однако имеются и некоторые отличия.
В прокариотической рибосоме есть три вида РНК: 5S, 16S и 23S РНК. Буква S здесь также означает «Сведберг». Иными словами, разные рРНК имеют свои собственные константы седиментации, соответствующие их названиям. 16S рРНК находится в малой субъединице, и одна из её функций — прикрепить иРНК на рибосому, чтобы начать трансляцию. У прокариот в иРНК перед старт-кодоном есть особая последовательность — последовательность Шайна-Дальгарно. Она нужна, чтобы рибосома могла «ухватиться» за иРНК и начать синтезировать белок. В 16S рРНК содержится участок, который комплементарно связывается с последовательностью Шайна-Дальгарно и обеспечивает эту самую связь.
В большой субъединице у прокариот содержатся два вида рРНК — 23S и 5S рРНК. 23S рРНК ответственна за катализ образования пептидной связи. Зачем нужна 5S рРНК, до сих пор непонятно, хотя на этот счет выдвигаются разнообразные гипотезы.
У эукариотических рибосом 4 вида рРНК: 5S, 5.8S,18S и 28S РНК . В малой субъединице находится 18S рРНК (она гомологична 16S рРНК прокариот). У эукариот нет последовательности Шайна-Дальгарно, и 18S рРНК, похоже, напрямую не связывается с иРНК (в отличие от прокариотической 16S рРНК). В целом у эукариот связывание рибосомы с иРНК и другие стадии трансляции проходят несколько иначе, чем у прокариот, но об этом вы узнаете из наших следующих статей.
В большой субъединице находятся три молекулы рРНК. 5S рРНК гомологична такой же рРНК у прокариот. 5.8S и 28S РНК гомологичны 23S рРНК прокариот и, по сути, являются двумя отдельными ее кусочками.
Как и все другие РНК (за исключением РНК некоторых вирусов), рРНК синтезируются на матрице ДНК с использованием ферментов РНК-полимераз. У бактерий один и тот же вид РНК-полимеразы транскрибирует все виды РНК. У эукариот РНК-полимераз несколько. РНК-полимераза III синтезирует 5S рРНК, а все другие виды рРНК транскрибируются РНК-полимеразой I. Из-за этого факта некоторые ученые предполагают эволюционное родство 5S рРНК и тРНК, которые синтезируются той же РНК-полимеразой.
Все сказанное о рРНК бактерий и эукариот суммировано в таблице 1.
Рибосомальные РНК имеют очень сложную пространственную структуру. Чтобы убедиться в этом, посмотрите на рисунок 7. В качестве примера здесь показана структура 16S рРНК. Обратите внимание на многочисленные шпильки — самокомплементарные участки РНК, которые обеспечивают ее сворачивание и стабилизируют эту сложную структуру. В линейном виде рРНК не может выполнять свои функции.
Особенностью рРНК также являются химические модификации нуклеотидов. У рРНК модифицированы около 2% всех нуклеотидов, и это необходимо для правильного сворачивания рРНК и выполнения ею своих функций. Модификации рРНК происходят при созревании рибосом. Для осуществления некоторых модификаций необходимы другие виды РНК, например, малая ядрышковая РНК. Примеры химических модификаций нуклеотидов рРНК представлены на рисунке 8.
Второй вид молекул, из которых состоят рибосомы, это белки. Они синтезируются в цитоплазме (с помощью рибосом, как и все другие белки), затем проходят через ядерные поры в ядро. В ядре идёт сборка рибосом, и рибосомальные белки, уже в составе рибосомы, снова возвращаются в цитоплазму. Вот такой сложный у них жизненный путь.
Некоторые из рибосомальных белков очень консервативны. Термин «консервативный» означает, что эти белки мало изменялись в ходе эволюции и очень схожи во всех доменах жизни. Помимо таких «всеобщих» белков в рибосомах также имеются и специфические. Они характерны либо только для эукариот, либо только для архей, либо только для бактерий. У эукариот рибосомальных белков больше, они составляют примерно половину массы рибосомы. У прокариот доля белков в рибосоме меньше — около 40%, а 60% приходится на рРНК. Белки и рРНК тесно взаимодействуют в рибосоме, формируя сложную пространственную структуру. Белковый и рибонуклеиновый состав рибосом бактерий и эукариот показан на рисунке 9.
Внутреннее строение рибосом
Внутри рибосома имеет сложное строение, где как раз и происходит «все самое интересное». Её можно сравнить с пещерой, в которой много полостей, ниш и ходов. Своды этой «пещеры» образованы рРНК и белками, причем ученые до сих пор спорят, как именно они там расположены и как друг с другом взаимодействуют.
Внутри рибосомы выделяют следующие важные части (рис.10):
— А-сайт;
— Р-сайт;
— Е-сайт;
— пептидилтрансферазный центр;
— сайт связывания иРНК;
— туннель для выхода белка.
Термин «сайт» в данном случае означает «место». О функциях этих сайтов могут рассказать расшифровки названий. А-сайт назван так потому, что сюда приходит аминоцил-тРНК — транспортная РНК, несущая аминокислоту. В Р-сайте находится пептидил-тРНК (peptidyl) — это «предыдущая» тРНК, её аминокислота уже образовала пептидную связь с растущей белковой цепочкой, но все еще связана с принесшей ее тРНК. Е-сайт (от слова “exit” — «выход») нужен для выхода тРНК, которая уже выполнила свою функцию и отдала аминокислоту растущему белку. Поверхности этих сайтов составлены в основном из рРНК, что опять же указывает на их главную роль в функционировании рибосомы.
Для того, чтобы растущий пептид мог выходить из рибосомы, в большой субъединице образован специальный выходной туннель. Стенки этого туннеля сформированы таким образом, чтобы белок не мог там «залипнуть» и быстро проскальзывал наружу.
Образование пептидной связи происходит между аминоацил-тРНК, находящейся в А-сайте и пептидом в Р-сайте. За катализ образования пептидной связи отвечает пептидилтрансфераза (рис.11). По своей природе пептидилтрансфераза — это участок 23S рРНК у прокариот или 28S у эукариот, то есть она является рибозимом. Это место — «святая святых» рибосомы, именно здесь осуществляется одна из ключевых реакций жизни — образование пептидной связи.
В строении рибосомы можно выделить еще и другие важные области — это места связывания с факторами трансляции. Факторы трансляции — это особые белки, которые необходимы для инициации, элонгации и терминации трансляции, без них рибосома функционировать не может. Подробнее о роли этих факторов мы расскажем в статье, посвященной трансляции.
Итак, мы с вами разобрали «морфологию» и «анатомию» рибосомы — как она выглядит внешне и как устроена внутри. Во второй части нашего рассказа вы узнаете, откуда рибосомы берутся в клетке, какими они бывают и как ученые придумали их использовать для установления родства организмов. Ну а в заключительной части мы расскажем о функционировании рибосом и подробнее разберем механизм трансляции.
Источник: vk.com
Строение
Важнейшей органеллой клетки является ядро. Оно содержит генетическую информацию и ядрышко, где образуются рибосомы. Синтезированные рибосомы через поры ядерной мембраны попадают либо на эндоплазматическую сеть, либо в цитоплазму. В зависимости от расположения в эукариотической клетке выделяют два вида рибосом:
- связанные – располагаются на эндоплазматической сети (шероховатый вид);
- свободные – располагаются в цитозоле.
Гладкая ЭПС образуется после освобождения от рибосом. В растительных клетках гладкая ЭПС формирует провакуоли, из которых затем образуются вакуоли.

Рибосомы – немембранные органеллы, имеющие округлую форму и состоящие из двух частей – субъединиц (большой и малой), каждая из которых содержит рибосомальную РНК (рРНК) и белки. С химической точки зрения рибосома – нуклеопротеид, состоящий из нуклеиновых кислот и протеинов.

Различают четыре разновидности молекул РНК рибосомы:
- 18S-РНК – содержит 1900 нуклеотидов;
- 5S-РНК – содержит 120 нуклеотидов;
- 5,8S-РНК – состоит из 160 нуклеотидов;
- 28S-РНК – состоит из 4800 нуклеотидов.
Малая частица рибосомы образована 30–35 белками и 18S-РНК. В большую субчастицу входит 45-50 белков и 5S-, 5,8S-, 28S-РНК.
В нерабочем состоянии части рибосом разъединены. Они соединяются с помощью информационной (матричной) РНК, обхватывая её с двух сторон. При синтезе белка рибосомы объединяются, образуя комплексы – полисомы или полирибосомы, связанные мРНК и напоминающие бусины на нитке.
Синтез белка
Главная функция рРНК – синтез белка из аминокислот.
Биосинтез белков включает два процесса:
- транскрипцию;
- трансляцию.
Транскрипция происходит с участием ДНК. Генетическую информацию считывается с ДНК и с помощью фермента РНК-полимеразы образуется мРНК. Далее начинается процесс трансляции, происходящий на рибосомах.
Этот процесс разделяется на три этапа:
- инициацию – начало синтеза;
- элонгацию – биосинтез;
- терминацию – завершение синтеза, отделение рибосомы.
При инициации происходит сборка рибосомы. Контактные части субъединиц называются активными центрами, между которыми располагается:
- мРНК в качестве «шаблона» синтеза;
- тРНК, осуществляющая перенос аминокислот на синтезируемую цепь;
- синтезируемый пептид, состоящий из аминокислот.
В процессе элонгации происходит удлинение полипептидной цепи за счёт присоединения аминокислот. Цепь отсоединяется от рибосомы на стадии терминации благодаря стоп-кодону – единицы генетического кода, шифрующего прекращение синтеза белка.

Биосинтез требует энергетических затрат. При присоединении одной аминокислоты расходуется по две молекулы АТФ (аденозинтрифосфата) и ГТФ (гуанозинтрифосфата). Кроме того, ГТФ тратится на процессы инициации и терминации.
Источник: obrazovaka.ru
Рибосомы — это уникальные природные фабрики, синтезирующие белок. Небольшие шарообразные органоиды, диаметр которых составляет 10-30 нм. Рибосомы представляют собой комплексы рибосомальной РНК с белками.
Рибосомы всех живых организмов состоят из двух субъединиц — малой субъединицы, и большой субъединицы.
Рибосомы формируются в ядрышках ядра, а затем выходят в цитоплазму, где и начинают выполнять свою главную функцию – синтез белков.
Рассмотрим процесс участия рибосом в синтезе белков.
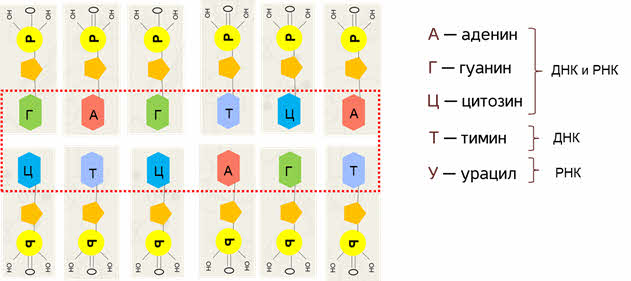
Мы ранее говорили о том что генетический код записан на языке нуклеотидов..
В состав которых входят азотистые основания аденин, гуанин, цитозин, которые входят в состав как ДНК, так и РНК. Тимин (T) входит в состав только ДНК, а урацил встречается только в РНК.
Азотистые основания — это 4 строительных кирпичика молекулы ДНК.
Синтез белков начинается с того что в ядре цепь ДНК расплетается с одной из её цепей происходит считывание информации (то есть ДНК выступает как матрица).
Другими словами, происходит перенос генетической информации (ее копирование) с ДНК на РНК.
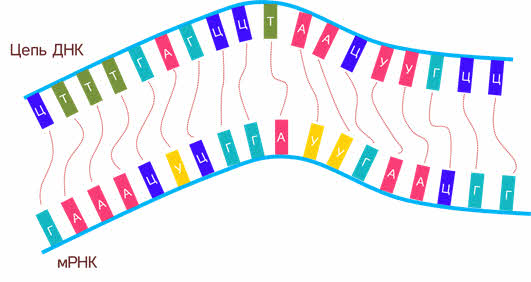
Такая РНК называется матричной (или информационной) так как она несёт информацию из ядра в цитоплазму на рибосомы.
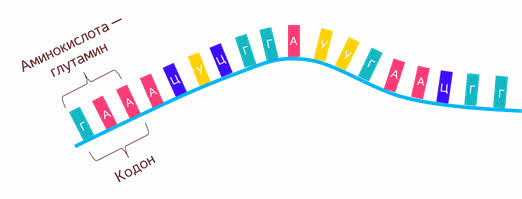
Сама матричная РНК состоит из кодонов триплетов (в последствии 1 кодон будет кодировать 1 аминокислоту). А из аминокислот как вы знаете состоят белки. И уже в цитоплазме – рибосомы, захватывают матричную РНК.
Однако сперва к матричной РНК присоединяется малая субъединица рибосомы.
Ещё одна важная молекула (транспортная РНК). Она доставляет к рибосомам аминокислоты.
Транспортная РНК выглядит в форме "клеверного листа" и содержит в своём составе тройку нуклеотидов, которую называют антикодоном.

Антикадон взаимосоответствует, то есть комплементарен кодону в матричной РНК с которым он связывается. К концу транспортной РНК присоединена соответствующая аминокислота.
Присоединяясь большая субъединица рибосомы формирует пептидильный (или П-участок) и аминоацильный (или А-участок).
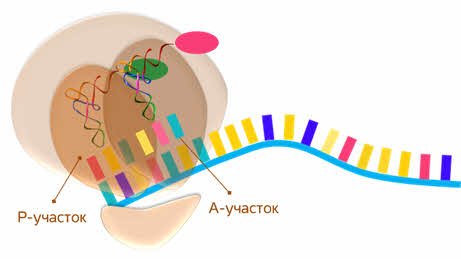
Входящая в А участок вторая транспортная РНК взаимосоответствует, то есть комплементарна второму кодону. Аминокислота первой транспортной РНК переноситься на аминокислоту второй транспортной РНК.
Первая транспортная РНК уходит, и рибосома продвигается дальше до конца матричной РНК.
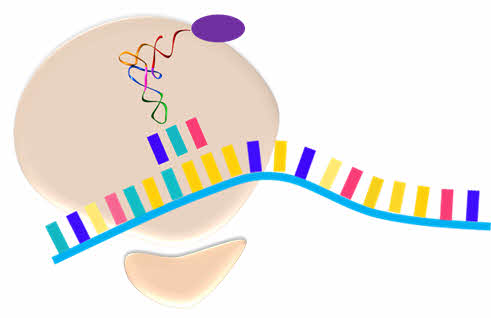
Таким образом происходит присоединение аминокислот, которые на поверхности рибосомы формируются в полипептидную цепочку.
Таким образом малая субъединица опознает подходящую РНК и место на ней, с которого нужно начать синтез белка. А большая субъединица, содержащая каталитический центр, присоединяется ко всей конструкции и ускоряет образование пептидной связи между растущей полипептидной цепочкой будущего белка и каждой последующей аминокислотой.
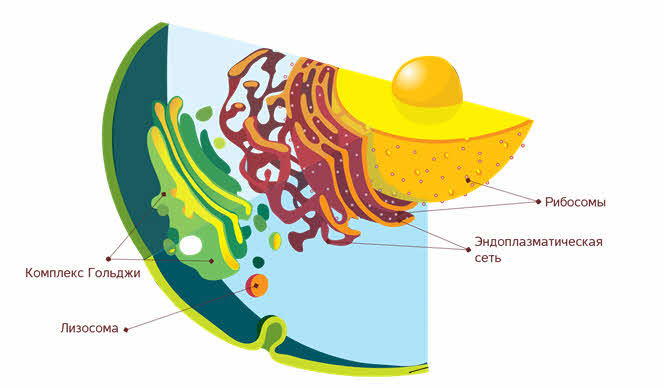
Рибосомы могут свободно перемещаться в цитоплазме. Либо прикрепляться к эндоплазматической сети.
Рассмотрим строение и функции эндоплазматической сети.
Эндоплазматическая сеть или эндоплазматический ретикулум как её ещё называют − это внутриклеточный органоид эукариотической клетки, который представляет собой разветвлённую систему из окружённых мембраной уплощённых полостей, пузырьков и канальцев.
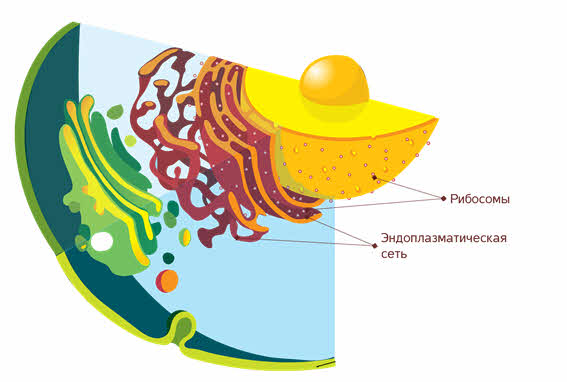
Каналы эндоплазматической сети могут пронизывать всю цитоплазму клетки. Они могут ветвиться и соединяться друг с другом, образуя транспортную систему клетки.
Структура эндоплазматической сети не является стабильной и подвержена частым изменениям.
Мембрана эндоплазматической сети морфологически идентична оболочке клеточного ядра и составляет с ней одно целое. Таким образом, её полости открываются в межмембранную полость ядерной оболочки.
Выделяют два вида эндоплазматической сети.
Часть мембран сети покрыта рибосомами – эту часть эндоплазматической сети называют шероховатой (гранулярной).
На шероховатой эндоплазматической сети происходит синтез белков в рибосомах.
Другая часть эндоплазматической сети называется гладкой (агранулярной). Она выполняет транспортную функцию белков.
Посмотрим, как это происходит.
Синтезированный рибосомами белок подходит к мембране эндоплазматической сети в это время она выгибается, захватывает белок и таким образом образуется пузырёк с белком − везикула.
Агранулярная эндоплазматическая сеть также участвует во многих процессах метаболизма. Также она играет важную роль в углеводном обмене, нейтрализации ядов и запасании ионов кальция. Ферменты агранулярной эндоплазматической сети участвуют в синтезе различных липидов и фосфолипидов, жирных кислот и стероидов.
Эндоплазматическая сеть — это транспортная система клетки. В которой происходит синтез белков, липидов и других веществ которые необходимы как самой клетке, так и многим другим клеткам. Если речь идёт о многоклеточно организме.
Также эндоплазматическая сеть принимает участие в том числе и в создании новой ядерной оболочки (например, после митоза).
Строение и функции комплекса Гольджи.
Синтезированные на рибосомах белки проходят через эндоплазматическую сеть и в виде везикул транспортируются в комплекс Гольджи.
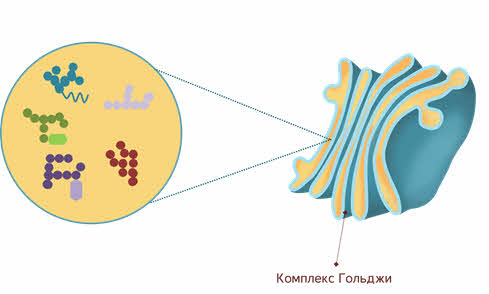
Который представлен в виде полостей, уложенных своеобразными стопками.
В отделах комплекса Гольджи белки изменяют свои формы (дозревают). Здесь к ним при помощи специальных ферментов присоединяются такие материалы как липиды и углеводы. Такие белки используются клеткой.
Комплекс Гольджи выполняет роль сортировщика белков. Белки с одинаковой сигнальной последовательностью будут отправлены в одинаковые части клетки, либо за пределы клетки.
Каким же образом это происходит?
От расширений цистерн комплекса Гольджи отщепляются пузырьки, содержащие эти белки. В дальнейшем они могут сливаться друг с другом и увеличиваться в размерах, образуя секреторные гранулы.
После этого секреторные гранулы начинают двигаться к поверхности клетки, соприкасаются с плазмолеммой, с которой сливаются их собственные мембраны, и таким образом содержимое гранул оказывается за пределами клетки.
Так изменённые и сортированные белки выходят из комплекса Гольджи в виде пузырьков.
Из пузырьков комплекса Гольджи содержащей ферменты образуются и (удалить и) пищеварительные органеллы лизосомы.
Рассмотрим строение и функции лизосом.
Лизосома – это окружённый мембраной клеточный органоид, который содержит в себе большой набор ферментов, способных разрушать пищевые вещества.
Данные ферменты формируются из белков в комплексе Гольджи.
Как вы уже знаете клетка захватывает необходимые ей вещества либо при помощи фагоцитоза, либо при помощи пиноцитоза. Поступившие питательные вещества необходимо расщепить (переварить).
Как вы знаете белки расщепляются до аминокислот, полисахариды до глюкозы, а липиды – до глицерина и жирных кислот. И для того что бы, например, полисахарид расщепился, и клетка получила необходимые ей молекулы глюкозы. Ему необходимо встретиться с лизосомой, которая содержит необходимые ферменты для расщепления.
Участие лизосомы в процессе питания простейших, также имеют немаловажную роль. Амёба питается путём фагоцитоза, поглощая бактерий, одноклеточные водоросли и мелких простейших.

Крупные частицы пищи захватываются в пищеварительные вакуоли, которые сливаются с лизосомами. Куда начинают поступать ферменты для переваривания.
Продукты переваривания проникают в цитозоль и используются в качестве пищи. Ферменты лизосомы очень активны, однако они не разрушают окружающую их мембрану.
Иногда лизосомы способны разрушить клетку, в которой они находятся.
Такой процесс разрушения − автолиз просто необходим будущей лягушке.
Лизосомы постепенно переваривают все клетки хвоста головастика во время его превращения в лягушку. А образовавшиеся во время этого процесса вещества всасываются и используются другими клетками тела.

Так же лизосомы можно назвать сборщиками мусора. Они уничтожают повреждённые или изношенные части клетки. К примеру, во время замены старых органоидов новыми, или переваривание белков и других веществ, произведённых внутри самой клетки. Лизосомы своими ферментами расщепляют весь клеточный мусор.
Такой процесс называется аутофагией — уничтожение ненужных клетке структур.
Источник: videouroki.net