Виды рибосом
Рибосома, функции которой будут рассмотрены в этой статье, – это частица, которая расположена непосредственно внутри клетки. Основная функция этой частицы – биосинтез белка. Основная, но не единственная.
Первооткрывателем рибосомы принято считать биолога Джорджа Палладе. Свое открытие он сделал в 1953 году, используя в своей работе электронный микроскоп.
Если говорить о вкладе русских ученых в изучении рибосомы, то стоит выделить работу биохимика академика А. С. Спирина.
Внешний вид рибосомы и ее другие особенности
Если внимательно рассмотреть клетку на электронных микрофотографиях, то можно увидеть небольшие частицы, расположенные в цитоплазме. Этими частицами и являются рибосомы.
Название «рибосома» состоит из двух частей. Первая походит от «рибонуклеиновая кислота», а вторая в переводе с греческого «сома» — тело.
Размер рибонуклеиновых частиц клетки колеблется в пределах 15-20 нм, а количество их полностью зависит от процесса биосинтеза белка, а именно — его интенсивности. Как правило, рибосом может быть около 5000 штук, в некоторых случаях – до 90 000. Если говорить о массе этого количества частиц, она порой может доходить до четверти массы самой клетки.
Форма рибосомы больше напоминает сферу, но однозначно констатировать этот факт невозможно. А вот функция рибосом в клетке связана с биосинтезом белка, и это подтвержденный факт.
По своей химической природе эти частицы относятся к нуклеопротеидам (комбинация нуклеиновых кислот с белком), которые состоят из рибонуклеиновой кислоты.
Прокариотический тип
Существует два типа рибосомы, строение и функции которых немного отличаются друг от друга.
Первый тип характерен для клеток бактерий и зеленых водорослей, то есть прокариотических организмов. Ее название — 70S рибосома, функции она выполняет все те же. Число в названии означает коэффициент седиментации (величина, которая определяет размер и форму макромолекул, а также скорость осаждения определенной микрочастицы, в данном случае рибосомы, в достаточно сильном гравитационном поле). Для этого типа он составляет 70 единиц Сведберга. Данные рибосомы состоят из двух неравноправных частиц: 30S и 50S. В первой составляющей находится одна молекула белка, во второй – две молекулы РНК. Основная функция, которую выполняют молекулы белка, входящие в состав рибосомы – структурная.
Эукариотический тип
Второй тип рибосом был обнаружен в клетках эукариотов (растительные или же животные организмы, у которых в клетках присутствует четко выраженное ядро). Название этой субчастицы – 80S. Рибосомы, функции которых заключаются в синтезе белка данного класса, состоят из равных частей РНК и белка. Но все те же две неравные субъединицы есть и в них (60S и 40S).
Рибосомы: строение и функции
Рибосома состоит из двух неравных субъединиц.
Большая субчастица, в свою очередь, состоит из:
- одной молекулы рибосомальной РНК, которая является высокополимерной;
- одной молекулы РНК, которая является низкополимерной;
- некоторого количества молекул белка, как правило, их около трех десятков.
Что касается меньшей субчастицы, то тут немного проще. В ее состав входят:
- молекула высокополимерной РНК;
- несколько десятков молекул белка, как правило, около 40 штук (молекулы при этом разнообразные по структуре и форме).
Молекула высокополимерной РНК необходима для того, чтобы все присутствующие белки соединить в одну целостную рибонуклеопротеидную составляющую клетки.
В процессе выполнения основной своей функции, то есть во время синтеза белка, рибосома выполняет и ряд дополнительных:
- Связка, а также удержание всех составляющих так называемой белоксинтезирующей системы. Принято называть данную функцию информационной, или матричной. Рибосома функции эти распределяет между двумя своими субчастицами, каждая из которых выполняет свою определенную задачу в данном процессе.
- Рибосомы выполняют функцию каталитическую, которая заключается в образовании особой пептидной связи (амидная связь, которая возникает как при образовании белков, так и при возникновении пептидов). Сюда же можно отнести и гидролиз ГТФ (субстрата для синтеза РНК). За выполнение этой функции отвечает большая субъединица рибосомы. Именно в ней находятся специальные участки, в которых и происходит процесс синтеза пептидной связи, а также центр необходимый для гидролиза ГТФ. Помимо этого именно большая субъединица рибосомы во время биосинтеза белка удерживает на себе цепь, которая постепенно вырастает.
- Выполняет рибосома функции механического передвижения субстратов, к коим относятся иРНК и тРНК. Иными словами, они отвечают за транслокацию.
В качестве заключения
Буквально каждая из субъединиц рибосомы, как большая, так и маленькая, может проявлять в некоторой степени те функции, которые непосредственно с ней связаны, отдельно от своей «соседки». Однако выполнять функцию транслокации может лишь рибосома в полном составе.
Можно смело сказать, что существует четкое разделение функций между частицами рибосомы. Малая часть отвечает за выполнение приема, а также расшифровку генетической информации. А вот большая частица принимает непосредственное участие в транслитерации.
Источник: www.syl.ru
Какую функцию выполняют рибосомы
Назначение описываемого органоида в любой клетке заключается в осуществлении синтеза белков. Белки используются практически всеми клетками:
- в качестве катализаторов — ускоряют время реакции;
- в качестве волокон — обеспечивают стабильность клетки;
- многие белки имеют индивидуальные задачи.

Основным хранилищем информации в клетках служит молекула дезоксирибонуклеиновой кислоты (ДНК). Специальный фермент, РНК-полимераза, связывается с молекулой ДНК и создает «зеркальную копию» — матричную рибонуклеиновую кислоту (мРНК), свободно перемещающуюся из ядра в цитоплазму клетки.
Цепочка рибонуклеиновой кислоты обрабатывается при выходе из ядра; области РНК, которые не кодируют белки, удаляются; мРНК используется для дальнейшего синтеза белка.
Каждая мРНК состоит из 4 различных нуклеиновых кислот, тройки которых составляют кодоны. Каждый кодон определяет специфическую аминокислоту. В организме всех живых существ на Земле встречаются 20 аминокислот. Кодоны, используемые для спецификации аминокислот, почти универсальны.
Кодон, запускающий все белки — «AUG», последовательность нуклеиновых оснований:
- аденин;
- урацил;
- гуанин.
Специальная молекула РНК поставляет аминокислоты для синтеза — транспортная РНК или тРНК. К активному кодону подходит тРНК, несущая соответствующую аминокислоту, ассоциируется с ним. Происходит образование пептидной связи новой аминокислоты со строящимся белком.
Где образуются рибосомы
Составные части органоида образуются в ядрышке. Две субъединицы объединяются для начала химического процесса синтеза белка из цепи мРНК. Рибосома действует в качестве катализатора, образуя пептидные связи между аминокислотами. Использованная тРНК высвобождается обратно в цитозоль, в дальнейшем она может связываться с другой аминокислотой.

Органоид достигнет стоп-кодона мРНК (UGA, UAG и UAA), остановив процесс синтеза. Специальные белки (факторы терминации) прервут цепочку аминокислот, отделив ее от последней тРНК — формирование белка закончится.
Различные белки требуют некоторых модификаций, транспортировки в определенные области клетки до начала функционирования. Рибосома, прикрепленная к эндоплазматическому ретикулуму, поместит вновь образованный белок внутрь, он пройдет дополнительные модификации, будет должным образом свернут. Другие белки образуются непосредственно в цитозоли, где действуют как катализатор для различных реакций.
Рибосомы создают нужные клеткам белки, составляющие около 20 процентов состава клетки. Приблизительно в клетке находится 10 000 различных белков, приблизительно по миллиону копий каждого.
Рибосома эффективно и быстро участвует в синтезе, добавляя 3-5 аминокислот к белковой цепи в секунду. Короткие белки, содержащие несколько сотен аминокислот, могут быть синтезированы за считанные минуты.
Состав и строение рибосом
Рибосомы имеют схожую структуру в клетках всех организмов Земли, незаменимы при синтезе белков. В начале эволюции различных форм жизни рибосома была принята в качестве универсального способа перевода РНК в белки. Эти органоиды изменяются в различных организмах незначительно.

Описываемые органоиды состоят из большой и малой субъединицы, располагающихся вокруг молекулы мРНК. Каждая субъединица представляет собой комбинацию белков и РНК, называемых рибосомальной РНК (рРНК).
Длина рРНК в разных цепях разная. рРНК окружена белками, создающими рибосому. рРНК удерживает мРНК и тРНК в органоиде и действует в качестве катализатора для ускорения образования пептидных связей между аминокислотами.
Рибосомы измеряются в единицах Svedberg, означающих сколько времени требуется молекуле для осаждения из раствора в центрифуге. Чем больше число, тем больше молекула.
Различия между прокариотическими и эукариотическими рибосомами рассмотрены в таблице.
| Критерий | Прокариотические | Эукариотические |
| Размер в единицах Svedberg | 70S | 80S |
| содержание белков и РНК | меньше белков и меньше РНК | больше белков и больше РНК |
| содержание молекул РНК | 3 молекулы РНК | 4 молекулы РНК |
Рибосомы отвечают за процесс синтеза белка – двигательной силы организма и являются одним из ключевых органоидов живой клетки, представленной во всем многообразии живых существ на Земле.
Источник: 1001student.ru
Внешний вид рибосомы и ее другие особенности
Если внимательно рассмотреть клетку на электронных микрофотографиях, то можно увидеть небольшие частицы, расположенные в цитоплазме. Этими частицами и являются рибосомы.
Название «рибосома» состоит из двух частей. Первая походит от «рибонуклеиновая кислота», а вторая в переводе с греческого «сома» — тело.
Размер рибонуклеиновых частиц клетки колеблется в пределах 15-20 нм, а количество их полностью зависит от процесса биосинтеза белка, а именно — его интенсивности. Как правило, рибосом может быть около 5000 штук, в некоторых случаях – до 90 000. Если говорить о массе этого количества частиц, она порой может доходить до четверти массы самой клетки.
Форма рибосомы больше напоминает сферу, но однозначно констатировать этот факт невозможно. А вот функция рибосом в клетке связана с биосинтезом белка, и это подтвержденный факт.
По своей химической природе эти частицы относятся к нуклеопротеидам (комбинация нуклеиновых кислот с белком), которые состоят из рибонуклеиновой кислоты.
Прокариотический тип
Существует два типа рибосомы, строение и функции которых немного отличаются друг от друга.
Первый тип характерен для клеток бактерий и зеленых водорослей, то есть прокариотических организмов. Ее название — 70S рибосома, функции она выполняет все те же. Число в названии означает коэффициент седиментации (величина, которая определяет размер и форму макромолекул, а также скорость осаждения определенной микрочастицы, в данном случае рибосомы, в достаточно сильном гравитационном поле). Для этого типа он составляет 70 единиц Сведберга. Данные рибосомы состоят из двух неравноправных частиц: 30S и 50S. В первой составляющей находится одна молекула белка, во второй – две молекулы РНК. Основная функция, которую выполняют молекулы белка, входящие в состав рибосомы – структурная.
Эукариотический тип
Второй тип рибосом был обнаружен в клетках эукариотов (растительные или же животные организмы, у которых в клетках присутствует четко выраженное ядро). Название этой субчастицы – 80S. Рибосомы, функции которых заключаются в синтезе белка данного класса, состоят из равных частей РНК и белка. Но все те же две неравные субъединицы есть и в них (60S и 40S).
Рибосомы: строение и функции
Рибосома состоит из двух неравных субъединиц.
Большая субчастица, в свою очередь, состоит из:
- одной молекулы рибосомальной РНК, которая является высокополимерной;
- одной молекулы РНК, которая является низкополимерной;
- некоторого количества молекул белка, как правило, их около трех десятков.
Что касается меньшей субчастицы, то тут немного проще. В ее состав входят:
- молекула высокополимерной РНК;
- несколько десятков молекул белка, как правило, около 40 штук (молекулы при этом разнообразные по структуре и форме).
Молекула высокополимерной РНК необходима для того, чтобы все присутствующие белки соединить в одну целостную рибонуклеопротеидную составляющую клетки.
В процессе выполнения основной своей функции, то есть во время синтеза белка, рибосома выполняет и ряд дополнительных:
- Связка, а также удержание всех составляющих так называемой белоксинтезирующей системы. Принято называть данную функцию информационной, или матричной. Рибосома функции эти распределяет между двумя своими субчастицами, каждая из которых выполняет свою определенную задачу в данном процессе.
- Рибосомы выполняют функцию каталитическую, которая заключается в образовании особой пептидной связи (амидная связь, которая возникает как при образовании белков, так и при возникновении пептидов). Сюда же можно отнести и гидролиз ГТФ (субстрата для синтеза РНК). За выполнение этой функции отвечает большая субъединица рибосомы. Именно в ней находятся специальные участки, в которых и происходит процесс синтеза пептидной связи, а также центр необходимый для гидролиза ГТФ. Помимо этого именно большая субъединица рибосомы во время биосинтеза белка удерживает на себе цепь, которая постепенно вырастает.
- Выполняет рибосома функции механического передвижения субстратов, к коим относятся иРНК и тРНК. Иными словами, они отвечают за транслокацию.
В качестве заключения
Буквально каждая из субъединиц рибосомы, как большая, так и маленькая, может проявлять в некоторой степени те функции, которые непосредственно с ней связаны, отдельно от своей «соседки». Однако выполнять функцию транслокации может лишь рибосома в полном составе.
Можно смело сказать, что существует четкое разделение функций между частицами рибосомы. Малая часть отвечает за выполнение приема, а также расшифровку генетической информации. А вот большая частица принимает непосредственное участие в транслитерации.
Источник: www.syl.ru
Новые вехи в истории рибосомы
Новая волна интереса к рибосомам поднялась в начале 90-х годов прошлого столетия. Возможно, толчком к этому послужили две примечательные работы, посвященные исследованию рибосом на разных стадиях жизни эукариотических организмов — малярийного плазмодия и клеточного слизевика.
Малярийный плазмодий вызывает у человека тяжелое заболевание — малярию. Заражение происходит после укуса малярийного комара, в слюне которого находится возбудитель болезни. Отличительной особенностью плазмодия является то, что его жизненный цикл состоит из двух частей (рис. 1). Одна часть протекает в теле комара, другая — в теле человека [12].
После укуса спорозоиты плазмодия — мелкие червеобразные подвижные клетки — попадают в кровоток. По кровотоку они достигают печени, где размножаются бесполым путем, превращаясь в одноядерные клетки, называемые мерозоитами. Голодные мерозоиты атакуют клетки крови — эритроциты — и проникают в них. Питаясь гемоглобином, мерозоиты продолжают бесполое размножение. Через некоторое время они разрушают эритроциты и снова выходят в кровь, где набрасываются на новые эритроциты. Это происходит циклично через каждые 48 часов. При разрушении эритроцитов в кровоток попадают и токсичные продукты жизнедеятельности мерозоитов, так что у человека через равные промежутки времени наблюдаются приступы лихорадки с ознобом и высокой температурой.
На стадии выхода из эритроцитов часть мерозоитов приобретает признаки половых клеток (мужских и женских) — образуются гаметоциты. Когда это происходит, плазмодий вступает во вторую стадию жизненного цикла, которая протекает в теле комара. Если комар выпивает кровь больного малярией человека, то в его организме гаметоциты окончательно созревают и превращаются в гаметы. Именно в теле комара гаметы сливаются, образуя оплодотворенную яйцеклетку. Для дальнейшего развития яйцеклетке необходимо попасть в кишечник комара, где она, проходя несколько стадий, образует спорозоиты. Малярийный плазмодий возвращается в то состояние, когда для дальнейшего развития ему снова необходимо попасть в тело человека. Как только комар кусает свою жертву, спорозоиты попадают в кровь, и цикл повторяется.
Так вот, изучая рибосомы малярийного плазмодия, ученые выяснили, что рРНК малой субъединицы рибосомы кодируется двумя генами [13]. Оказалось, что в клетках плазмодия, живущего в москитах, образуется продукт одного рРНК-гена, а в клетках, попавших в млекопитающее или человека, — продукт другого гена рРНК. Выходило, что, во-первых, состав рибосомы может меняться, а, во-вторых, что эти изменения зависят от состояния внешней среды и от фазы жизненного цикла организма.
Похожие результаты, но уже в отношении других компонентов рибосомы — рибосомных белков — несколькими годами позже получили другие ученые.
Dictyostelium discoideum — слизевик, обитающий в верхних слоях почвы, — является излюбленным модельным организмом молекулярных биологов.
Бóльшую часть жизненного цикла диктиостелиум проводит в виде одноклеточных амёбоподобных форм (миксамёб), питающихся бактериями и дрожжами. При благоприятных условиях (достаточная влажность, нужная температура, наличие питательных веществ) миксамёбы питаются и свободно размножаются делением надвое. Можно сказать, что миксамёбы — индивидуалисты, предпочитающие избегать контактов с сородичами, но когда их численность возрастает и пищевые ресурсы заканчиваются, начинают происходить удивительные вещи. Одна или несколько голодающих клеток принимаются выделять молекулы циклического аденозинмонофосфата (цАМФ) — сигнала «клеточного голода», который одновременно является хемоаттрактантом, привлекающим к источнику сигнала соседних миксамёб. Во время миграции ползущие миксамёбы выделяют и собственное небольшое количество цАМФ, привлекая все больше и больше новых клеток. В результате происходит быстрое объединение огромного количества миксамёб в единый холмообразный агрегат, насчитывающий до нескольких тысяч особей. Так возникает псевдоплазмодий — большое скопление амёбоидных клеток. От обычного плазмодия он отличается тем, что образующие его клетки не сливаются воедино полностью, а, находясь в тесном контакте с соседними клетками, все же сохраняют обособленность и индивидуальность. После агрегации, клетки, находящиеся на вершине «холма», все еще выделяют сигнальные молекулы, и за счет этого продолжают выталкиваться кверху клетками, находящимися у «подножия». Плазмодий вытягивается вверх, а затем заваливается на бок. С этого момента он переходит в стадию «слизня». Мигрируя по направлению к свету и более высокой температуре, слизень достигает поверхности почвы, где в результате перегруппировки и дифференцировки составляющих его клеток формируется плодовое тело. Оно состоит из вытянутого стебелька и находящейся на его вершине споровой коробочки. Споры после созревания рассеиваются ветром, и на новых местах при благоприятных условиях из них выходят миксамёбы, а жизненный цикл слизевика начинается заново (рис. 2) [14].
Именно этот необычный жизненный цикл диктиостелиума заинтересовал ученых из Института молекулярной биологии в Нью-Джерси [15]. Они исследовали рибосомы клеток, находящихся на разных жизненных этапах: на стадии одноклеточной миксамёбы (назовем их рибосомы «старыми») и на стадии споры (назовем их рибосомы «новыми»). Из клеток обеих стадий выделили рибосомные белки и количественно сравнили. Результаты были неожиданными. Как оказалось, между стадиями жизненного цикла происходит некое «переключение» состава рибосом, когда «старые» рибосомы утилизируются и на их место приходят «новые», состав которых отличен от первоначального (рис. 3)! В чем состояло отличие? Оказалось, что «новые» рибосомы содержат иные количества некоторых рибосомных белков по сравнению со «старыми». Опять, как и в случае с плазмодием, получалось, что состав рибосом меняется в зависимости от стадии клеточного цикла, но изменениям в данном случае подвергается уже не рРНК, а другой компонент рибосомы — белки.
Как можно объяснить полученные в ходе этих двух экспериментов данные, фиксирующие изменения в составе рибосом, которые зависят от стадии жизни организма и от условий внешней среды? Знакомясь с научными статьями, посвященными этому вопросу, можно встретить разные рассуждения. Например, такое. Оно опирается на наше знание того, что на разных стадиях жизненного цикла производимый клеткой набор белков примерно схож. Но для каждой стадии существуют и свои характерные белки. По-видимому, для производства таких белков на каждой конкретной стадии необходимы «специальные» рибосомы. При переходе на другую стадию, где требуются иные характерные белки, образуются иные «специальные» рибосомы. Но как рибосома узнает, какие именно белки ей производить? Можно предположить, что для производства «нужных» белков она должна «выбрать» соответствующие им мРНК из всех мРНК, присутствующих в клетке. Как и какие мРНК ей выбрать для трансляции? Опять же можно предположить, что в рибосоме существует некий участок (это могут быть области рРНК, рибосомных белков или те и другие одновременно), взаимодействующий с молекулами мРНК и каким-то образом производящий «селекцию» тех молекул мРНК, которые будут использованы для трансляции. Иными словами, те или иные молекулы, входящие в рибосому, могут напрямую влиять на то, какие мРНК она «выберет» для трансляции и, следовательно, на то, какие белки будут образовываться в клетке [16]. Эти рассуждения приводят к вероятности существования взаимозависимости между набором белков и составом рибосом.
Встречаются и другие рассуждения. Вот еще одно из них. Обновление молекул, включая и те, что входят в рибосому, — это главнейший процесс во время роста и развития клетки. Поэтому можно рассматривать синтез «новых» рибосом как механизм поддержания стабильности этих органелл и их функциональной целостности для обеспечения выживаемости организма [17]. Например, в случае со слизевиком ученые обнаружили, что малая (40S) субъединица рибосом у спор более устойчива к воздействию температуры, чем малая субъединица рибосом миксамёб. Возможно, именно «новые» рибосомные белки обеспечивали эту стабильность. Эти рассуждения могут приводить к мысли о том, что рибосомы способны играть роль в поддержании гомеостаза для повышения выживаемости организма.
Во времена описываемых опытов образование зрелой 80S рибосомы из двух субъединиц являлось загадкой, но третий вариант рассуждений [16] был приближен к современному и опирался на то, что для соединения двух субъединиц в одну зрелую крайне важно взаимодействие рРНК и рибосомных белков. Однако было непонятно, какую именно роль играют рРНК и рибосомные белки в образовании ее функциональных областей. Предполагалось, что рРНК крайне важна для производства белковой цепи, и ее «правильная» структура необходима для протекания разных этапов этого процесса. А вот рибосомные белки нужны именно для создания такой структуры. Они являются каркасом для правильного расположения рРНК в зрелой рибосоме. Таким образом, назначение «переключения» белкового состава рибосом — регулировать пространственную структуру рибосомы, обеспечивая доступ к ее участкам, необходимым для трансляции белков именно на данном этапе жизненного цикла.
Проведенные опыты позволили ввести понятие гетерогенной популяции рибосом — то есть такой популяции, в которой один или несколько структурных компонентов (рибосомные белки или рибосомные РНК) зрелой органеллы подвергались изменениям (качественным или количественным) в течение жизненного цикла клетки.
Возникало множество вопросов. Например, какое из приведенных выше суждений справедливо, какая теория верна? Какую все-таки роль играют рибосомные белки и рРНК в функционировании рибосомы? Влияют ли они на синтез специфических молекул, характерных для клеток определенных стадий и тканей? Каков механизм «переключения» состава рибосомы? Существуют ли гомогенные популяции рибосом, то есть такие, состав которых не меняется? А также возникали многие другие вопросы, ответов на которые в то время не было.
Рибосома — молекулярный фильтр?
В данной статье невозможно описать все эксперименты, проведенные исследователями во время поиска ответов на эти вопросы, хотя многие из них были крайне смелыми и новаторскими и, несомненно, увлекли бы читателя. Но мы ограничимся наиболее значительными, а также опишем ключевые научные идеи, лежащие в основе современного взгляда на рибосому.
В самом начале нового тысячелетия возникла гипотеза рибосомного фильтра [18]. Заслуга авторов этой гипотезы, Винсента Мауро и Геральда Эдельмана, в том, что они, проанализировав и обобщив накопившиеся к тому времени данные, предложили совершенно новый взгляд на рибосому и на принцип ее функционирования. Если раньше рибосома рассматривалась как пассивная структура, с машинной точностью воспроизводящая генетическую информацию, то новый взгляд, предложенный авторами, возводил рибосому в новый ранг, и теперь ей приписывалась неожиданная роль в управлении фундаментальными клеточными процессами. Она приобретала звание «фильтра», который из общего потока клеточных мРНК отсеивает некоторую часть с заданными свойствами и на их основе производит белок. Остальные же мРНК она для трансляции не использует. Авторы предложили и механизм «отсеивания».
Дело в том, что в мРНК есть не только области, кодирующие аминокислотную последовательность белка, но и области, имеющие чисто регуляторное назначение (рис. 4). С их помощью начинать синтезировать белок рибосома может по двум разным механизмам.
Первый носит название кэп-зависимого, или сканирующего. На одном из концов молекулы мРНК имеется специальная структура — кэп (молекула 7-метилгуанозина), на который перед началом синтеза садится рибосома. Сев, она движется вдоль молекулы мРНК, сканируя ее на предмет старт-кодона, кодирующего первую аминокислоту белка. Найдя старт-кодон, рибосома начинает синтез.
При втором механизме, кэп-независимом, характерном в основном для вирусов, рибосома садится на специальную область, называемую IRES (Internal Ribosomal Entry Site; в переводе с англ. — «сайт внутренней посадки рибосомы»), которая и направляет ее к старт-кодону.
Так вот, гипотеза рибосомного фильтра предполагала, что «фильтрование» происходит за счет специфического взаимодействия рибосомных белков и рРНК с определенными областями мРНК, которые могут запускать синтез белка по схожему с IRES принципу. Такие взаимодействия должны носить конкурирующий характер. Это значит, что мРНК, обладающие одинаковыми или схожими областями, будут соперничать за связывание с рибосомой, и эффективность их трансляции будет различна.
Способность клетки менять состав рибосом также имеет огромное значение для работы «фильтра». Добавление или утрата некоторых компонентов может приводить к пространственной недоступности областей рибосомы, взаимодействующих с мРНК, а значит, будет блокировать и синтез некоторых белков. Именно так, по мнению авторов гипотезы, могла меняться специфичность «фильтра».
Гипотеза рибосомного фильтра породила другую гипотезу — о специализации рибосом [19]. Специализация — следствие гетерогенности, то есть избирательность рибосом в отношении мРНК, которая приводит к синтезу только каких-то определенных белков, закодированных в «избранных» рибосомой молекулах мРНК. К сожалению, ввиду отсутствия приборов и методов, с помощью которых можно было бы экспериментально проверить описанные идеи, эти гипотезы так и оставались гипотезами некоторое время.
Гипотезы приобретают подтверждение
Несомненно, двадцать первый век — век высоких технологий, позволяющих человеку совершать то, что раньше казалось выдумкой ученых-фантастов. И молекулярные биологи активно пользуются результатами научно-технического прогресса в своих научных изысканиях. Благодаря интенсивному развитию техники, несколько лет назад сразу обе гипотезы нашли свое экспериментальное подтверждение [20]. С помощью самых современных технологий установили, что рибосомы модельного объекта — стволовой клетки эмбриона мыши, не обладающей таким сложным жизненным циклом, как клетки диктиостелиума или малярийного плазмодия, также гетерогенны, то есть отличаются друг от друга составом входящих в них белков. Получается, что и клетки млекопитающих содержат неодинаковые по составу рибосомы!
Дальше — больше. Оказалось, что в одной и той же клетке присутствует не одна гетерогенная популяция рибосом, как полагали ранее, а сразу несколько таких популяций! Они не сменяют друг друга, а сосуществуют одновременно. Было экспериментально доказано, что каждая из популяций преимущественно осуществляет трансляцию только определенного набора мРНК. Это означает, что рибосомы не универсальны, то есть не способны транслировать абсолютно любую молекулу мРНК, как считалось ранее. Отдельные группы рибосом взаимодействуют только с некоторыми мРНК и, следовательно, «отвечают» за синтез лишь части клеточных белков. Было доказано, что избирательность рибосом вызвана именно присутствием определенных рибосомных белков, которые, предположительно, связываются с некими регуляторными областями в мРНК. Но точный механизм этого процесса требует дальнейших исследований.
Итак, получается, что функции рибосомных белков более обширны, чем мы были склонны думать ранее! Благодаря изменениям состава рибосомы клетка может регулировать, какие гены будут «превращены» в белки, а какие нет, в соответствии с ее нуждами.
Что же дальше?
Пока рано говорить о том, куда приведут нас исследования гетерогенности рибосом. Несомненно, они позволят человечеству лучше понимать механизмы многих заболеваний, в том числе онкологических.
Например, уже выявлены заболевания, именуемые рибосомопатиями, причиной которых являются генетические мутации компонентов рибосом [21].
Анемия Даймонда—Блэкфана — типичный пример рибосомопатии, выявляется в течение первого года жизни ребенка. Это заболевание названо в честь врачей, впервые его описавших и классифицировавших в 30-е годы двадцатого века. Оно относится к числу редких, встречается в пяти случаях из миллиона, с одинаковой вероятностью и у мальчиков, и у девочек. Первичным симптомом болезни является повышенная бледность кожи ребенка, описаны случаи рождения детей с «заячьей губой». К возрасту шести месяцев могут появиться такие симптомы как увеличение размеров печени и селезенки, нарушения работы сердечно-сосудистой системы. Также происходит процесс торможения выработки эритроцитов в костном мозге, из-за чего наблюдаются бледность, вялость, быстрая утомляемость. При отсутствии лечения заболевание приводит к тяжелой сердечной недостаточности и смерти. Как оказалось, причиной, вызывающей анемию Даймона—Блэкфана, являются мутации в генах, кодирующих некоторые рибосомные белки, что приводит к неправильной работе рибосом, снижению их количества в клетках и, как следствие, негативным последствиям.
В заключение
История рибосомы, начавшаяся более шестидесяти лет назад, — яркий пример процесса научного поиска, который привел к изменению нашего взгляда на работу и функции рибосомы. Сейчас мы не можем сказать, чем закончится эта история, к каким результатам и открытиям она приведет.
В науке не бывает незначительных результатов. Мы, обыватели, привыкли, что ее достижения влияют на нашу жизнь, а, следовательно, должны быть масштабными и иметь непосредственное практическое применение. Например, открытие пенициллина — первого антибиотика — позволило спасти миллионы жизней и дало виток новому направлению исследований, до сих пор не утратившему актуальности. Масштаб и польза налицо. Однако нам следует помнить, что в области познания не бывает «больших» и «малых» достижений. Любой научный результат — это всегда движение вперед, это всегда большая победа, созданная огромным кропотливым трудом целой плеяды ученых. Так же и исследования рибосомы. Возможно, они станут еще одним штрихом, добавленным учеными к нашей картине мира, а возможно, приведут к колоссальному прорыву, например, в лечении онкологических заболеваний.
Источник: biomolecula.ru
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов [1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции» [2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
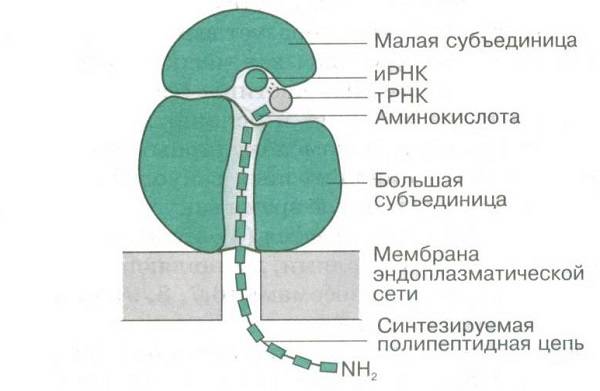
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона [9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Источник: dic.academic.ru