Рибосоми утворюються в
трансляція, тобто зчитування коду матричної (інфоромаційної) РНК і збирання поліпептиду. Шляхом введення мічених амінокислот виявлено, що в рибосомах відбувається синтез білків. Поліпептидні молекули білка синтезуються таким чином, що певні амінокислоти в рибосомі з’єднуються одна з одною у відповідній послідовності. Тому інформаційна РНК, яка у вигляді кодонів (триплетів), кодує порядок розміщення амінокислот, повинна переміщатися по рибосомі по мірі приєднання чергової амінокислоти до попередньої. Чим більше рибосом містить полісома, тим більше молекул поліпептидів буде синтезуватися на ній одночасно. На малій субодиниці рибосоми в місці її контакту з великою знаходиться іРНК-зв’язуюча ділянка, а також ділянка, яка утримує аміноацил-тРНК. Між двома ділянками рибосоми знаходиться центр, який каталізує утворення пептидних зв’язків.
Важливу роль в синтезі білка відіграє транспортна РНК (синоніми: тРНК, розчинна РНК, або РНК-переносник), функція якої полягає в тому, щоби з фонду амінокислот, утворених клітиною, вибрати “потрібну” і разом з нею направитися до рибосоми.
анспортна РНК має вигляд листочка (рис. 2.20), черешок якого у кожній тРНК має такий же самий триплет нуклеотидів —ЦЦА. Ця ділянка служить для прикріплення амінокислоти, утворення аміноацил-тРНК. Друга ділянка “пізнає” “свою” амінокислоту, яка і прикріплюється до першої ділянки тРНК. Третя ділянка — це антикодон (триплет нуклеотидів), за допомогою якого тРНК, навантажена амінокислотою, поміщає її на відповідне місце — кодон в іРНК, спарюючись з ним, за принципом комплементарності. Четверта ділянка тРНК пізнає рибосому на іРНК і прикріпляється до неї.
Синтез білка на рибосомах починається з прикріплення рибосоми (її малої субодиниці) до певної ділянки іРНК. Дальше в рибосому вступає тРНК з амінокислотою (аміноацил-тРНК) і своїм антикодоном (триплетом нуклеодитів) контактує з комплементарним йому кодоном на іРНК. Тоді тРНК від’єднується і рибосома разом з амінокислотою переміщується на наступну позицію (рух іРНК і рибосоми є зустрічним). У рибосомі до попередньої амінокислоти приєднується наступна в складі аміноацил-тРНК шляхом утворення пептидного зв’язку. На кожному етапі відбувається приєднання до рибосоми аміноацил-тРНК знову ж таки за принципом комплементарності — антикодон тРНК до відповідного кодону іРНК. Як тільки амінокислоти з’єднуються між собою, тРНК відпадає. І так процес синтезу білкового ланцюжка продовжується і завершується звільненням оліго- чи поліпептиду від рибосоми. Рибосома, яка закінчила збирання пептидного ланцюжка дисоціює (роз’єднується) на субодиниці і може знов приєднуватися на звільнене місце в іРНК.
Вважають, що розміщені вільно в гіалоплазмі полісоми синтезують білок для потреб самої клітини. Прикріплені до мембран гранулярної ендоплазматичної сітки полісоми синтезують білок на експорт для екзоцитозу, тобто виведення його за межі клітини (клітина печінки синтезує білки плазми крові, В-лімфоцити і плазмоцити — g-глобуліни). При рості молодих клітин кількість рибосом збільшується. У процесі метаболізму білки цитоплазми постійно обновлюються, синтезуючись на полісомах. Рибосоми здійснюють також синтез спеціальних білків, таких як гемоглобін у попередників еритроцитів.
Утворення рибосом.
Рибосоми в еукаріот синтезуються в ядерці. Матрицею для рРНК є ділянки ДНК. Виділяють декілька етапів утворення рибосом з відповідними назвами: (1) еосоми (з грец— рання зірка, початок) утворюються на початковому етапі, коли в ядерці на ДНК синтезується лише рРНК; (2) неосоми (з грец. новий) — це комплекси рРНК-білок, які піддаються кількаступеневій процедурі дозрівання і як готові субодиниці потрапляють у цитоплазму і там за участю Mg2+ на іРНК з’єднуються в (3) рибосоми. Нанизуючись на нитку іРНК, утворюють полірибосоми (полісоми). У прокаріот рибосоми утворюються в цитоплазмі внаслідок простої агрегації компонентів.
Таким чином, формування полісом відбувається за участю іРНК, яка синтезується в ядрі на еухроматинових ділянках хромосом і через порові комплекси потрапляє в цитоплазму. На ній і нанизуються рибосоми з участю іонів магнію. Так формуються комплекси, які синтезують білок.
Будова
Під електронним мікроскопом у ядерці виділяють кілька субкомпартментів. Так звані фібрилярні центри оточені ділянками щільного фібрилярного компонента, де і відбувається синтез рРНК. Зовні від щільного фібрилярного компонента розташований гранулярний компонент, що представляє собою скупчення дозріваючих рибосомних субчастинок. Ядерце знаходиться всередині ядра клітини, і не має власної мембранної оболонки, однак добре помітно під світловим і електронним мікроскопом.
У ядрах різних клітин, а також і в ядрі однієї і тієї ж клітини в різні моменти її життєдіяльності кількість ядерець, їх форма і розміри можуть бути різними. Часто в ядрах міститься лише 1-2 ядерця, але їх може бути 5-7 і більше.
Источник: studopedia.su
Строение
Важнейшей органеллой клетки является ядро. Оно содержит генетическую информацию и ядрышко, где образуются рибосомы. Синтезированные рибосомы через поры ядерной мембраны попадают либо на эндоплазматическую сеть, либо в цитоплазму. В зависимости от расположения в эукариотической клетке выделяют два вида рибосом:
- связанные – располагаются на эндоплазматической сети (шероховатый вид);
- свободные – располагаются в цитозоле.
Гладкая ЭПС образуется после освобождения от рибосом. В растительных клетках гладкая ЭПС формирует провакуоли, из которых затем образуются вакуоли.

Рис. 1. Расположение рибосом в клетке.
Рибосомы – немембранные органеллы, имеющие округлую форму и состоящие из двух частей – субъединиц (большой и малой), каждая из которых представляет собой смесь рибосомальной РНК (рРНК) и белков. С химической точки зрения рибосома – нуклеопротеид, состоящий из нуклеиновых кислот и протеинов.

Рис. 2. Строение рибосом.
Различают четыре разновидности молекул РНК рибосомы:
- 18S-РНК – содержит 1900 нуклеотидов;
- 5S-РНК – содержит 120 нуклеотидов;
- 5,8S-РНК – состоит из 160 нуклеотидов;
- 28S-РНК – состоит из 4800 нуклеотидов.
Малая частица рибосомы образована 30-35 белками и 18S-РНК. В большую субчастицу входит 45-50 белков и 5S-, 5,8S-, 28S-РНК.
В нерабочем состоянии части рибосом разъединены. Они соединяются с помощью информационной (матричной) РНК, обхватывая её с двух сторон. При синтезе белка рибосомы объединяются, образуя комплексы – полисомы или полирибосомы, связанные мРНК и напоминающие бусины на нитке.
Синтез белка
Главная функция рРНК – синтез белка и аминокислот.
Биосинтез белков включает два процесса:
- транскрипцию;
- трансляцию.
Транскрипция происходит с участием ДНК. Генетическую информацию считывает фермент РНК-полимераза, образуя мРНК. Далее начинается процесс трансляции, происходящий на рибосомах.
Этот процесс разделяется на три этапа:
- инициацию – начало синтеза;
- элонгацию – биосинтез;
- терминацию – завершение синтеза, отделение рибосомы.
При инициации происходит сборка рибосомы. Контактные части субъединиц называются активными центрами, между которыми располагается:
- мРНК в качестве «шаблона» синтеза;
- тРНК, осуществляющая перенос аминокислот на синтезируемую цепь;
- синтезируемый пептид, состоящий из аминокислот.
В процессе элонгации происходит удлинение полипептидной цепи за счёт присоединения аминокислот. Цепь отсоединяется от рибосомы на стадии терминации благодаря стоп-кодону – единицы генетического кода, шифрующего прекращение синтеза белка.

Рис. 3. Общая схема синтеза белка на рибосоме.
Биосинтез требует энергетических затрат. При присоединении одной аминокислоты расходуется по две молекулы АТФ (аденозинтрифосфата) и ГТФ (гуанозинтрифосфата). Кроме того, ГТФ тратится на процессы инициации и терминации.
Источник: obrazovaka.ru
1. Історія досліджень рибосоми
Рибосоми вперше були описані як ущільнені частки, або гранули, клітинним біологом румунського походження Джорджем Паладе в середині 1950-х років [1]. У 1974 р. Паладе, Клод і Крістіан Де Дюв отримали Нобелівську премію з фізіології і медицині «за відкриття, що стосуються структурної і функціональної організації клітини». Термін «рибосома» був запропонований Річардом Робертсом в 1958 замість «рібонуклеобелковая частка мікросомальної фракції» [2]. Біохімічні і мутаційні дослідження рибосоми починаючи з 1960-х дозволили описати багато функціональні та структурні особливості рибосоми.
На початку 2000-х з’явилися атомні структури окремих субодиниць, а також повної рибосоми, пов’язаної з різними субстратами, які дозволили зрозуміти механізм декодінг (розпізнавання антикодону тРНК, комплементарного кодону мРНК) і деталі взаємодій між рибосомою, антибіотиками, тРНК і мРНК.
Нобелівська премія з хімії 2009 року отримано за визначення структури прокаріотичної рибосоми вченим з Великобританії Венкатраману Рамакрішнану, американцем Томасом Стейцем і ізраїльтянкою Адою Йонат. У 2010 році в лабораторії Марата Юсупова була визначена тривимірна структура еукаріотичної рибосоми. [3]
У 2009 році канадські біохіміки Костянтин Боков і Сергій Штейнберг з Монреальського університету, дослідивши тривимірну структуру Хвороби сучасних бактерій E.coli, прийшли до висновку, що рибосоми могли сформуватися в результаті поступової еволюції з дуже простої маленької молекули РНК — «проторібосоми», здатної каталізувати реакцію з’єднання двох амінокислот. Всі інші структурні блоки рибосоми послідовно додавалися до проторібосоме, не порушуючи її структуру і поступово підвищуючи ефективність її роботи. [4]
2. Механізм трансляції
Трансляція — синтез білка рибосомою на основі інформації, записаної в матричної РНК ( мРНК). мРНК зв’язується з малою субодиницею рибосоми, коли відбувається впізнавання 3′-кінцем 16S Хвороби комплементарної послідовності Шайн-Далгарно, розташованої на 5′-кінці мРНК (у прокаріот), а також позиціонування стартового кодону (як правило, AUG) мРНК на малій субодиниці.
еукаріотів мала субчастіца рибосоми зв’язується також з допомогою кепа, на кінці мРНК. Асоціація малої і великої субодиниць відбувається при зв’язуванні формілметіоніл- тРНК (fMET-тРНК) та участі факторів ініціації (IF1, IF2 і IF3 у прокаріотів, їх аналоги і додаткові фактори беруть участь в ініціації трансляції у еукаріотичних рибосом). Таким чином, розпізнавання антикодону (в тРНК) відбувається на малій субодиниці.
Після асоціації, fMET- тРНК знаходиться в P-(peptidyl-) сайті каталітичного (пептидил-трансферазной) центру рибосоми. Наступна тРНК, що несе на 3′-кінці амінокислоту і комплементарна друга кодону на мРНК, міститься за допомогою фактора EF-Tu в А-(aminoacyl-) сайт каталітичного центру рибосоми. Потім, утворюється пептидний зв’язок між формилметионин (пов’язаним з тРНК, що знаходиться в Р-сайті) та амінокислотою, принесеної тРНК, що знаходиться в А-сайті. Механізм каталізу освіти пептидной зв’язку в пептидил-трансферазной центрі до цих пір повністю не ясний. На даний момент існує кілька гіпотез, що пояснюють деталі цього процесу: 1. Оптимальне позиціонування субстратів (induced fit) [5], 2. Виключення з активного центру води, здатної перервати освіту пептидного ланцюга за допомогою гідролізу [6], 3. Участь нуклеотидів рРНК (таких як А2450 і А2451) в перенесенні протона [7] [8], 4. Участь 2′-гідроксильної групи 3′-кінцевого нуклеотиду тРНК (А76) в перенесенні протона [9];. Висока ефективність каталізу досягається взаємодією цих факторів.
Після утворення пептидного зв’язку, поліпептид виявляється пов’язаним з тРНК, що знаходиться в А-сайті. На наступному етапі деацілірованная тРНК рухається з Р-сайту в Е-сайт (exit-), а пептидил-тРНК з А-в Р-сайт. Цей процес називається транслокацією і відбувається за участю фактора EF-G. тРНК, комплементарна наступного кодону мРНК, зв’язується з А-центром рибосоми, що веде до повторення описаних кроків. Стоп- кодони (UGA, UAG і UAA) сигналізують про закінчення трансляції. Процес закінчення трансляції та звільнення готового поліпетіда, рибосоми і мРНК, називається термінації. У прокаріотів він відбувається за участю факторів термінації RF1, RF2, RF3 і RRF.
Источник: znaimo.com.ua
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов [1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции» [2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона [9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Источник: dic.academic.ru
Рибосомами називаютьсферичні чи грибоподібні, дуже дрібні органели діаметром близько 22 нм. Вони були вперше описані і 1953 році американським біологом Д.Е.Паладе, який довів, що рибосоми являють собою нуклеопротеїди.
Кожна рибосома складається з двох субодиниць – великої і малої. Для характеристики рибосом використовують їхню властивість, як і всяких часток і молекул, осаджуватися з постійною швидкістю під дією відцентрової сили при диференційованому центрифугуванні. Досліди по седиментації виявили існування двох головних типів рибосом, що були названі 70S і 80S – рибосомами. Перший тип являється у прокаріот, а більші 80 S –рибосомами – в еукаріотичних клітинах (ри.с.1.16).

Рис. 1.16. Порівняння структур прокаріотичних і еукаріотичних рибосом. Незважаючи на розходження в структурі, ці рибосоми дуже подібні у функціональному відношенні.
Рибосоми з константою седиментації 70 S поділяють на субодиниці 50S і 30S, а 80S – рибосоми — на субодиниці 60S і 40S. Розпад на субодиниці відбувається при зниженні в середовищі концентрації двовалентних іонів металів (Mg, Ca, Co, Mn). Цей процес зворотний : при відновленні концентрації іонів субодиниці об’єднуються, утворюючи нативні рибосоми. Рибосоми складаються з приблизно рівних за масою кількістю РНК і білка, тобто являють собою рибонуклеопротеїнові частки. РНК, що входить до їх складу, називається рибосомною РНК
(рРНК) і синтезується в ядерці.
У клітинах вищих рослин рибосоми звичайно зв’язані з мембранами гранулярної ендоплазматичної сутки, розташовуючись безладно лінійно, а іноді у вигляді розеток чи спіралей на їх зовнішній поверхні. У різних рослинних клітинах число рибосом коливається від декількох тисяч до декількох десятків тисяч одиниць. Їх концентрація у клітинах і тканинах може змінюватися у процесі онтогенезу і залежить від живлення, водного режиму, температури й інших умов, а також функціональної активності клітини.
Установлено, що на рибосомах відбувається біосинтез білка, тобто зв’язування активованих амінокислот і укладення їх у поліпептидний ланцюг відповідно до генетичної інформації, отриманої з ядра через інформаційну РНК. На поверхні іРНК відбувається взаємодія між комплексами « амінокислота – транспортна РНК» і самою рибосомою. З рибосомами одночасно можуть з’єднуватися тільки два комплекси і замикається тільки один пектиновий зв’язок. Потім рибосома переміщується по іРНК, до неї підходить наступний комплекс «амінокислота – тРНК» і замикається новий пептидний зв’язок. Так продовжується до закінчення синтезу поліпептидного ланцюга. Цей процес називається трансляцією
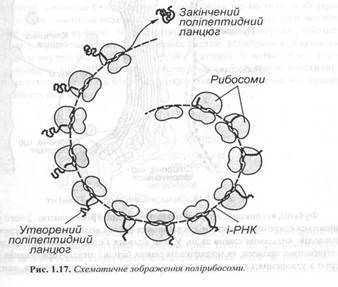
. Рибосоми діють в основному не ізольовано, а спільно й упорядковано. Угрупування рибосом, що транслює іРНК і синтезує той самий білок, одержало назву полісоми
. В одній полісомі може знаходитися від 5 до 70 рибосом. На ЕПС полісоми виявляються у вигляді характерних завитків (рис.1.17).

Подібні статті
Сезонні зміни в житті безхвостих, пов’язані з особливостями їх біології (жаби, ропухи)
Поведінка земноводних нескладна, що відповідає організації центральної нервової системи. Частина безхвостих здатна до швидких, але одноманітним рухам; у воді більшість видів більш рухливі, чим на суші. Основа поведінки земноводних — порівн …
Історія розвитку анатомії як науки
В історії розвитку анатомії, як і ветеринарної медицини, розрізняють три періоди: перший — анатомія давніх часів: з найдавніших часів до занепаду Західної Римської імперії (476 р); другий — історія анатомії середніх віків: з часів занепаду …
Источник: www.grandbiology.com