Фагоцитарную функцию выполняют
а, в, г
б, в, г
в, г, д
а, г, д
б, г, д
Незавершенный фагоцитоз включает в себя все стадии, кроме?
адгезии
хемотаксиса
поглощения
переваривания
Интерфероны: 1) являются иммуноглобулиновыми молекулами; 2) вырабатываются специализированными клетками; 3)активируют фагоцитарные клетки; 4) лизируют клеткимишени; 5) усиливают активность цитотоксических Тлимфоцитов. Выберите правильную комбинацию ответов?
б, в, д
а, б, в
а, г, д
в, г, д
б, г, д
Свойства полноценных антигенов?
чужеродность
высокий молекулярный вес
низкий молекулярный вес
специфичность
отсутствие детерминантных групп
Какие морфологические структуры бактерий несут признаки антигенной чужеродности?
жгутики
капсула
клеточная стенка
ЦПМ
генофор (нуклеоид)
лизосомы
Антитела класса IgЕ вырабатывают?
базофилы
плазматические клетки
Тлимфоциты
тимоциты
тучные клетки
Клеточный иммунитет – это: 1) количество Т, Влимфоцитов, естественных киллеров; 2) индукция цитотоксических CD8 Тлимфоцитов; 3) фагоцитарная реакция; 4) антителообразование; 5) отторжение чужеродного трансплантата. Выберите правильную комбинацию ответов?
а, б
б, в
б, д
в, г
а, д
Что означает термин «инфекционный иммунитет» («инфекционная невосприимчивость»)?
не восприимчивость к инфекционным агентам вообще
иммунитет, приобретённый в результате введения готовых АТ против какоголибо возбудителя
иммунитет, приобретённый в результате введения Аг какоголибо возбудителя
иммунитет к повторному заражению, обусловленный наличием этого же возбудителя в организме
иммунитет, развившийся в результате передачи АТ к инфекционным агентам от матери плоду
иммунитет, развившийся в результате выздоровления после инфекционной болезни
Приобретенный иммунитет?
развивается в результате изменения генотипа
возникает при искусственной иммунизации
передается трансплацентарно;
создается пассивно
является индивидуальным
Антитоксический иммунитет возникает при?
введении эндотоксина
иммунизации анатоксином
иммунизации любым белком
введением антитоксической сыворотки
применением антимикробной сыворотки
К центральным органам иммунной системы человека относятся?
селезенка
щитовидная железа
лимфатические узлы
костный мозг
миндалины.
Антитела вырабатываются?
Тхелперами
Вклетками
эпителиальными клетками
плазматическими клетками
клетками селезенки.
ОТВЕТЫ К ЗАДАЧАМ
АЭРОГЕННЫЕ ИНФЕКЦИИ
К задаче 1.
1. Менингококковая инфекция, генерализованная смешанная тяжелая форма — менингококцемия, менингит.
2. Диференцировать нужно с сыпным тифом и явлениями менингизма, свойственными в детском возрасте. Но из объективного осмотра и данных анамнеза следует исключить возможное осложненное течение кори, заболевание развилось остро и на фоне гнойного ринита, сопровождалось рвотой и наличием менингиальных симптомов. Явления менингизма тоже следует исключить, т.к. они возможны на фоне выраженной интоксикации при многих вирусных и бактериальных инфекциях, но им не свойственна восходящего характера обильная геморрагическая сыпь.
3. Девочка срочно госпитализирована в инфекционную больницу в отделение интенсивной терапии, где ей проведут люмбальную пункцию. Ликвор и кровь на гемокультуру в теплом виде должны быть доставлены в баклабораторию. Кровь на свертываемость, время кровотечения, коагулограмму. Общеклинические анализы. Контроль диуреза.
4. При сочетании менингококцемии с менингитом назначают только бактериостатические препараты во избежание развития инфекционно-токсического шока — хлорамфеникол 1 г в/в каждые 6 ч (детям 75–100 мг/кг каждые 6 ч) или цефтриаксон 2 г в/в каждые 12 ч (детям 80–100 мг/кг каждые 12–24 ч) При тяжёлых нарушениях — гормональная терапия (дексаметазон по 0,15 мг/кг каждые 6 ч). Противошоковая терапия. Дезинтоксикационная терапия. Препараты, улучшающие реологические свойства крови (реополиглюкин, гепарин).
5. Противоэпидемические мероприятия. Осмотр контактных, обследование на менингококконосительство и при положительных результатах, проведение санации.
К задаче 2
1. Менингококковая инфекция генерализованная смешанная форма. Менингококкемия Менингококковый менингит. Крайне тяжелая форма, молниеносное течение.
2. Транспортировка в отделение интенсивной терапии (на носилках или на каталке) инфекционной больницы. Бензилпенициллин вводится из расчета 200 тыс ЕД на кг массы тела в сутки, в первые дни вводится 6-кратно с интервалом 4 часа, часть в/в, а часть в/м. Обязательна дезинтоксикационная (р-ры глюкозы или физраствора) терапия с введением препаратов, улучшающих проникновение бензилпенициллина через гематоэнцефалический барьер (кофеинбензоат натрия в разовой дозе — 4-5 мг/кг). Препараты, улучшающие реологические свойства крови (реополиглюкин), лечение ДВС-синдрома (гепарин, преднизолон и др. в зависимости от стадии ДВС).
3. Дифференциальный диагноз: с серозными менингитами, менингоэцефалитами, туберкулезным менингитом, субарахноидальным кровоизлиянием, объемными процессами головного мозга, лейкозами, геморрагическим васкулитом, геморрагическими лихорадками.
4. До введения антибиотиков срочно мазки из ротоносоглотки на менингококк, посев крови на менингококк (гемокультура), должна быть произведена люмбальная пункция, как с диагностической, так и с лечебной целью. Кровь на свертываемость, время кровотечения, коагулограмму. Общеклинические анализы.
5. Противоэпидемические мероприятия. Осмотр контактных по месту жительства и работы, обследование на менингококконосительство и при положительных результатах провести санацию.
К задаче 3
1. Менингококковая инфекция генерализованная смешанная форма. Менингококкемия Менингококковый менингит. Тяжелая форма, молниеносное течение.
2. Дифференциальный диагноз: с серозными менингитами, менингоэцефалитами, туберкулезным менингитом, субарахноидальным кровоизлиянием, объемными процессами головного мозга, лейкозами, геморрагическим васкулитом, геморрагическими лихорадками.
3. До введения антибиотиков срочно мазки из ротоносоглотки на менингококк, посев крови на менингококк (гемокультура), должна быть произведена люмбальная пункция, как с диагностической, так и с лечебной целью. Кровь на свертываемость, время кровотечения, коагулограмму. Общеклинические анализы.
4. Транспортировка в отделение интенсивной терапии (на носилках или на каталке) инфекционной больницы. Бензилпенициллин вводится из расчета 200 тыс ЕД на кг массы тела в сутки, в первые дни вводится 6-кратно с интервалом 4 часа, часть в/в, а часть в/м. Обязательна дезинтоксикационная (р-ры глюкозы или физраствора) терапия с введением препаратов, улучшающих проникновение бензилпенициллина через гематоэнцефалический барьер (кофеинбензоат натрия в разовой дозе — 4-5 мг/кг),
5. Противоэпидемические мероприятия. Осмотр контактных по месту жительства и работы, обследование на менингококконосительство и при положительных результатах провести санацию.
К задаче 4
1. Менингококковая инфекция тяжелая генерализованная форма. Менингококкемия, осложнение: инфекционно-токсический шок II ст.
2. Дифференциальный диагноз необходимо проводить с крайне тяжелой формой гриппа, осложненным геморрагическим синдромом и ИТШ; эндемичными для данной местности геморрагическими лихорадками, лептоспирозом, первичным сепсисом, ст. септицемии.
3. Тактика ведения больной: госпитализация в реанимационное отделение или палату интенсивной терапии в зависимости от оснащенности ЛПУ. Бензилпенициллин вводится из расчета 200 тыс ЕД на кг массы тела в сутки, в первые дни вводится 6-кратно с интервалом 4 часа, часть в/в, а часть в/м. Обязательна дезинтоксикационная (р-ры глюкозы или физраствора) терапия с введением препаратов, улучшающих проникновение бензилпенициллина через гематоэнцефалический барьер (кофеинбензоат натрия в разовой дозе – 4-5 мг/кг), а также введение лазикса; патогенетические средства по выраженности патологических синдромов (препараты для лечения ДВС в зависимости от его стадии по данным исследования).
4. Объем исследований. До введения антибиотиков срочно мазки из ротоносоглотки на менингококк, посев крови на менингококк (гемокультура). Кровь на свертываемость, время кровотечения, коагулограмму. Общеклинические анализы.
5. Объем противоэпидемических мероприятий. Так как больная проживает в общежитие, необходимо осмотреть всех ребят, провести термометрию, обследовать на менингококконосительство и при положительных результатах провести санацию.
К задаче 5.
1. Учитывая бурное начало заболевания, распространение геморрагической сыпи с некрозами и преимущественной локализацией на ногах, выраженных менингеальных симптомов на второй день заболевания, отсутствия характерного для сыпного тифа гепатолиенального синдрома, а также с учетом эпидемического сезона, контакта с больным ОРЗ, необходимо поставить диагноз: Менингококковая инфекция, тяжелая генерализованная смешанная форма — менингококкемия, менингококковый менингит.
2. Транспортировка в отделение интенсивной терапии (на носилках или на каталке), до введения антибиотиков срочно мазки из ротоносоглотки на менингококк, посев крови на менингококк (гемокультура), должна быть произведена люмбальная пункция, как с диагностической, так и с лечебной целью.
3. Нет оснований думать о сыпном тифе: слишком бурно развилось заболевание, головная боль сопровождающаяся рвотой, раннее появление геморрагической сыпи с некрозами уже на 2-й день заболевания с преимущественной локализацией на нижних конечностях, нарушение сознания в начале заболевания не характерно для сыпного тифа.
4. Рано начатая антибиотикотерапия спасет жизнь больного! Препаратами выбора прошлых лет при эпидвспышках менингококковой инфекции были препараты бензилпенициллина и левомецитина в массивных дозах, в 3-4 раза превышающих обычные терапевтические дозы этих препаратов. Бензилпенициллин вводится из расчета 200 тыс ЕД на кг массы тела в сутки, в первые дни вводится 6-кратно с интервалом 4 часа, часть в/в, а часть в/м. Обязательна дезинтоксикационная (р-ры глюкозы или физраствора) терапия с введением препаратов, улучшающих проникновение бензилпенициллина через гематоэнцефалический барьер (кофеинбензоат натрия в разовой дозе — 4-5 мг/кг), а также введение лазикса; патогенетические средства по выраженности патологических синдромов.
5. С учетом того, что больной проживает в общежитие, необходимо осмотреть всех ребят на педикулез, провести термометрию, обследовать на менингококконосительство и при положительных результатах провести санацию.
К задаче 6
1. На основании: острого начала заболевания, резкого повышения температуры, головной боли в лобной и височной областях, развившегося в первые сутки заболевания трахеита (кашель и боль за грудиной) и фарингита (покраснение и зернистость слизистых мягкого неба и задней стенки глотки), относительной брадикардии, небольшой гипотонии, контакта с лихорадящей больной — можно поставить диагноз: грипп, острое течение, тяжелая форма.
2. Данных за сыпной тиф нет, однако, необходимо помнить, что у лиц пожилого возраста, перенесших в прошлом сыпной тиф, может возникнуть рецидив сыпного тифа (болезнь Бриля) на фоне переносимой вирусной инфекции.
3. Исследование на грипп — кровь на парные сыворотки с интервалом 5 дней, смывы из носа и зева на «экспресс-диагностику» с помощью флюоресцирующих антител. В план обследования надо включить серологические реакции (РСК и РНГА с риккетсиозным диагностикумом);
4.Этиотропные (противогриппозные) препараты, дезинтоксикационная (реополикглюкин, реглюман, глюкоза 5%), патогенетическая и симптоматическая терапия.
5. Противоэпидемические мероприятия: госпитализация в бокс инфекционного отделения интенсивной терапии. Дома — заключительная дизенфекция.
К задаче 7
1. Распространенная дифтерия зева, тяжелая форма, с переходом в токсическую форма II ст. — поставлен на основании характерных для дифтерии клинических данных общих (на фоне субфебрильной t° тяжелое состояние, затрудненное поверхностное учащенное дыхание, малоподвижный, бледный с отеком шеи с обеих сторон до ключицы); местных выраженных изменений на слизистой ротоглотки (отечности миндалин и слизистых, наличия распространенного бугристого трудно отделяемого налета серого цвета).
2. Дифференциальный диагноз необходимо провести с заболеваниями, протекающими с синдромом тонзиллита: с перитонзиллитом (перитонзиллярным абсцессом), инфекционным мононуклеозом, аденовирусной инфекцией, ангинозной формой туляремии, лейкозами и др.
3. План обследования: общий анализ крови, мочи, мазок на BL, ЭКГ, определение уровня содержания антитоксина в крови, РПГА – титр антимикробных тел, РСК с аденовирусным антигеном,
4. План лечения. Постельный режим до15-20 суток, введение противодифтерийной сыворотки от 80 000 до 120 000 МЕ с интервалом 12 часов до снижения клинических симптомов (уменьшения налетов и отека), далее дозу уменьшают практически в 2 раза. Дезинтоксикационная терапия, этиотропная (бензилпенициллин по 2 000 000 млн через 4 часа). Назначается гипербарическая оксигенация по 40-60 мин. в день.
5. Профилактика. Наблюдение за контактными – осмотр, термометрия, обследование на дифтерию, вакцинация не привитых, санация выявленных носителей токсигенных коринебактерий.
К задаче 8
1. Острый орнитоз, типичная (пневмоническая) форма, средней степени тяжести.
2. Лабораторные методы: общий анализ крови, мочи, РСК с орнитозным антигеном, иногда используют ПЦР. Аллергологические методы: внутрикожная проба с антигеном. Инструментальные методы: ЭКГ, рентгенография органов грудной клетки.
3. Проводится с гриппом и другими острыми респираторными заболеваниями, пневмониями различной этиологии, Ку-лихорадкой, микоплазмозом, инфекционным мононуклеозом, бруцеллезом.
4. Этиотропное: антибиотики тетрациклинового ряда в течении 7 дней во время лихорадочного периода. Дезинтоксикационная терапия: кристаллоидные и коллоидные растворы. Патогенетическая терапия: оксигенотерапия, бронхолитики. Иногда ГКС. Лечение осложнений симптоматическое.
5. Профилактика: санитарно-ветеринарные мероприятия в местах, где имеются птицы и ограничение контакта с ними. Специфической профилактики нет.
К задаче 9
1. Диагноз грипп, острое течение, тяжелая форма — поставлен на основании: острого начала заболевания, резкого повышения температуры, головной боли в лобной и височной областях, развившегося в первые сутки заболевания трахеита (кашель и боль за грудиной) и фарингита (покраснение и зернистость слизистых мягкого неба и задней стенки глотки), относительной брадикардии, небольшой гипотонии, контакта с лихорадящим больным.
2. Госпитализации больного обязательна из-за тяжести развившегося заболевания.
3. Исследование на грипп — кровь на парные сыворотки с интервалом 5 дней, смывы из носа и зева на «экспресс-диагностику» с помощью флюоресцирующих антител.
4.Этиотропные (противогриппозные) препараты, дезинтоксикационная (реополикглюкин, реглюман, глюкоза 5%), патогенетическая и симптоматическая терапия.
5. Противоэпидемические мероприятия: госпитализация в бокс инфекционного отделения интенсивной терапии. Дома — заключительная дизенфекция.
К задаче 10
1. Предварительный диагноз. Внебольничная правосторонняя очаговая бронхопневмония.
2. Данное заболевание скорее всего вирусной этиологии, так как после перенесенного ОРЗ, леченного самостоятельно, отмечались признаки интоксикации (общая слабость, снижение работоспособности при незначительной физической нагрузке, потливость), длительно сухой кашель, волнообразность лихорадки и характерные физикальные признаки (укорочение перкуторного звука, усиление голосового дрожания, ослабление дыхания, справа).
3. План обследования: рентгенография органов грудной клетки, исследование мокроты (бактериологическое и вирусологическое). Общеклинические анализы в динамики, ЭКГ.
4. Лечение. Противовирусные препараты, разжижающие мокроту, антигистаминные, введение преднизолона.
КИШЕЧНЫЕ ИНФЕКЦИИ
К задаче 1
1.Брюшной тиф, тяжелая гриппоподобная форма (из крови и кала выделена палочка Эберта — S. Typhi, лейкопения, анэозинофилия).
2 Тяжесть заболевания обусловлена отсутствием селезенки.Обычно гриппоподобная форма брюшного тифа протекает доброкачественно, лихорадочный период не превышает 9дней.
3. Необходимо провести исследования на вирусы гриппа (мазки из носа и зева, кровь на парные сыворотки). Перед выпиской дуоденальное зондирование с посевом желчи (биликультура), чтобы исключить носительство.
4.Необходимо дифференцировать с аденовирусной инфекцией, гриппом, паратифами, малярией.
5. Противоэпидемические мероприятия. Обследование членов семьи и других контактных на брюшной тиф.
К задаче 2
1. У приведенного больного пневмонический симптомокомплекс сочетался с постоянной высокой температурой, но длительная высокая температура, постоянно сохранявшаяся относительная брадикардия и лейкопения с нейтрофильным сдвигом, отсутствие эозинофилов в гемограмме – должны были направить врача на исследование крови на брюшной тиф, сепсис, тем более, что эффекта от проводимой терапии не было.
2. Диагноз: брюшной тиф, тяжелая редкая форма пневмотифа, осложненная кишечным кровотечением. Данная форма встречается крайне редко у 6,2% больных. Неправильный подбор антибиотиков (группа пенициллинового ряда) усугубил тяжесть заболевания, а патоморфологический процесс в кишечнике проявился кровотечением.
3. Диагноз был подтвержден высевом палочки Эберта из крови больного, необходимо обследовать мокроту на S. Typhi , а если развивается плеврит, то плевральную жидкость.
4. Необходимо дифференцировать с сепсисом (кровь на стерильность), малярией (кровь на мазок и толстую каплю).
5. Скорее всего сформируется носительство, наблюдение у врача кабинета инфекционных заболеваний – 3 месяца с ежемесячным обследованием кала и мочи на S. Typhi (урино- и копрокультура), в конце 3-его месяца дуоденальное зондирование с посевом желчи (биликультура). По истечению 3-х месяцев пациент передается под наблюдение в эпидотдел роспотребнадзора.
К задаче 3
1. Клинический диагноз: брюшной тиф, тяжелая форма, инфекционно-токсический шок, атипичное течение, менинготиф. Диагноз подтвержден лабораторными данными: положительная гемокультура, рост S. Typhi при посеве ликвора, резко положительная реакция Видаля 1:800, анэозинофилия.
2. Тяжесть заболевания обусловлена атипичным течением с укороченным инкубационным периодом (больной из очага брюшного тифа), укороченным продромальным периодом, развитием выраженного тифозного статуса на 6 день заболевания, температурных «врезов» с развитием тяжелого неврологического синдрома, характерного для менингита.
3. Перед выпиской провести исследование посева мочи (уринокультура), кала (копрокультура), желчи (биликультура), люмбальная пункция с посевом ликвора, ЭЭГ, консультация невропатолога, после выписки наблюдение невропатолога и инфекциониста.
4. Дифференцировать необходимо с паратифами, энтеровирусными инфекциями, вирусными и бактериальными менингитами.
5. Противоэпидемические мероприятия. Обследование членов семьи и других контактных на брюшной тиф. После выписки наблюдение у врача кабинета инфекционных заболеваний – 3 месяца с ежемесячным обследованием кала и мочи на S. Typhi (урино- и копрокультура), в конце 3-его месяца дуоденальное зондирование с посевом желчи (биликультура).
К задаче 4
1. Острая дизентерия средней степени тяжести, микст-инфекция при сочетанном течении брюшного тифа с паратифом В, энтероколитическая форма (выраженное длительное поражение желудочно-кишечного тракта).
2. Диагноз подтвержден явлениями катарального колита при ректороманоскопии, что характерно для дизентерии; одновременный рост в копрокультуре возбудителей паратифа В и брюшного тифа, положительные реакции Видаля с диагностикумами брюшного тифа 1:400 и с паратифом В — 1:400.
3. К лечению необходимо дополнить левомицетин (хлорамфеникол), антибиотик к которому чувствительны салмонеллы. Диета – стол №2, режим постельный до 10-го дня нормальной tº, патогенетическая терапия, дезинтоксикационная (в данном случае возможно per os), прием энтеросорбентов через 2 часа после еды, пре- и пробиотиков, витаминотерапия.
4. Диф.диагноз: амебиаз, неспецифический язвенный колит, кишечный иерсиниоз.
5. Обследование членов семьи и других контактных на брюшной тиф, паратифы, шигеллезы.
К задаче 5
1. Клинический диагноз: паратиф В, острое течение, тяжелая форма, осложненная кишечным кровотечением, перфоративным перитонитом, межпетлевым абсцессом.
Быстрое нарастание интоксикации, появление сыпи на 4 день заболевания, типичные изменения языка, увеличение печени и селезенки, усиление болей в животе с локализацией внизу справа – говорят о развитие патологических изменений в кишечнике, которые чаще всего развиваются при тифо-паратифозных заболеваниях, тяжелые формы заболевания чаще – при паратифе В, паратиф А протекает более благополучно.
2. Тяжесть заболевания обусловлена развитием интоксикации, кишечным кровотечением, прободением кишечника с развитием перитонита и межпетлевого абсцесса.
3. В истории болезни не отражены — диета, и режим больного, нарушение, которых возможно и послужили развитию тяжелых осложнений. Нет лабораторных данных, подтверждающих этиологический диагноз.
4. Необходимо провести исследование: посев крови на гемокультуру, посевы кала и мочи на тифо-паратифозные вобудители(урино- и копрокультура), реакцию Видаля с тифо-паратифозными диагностикумами, перед выпиской дуоденальное зондирование с посевом желчи (биликультура), чтобы исключить носительство.
5. Диф. диагностику необходимо провести: с кишечным иерсиниозом, аппендицитом, неспецифическим язвенным колитом.
К задаче 6
1. Диагноз: Брюшной тиф, острое течение, крайне тяжелая форма, инфекционно-токсическое состояние (статус тифозус). В пользу данного диагноза: острое развитие заболевания, постепенное нарастание лихорадки и интоксикации с нарушением сознания, появление папулезно-розеолезной сыпи в пределах 8-10 дня заболевания (9 день), умеренное вздутие живота, тимпанит, легкое урчание справа, наличие гепато-лиенального синдрома и грязно-серого налета на языке.
2. Тяжесть заболевания обусловлена возможно антибиотикорезистентностью возбудителя и, как следствие, отсутствием эффекта от проводимой этиотропной терапии.
3. Данному больному в плане этиотропной терапии можно увеличить суточную дозу антибиотика в 1,5 раза (В.А. Постовит, 1988) или заменить на антибактериальную группу, например сульфаниламиды, в частности – бисептол (В.М. Волжанин, 1996); можно левомицетин усилить дополнительно назначением бисептола, или сульфатона. В настоящее время при устойчивости брюшнотифозных возбудителей к левомицетину, рекомендуется назначить препараты из группы фторхинолонов (ципрофлоксацин, норфлоксацин и др.). Так как при брюшном тифе в воспалительном процессе кишечника принимает участие аутоиммунный компонент, то к лечению необходимо дополнить антигистаминные препараты или небольшие дозы гормонов под контролем свертываемости крови.
4. Необходимо дифференцировать с сепсисом (кровь на стерильность), тяжелой формой кишечного иерсиниоза (посевы на питательные среды крови, кала, ликвора, материал из аппендикулярного отростка, серологические реакции: РА, РНГА, ИФА)
5. Посев крови на гемокультуру, посевы кала и мочи на тифо-паратифозные вобудители(урино- и копрокультура), реакцию Видаля с тифо-паратифозными диагностикумами, перед выпиской дуоденальное зондирование с посевом желчи (биликультура).
К задаче 7
1. Диагноз. На основании длительной лихорадки постоянного типа (2 недели), заторможенного сознания, бледности кожных покровов, розеолезной сыпи на коже живота и груди, приглушенности сердечных тонов и относительной брадикардии, характерного языка (отечен с отпечатками зубов, густо обложен грязно-серым налетом), вздутия и болезненности живота с урчанием в правой подвздошной области, гепатомегалии, лейкопении с анэозинофилией, низкого удельного веса мочи — инфекционист поставил диагноз: Брюшной тиф, типичное течение, крайне тяжелая форма, тифозный статус, инфекционно-токсический шок.
2. Продолжительность заболевания обусловлена развитием кишечного кровотечения, что подтверждается развившимися внезапно клиническими симптомами: снижение температуры до 35,4º, появление холодного пота, учащение пульса —105 ударов в минуту на фоне нормальной температуры, снижения артериального давления — 80/50 мм рт. ст, обильного стула со сгустками крови.
3. Тактика ведения больного проводилась интенсивная с четким наблюдением и фиксацией патологической симптоматики и гибким реагированием назначений. К лечению и ведению больного можно дополнить – холод на живот в первые часы кровотечения, строгий покой и голод, консультация хирурга и постоянная с ними связь – все это не отражено в краткой выписки больного, возможно дополнить переливание концентрированной плазмы и тромбоцитарной массы.
4. Необходимо дифференцировать прежде всего с отравлением ртутью, а также с неспецифическим язвенным колитом, иерсиниозом, малярией.
К задаче 8.
1. На основании длительной лихорадки (в течении 3-х недель), брадикардии на фоне гипертермии, нарушения сознания, внезапного падения t° (36,4°), развития бледности и учащения пульса (102 уд/мин); выраженного болевого синдрома при взятии судна можно предположить осложнения — кишечное кровотечение, перфорация стенки тонкой кишки с развитием перитонита, которые чаще всего сопровождают не леченные или не диагностированные случаи брюшного тифа и развиваются в конце 3 начале 4 неделях патоморфологического процесса данного заболевания (стадия отторжения некротических участков с образованием чистых язв). Клинический диагноз: Брюшной тиф, тяжелая форма, острое течение; осложнения — кишечное кровотечение, перфорация стенки тонкой кишки с развитием перитонита.
2. Дифференциальный диагноз необходимо провести: с сепсисом (кровь на стерильность), тяжелой формой кишечного иерсиниоза, аппендицитом, неспецифическим язвенным колитом.
3. Объем исследований Необходимо провести исследование: посев крови на гемокультуру, посевы кала и мочи на тифо-паратифозные вобудители(урино- и копрокультура), реакцию Видаля с тифо-паратифозными диагностикумами, перед выпиской дуоденальное зондирование с посевом желчи (биликультура), чтобы исключить носительство.
4. Ваша тактика лечения: голод, холод и покой, консультация хирурга, срочная операция (лапоротомия с ревизией кишечника). Лечение: левомицетин 0,5 г 4 раза в сутки, дезинтоксикация, аналгетики. Дробное переливание одногруппной, лучше свежей крови в объеме 1/3 от количества выделенной дегтеобразной массы. С гемостатической целью вводят викасол, аминокапроновую кислоту, фибриноген, желатиноль, хлористый кальций. Режим строгий постельный, диета, исключение из питания продуктов, содержащих грубую клетчатку.
5. Прогноз может быть благоприятным при своевременном оказании хирургической помощи, тщательном уходе за больным, комплексной этиотропной и патогенетической терапии.
К задаче 9.
1. Брюшной тиф, средней степени тяжести, острое течение, разгар болезни — на основании классического развития болезни и эпиданамнеза (употребление технической воды).
2. Дифференциальный диагноз: с гриппом (обычно гриппоподобная форма брюшного тифа протекает доброкачественно, лихорадочный период не превышает 9дней.), пневмонией (начало заболевания с пневмонии при брюшном тифе рассматривается как атипичное течение), так как с этими диагнозами больной был направлен на госпитализацию; иерсиниозом, паратифами, малярией.
3. Гемокультура, РПГА с антигенами брюшного тифа и паратифов А и В, реакция Видаля, ИФА. Необходимо провести исследования на вирусы гриппа (мазки из носа и зева, кровь на парные сыворотки).
4. Левомицетин сукцинат натрия 1.0 3 раза в сутки в/м до 4-го — 5-го дня нормальной температуры с последующим снижением на 0,5 г до 10 дня нормальной температуры.
5. Объем противоэпидемических мероприятий: обследование контактных по комнате в общежитии — осмотр, термометрия и обследование на тифо-паратифозные возбудители. Перед выпиской больному провести дуоденальное зондирование с посевом желчи (биликультура), чтобы исключить носительство.
К задаче 10.
1. Высокая температура, головная боль, слабость, бес сонница, отсутствие аппетита, жидкий стул, обильная пятни сто-папулезная сыпь на туловище и конечностях, относитель ная брадикардия, утолщенный, обложенный язык, эпиданамнез (пребывание в Средней Азии) обязывают исключить тифо-паратифозное заболевание. Скорее всего, это паратиф В, поскольку начало болезни острое, отмечались озноб, ка таральные явления и явления гастроэнтерита, раннее появ ление обильной сыпи.
2. Сочетание диспепсического и катарального синдромов, сильная головная боль, высокая температура, наличие сыпи обязывают дифференцировать с иерсиниозом, сыпным тифом и гриппом. Против иерсиниоза — отсутствие артралгий и миалгий, симптома «перчаток» и «носков». Против сыпного тифа — подострое начало, наличие диспепсических явлений. Против гриппа — длительность заболевания, наличие сыпи, диспепсических явлений.
3. Бактериологические исследования — посев крови, мочи, испражнений для выделения возбудителя брюшного тифа или паратифов. Серологические исследования крови в парных сыворотках для исключения гриппа; реакция Видаля, РНГА с Н-, О-, Vi антигенами брюшного тифа, паратифов А и В, иерсиниозными диагностикумами, РСК, РГА с риккетсиями Провачека. Общий анализ крови.
4. Госпитализация в инфекционную больницу. При усилении боли в животе — голод, холод и покой, консультация хирурга. Лечение: левомицетин 0,5 г 4 раза в сутки, дезинтоксикация, аналгетики. Режим строгий постельный, диета, исключение из питания продуктов, содержащих грубую клетчатку.
5. Контактных по работе лиц и домочадцев: осмотр, термометрия и обследование на тифо-паратифозные возбудители.
К задаче 11.
1. Внезапное появление боли в животе, локальная болезненность при пальпации в илеоцекальной области, напряжение мышц брюшной стенки и положительные симптомы раздражения брюшины позволили врачу скорой помощи заподозрить острый аппендицит. Однако выявленный при ревизии брюшной полости язвенный илеит требует объяснений.
2. Субфебрильная температура, симптомы интоксикации за 18 дней до операции, кратковременный эффект от приема ампициллина, наличие язвенного илеита (3-я неделя начало отторжения некротических участков с лимфатических фолликулов подвздошной кишки и формирование чистых язв – 4 неделя заболевания) и регионарного лимфаденита, данные гемограммы позволяют в первую очередь заподозрить у больного брюшной тиф, преперфоративное состояние. Стертое течение обусловлено кратковременным приемом ампи циллина в дозах, недостаточных для полного излечения.
3. Больной нуждается в дальнейшем наблюдении хирурга и инфекциониста, строгом постельном режиме, диетическом питании, дезинтоксикации, приеме левомицетина 0,5 г 4 раза в сутки.
4. Посев крови на желчный бульон или, посев мочи на среду Плоскирева и бактоагар, реакция Видаля и РНГА с О-, Н-, Vi – антигенами брюшного тифа и паратифами А и В, бактериологическое исследование ткани лимфоузла, брыжейки и содержимого аппендикса на бактерии тифо-паратифозной группы и иерсинии.
5. Нужно проводить в данном отделении текущую дезинфекцию, а при переводе больного в инфекционное отделение – заключительную.
К задаче 12 .
1. Головная боль, плохой сон, снижение аппетита, вздутие живота, фебрильная температура на протяжении 10 дней, бледность, слабость, гепатолиенальный синдром, относительная брадикардия, обложенность языка коричневатым налетом, контакт с лихорадящими больными с не установленным диагнозом позволяют предположить тифо-паратифозное заболевание.
2. Повторное повышение температуры тела — или волнообразная температурная кривая (2-3 волновая) при брюшном тифе описаны еще С.П.Боткиным в конце 19 века, Н.И Рагоза и А.Л. Каценович (1935г.) примерно у 50% больных (проанализировано 10106 ист.бол.) брюшным тифом зафиксировали волнообразный характер температурной кривой. В данном случае прием бисептола, аспирина, анальгина всего лишь одну неделю оказал положительный эффект, но этиотропное лечение было прервано, его необходимо принимать при брюшном тифе до 10-12 дня после нормализации температуры, а постельный режим и соблюдение соответствующей диеты – 30 – 35 дней, так как патоморфологические изменения в кишечнике продолжаются примерно 5 недель при неосложненных формах заболевания. У данной больной 29 день болезни (конец 4-ой недели), еще возможно развитие осложнений со стороны кишечника.
3. Данных за грипп нет: отсутствует свойственный гриппу токсикоз в первые дни болезни, нет респираторно-катарального синдрома.
4. Не получила должной оценки врача длительная (более 5 дней) лихорадка, вздутие живота, гепато-лиенальный синдром, что также не свойственно гриппу. Пятидневная лихорадка при неясности диагноза обязывала врача к проведению дополнительных методов обследования, которые не были предприняты. Таким образом, диагнозы «грипп, пневмония» следует считать ошибочными, а работу врача по ведению больной — неудовлетворительной.
5. Объем противоэпидемических мероприятий необходимо начать со старшей группы детского сада, где больная работает воспитателем, а также персонал столовой д/с, домочадцев: осмотр, термометрия и обследование на тифо-паратифозные возбудители.
К задаче 13 .
1. Тифо-паратифозное заболевание (брюшной тиф), тяжелая форма, атипичное течение. Правосторонняя очаговая пневмония (пневмотиф). Осложнение: кишечное кровотечение.
Диагноз поставлен на основании продолжительной высокой лихорадки, головной боли, бессонницы, объективных данных: вялости, заторможенности больного, относительной брадикардии, «тифозного» языка, метеоризма, гепатолиенального синдрома, болезненности живота в правой подвздошной области, гемограммы (лейкопения, лимфоцитоз, анэозинофилия), появления кишечного кровотечения в конце второй недели заболевания.
Жалобы больного на боли в грудной клетке, появление мокроты, выявленных врачом при осмотре больного патологии со стороны легких (одышка, укорочение перкуторного звука в области правого угла лопатки, наличие ослабленного дыхания, сухих и влажных хрипов) на 3-й день заболевания – указывали на развитие пневмонии и не могли говорить о брюшном тифе, и только впоследствии, развившаяся типичная клиника брюшного тифа с характерным тяжелым осложнением, говорит об атипичном течении его начального периода – пневмотифе.
2. Наличие правосторонней очаговой пневмонии, которую подтверждают клинические и рентгенологические данные, не противоречит диагнозу брюшного тифа, т.к. пневмония является одним из атипичных проявлений данной инфекции. Наличие изменений, обнаруженных при рентгеноскопии, в сочетании с длительной лих
Источник: cyberpedia.su
К лейкоцитам, этим основным клеточным компонентам воспаления и иммунной реакции, относятся нейтрофилы, лимфоциты, моноциты, эозинофилы и базофилы. Кровь служит наиболее доступным источником лейкоцитов и средством транспортировки клеток из костного мозга, где они генерируют, в различные ткани. В норме число лейкоцитов в крови взрослых лиц составляет 4,5—11•109/л (их норма у лиц разного возраста указана в приложении). Из всех лейкоцитарных клеток большая часть приходится на нейтрофилы (54—62%), затем следуют лимфоциты (25—33%), моноциты (3—7%), эозинофилы (1—3%) и базофилы (0—0,75%). Полагают, что различные типы лейкоцитов происходят от общей стволовой клетки. Из всех ядросодержащих клеток костного мозга 3/4 участвуют в продукции лейкоцитов. Созревание лейкоцитов в костном мозге находится, по всей вероятности, под регуляторным контролем разнообразных факторов, еще не полностью изученных. Поскольку изменение числа и типа лейкоцитов обычно бывает связано с болезненным процессом, их общее число (в 1 мл3) и лейкоцитарную формулу определяют часто. Вопрос о лимфоцитах и базофилах дискутируется в других разделах книги. Настоящая глава посвящена изучению нейтрофилов, моноцитов и эозинофилов.

Рис. 56-1. Схематически представленный жизненный цикл нейтрофилов.
Нейтрофилы
Процесс созревания
Основные этапы жизненного цикла нейтрофилов схематически представлены на рис. 56-1. В норме нейтрофилы ‘человека вырабатываются исключительно в костном мозге. Оптимальный подсчет позволил определить, что число стволовых клеток, необходимых для поддержания гемопоэза, соответствует 400—500. Получены убедительные доказательства, свидетельствующие о продукции моноцитами периферической крови и тканевыми макрофагами колониестимулирующих факторов и синтезе гормона (ов), необходимого (ых) для роста моноцитов и нейтрофилов в костном мозге. Система гемопоэза не только производит достаточное количество нейтрофилов (примерно 1,3•1011/80 кг в сутки) для участия в физиологических процессах, но и создает резерв в костном мозге, который может быть мобилизован в ответ на воспаление или инфекцию. Увеличение числа нейтрофилов в периферической крови называют нейтрофилией, а появление в ней незрелых клеток—сдвигом формулы крови влево. Уменьшение числа нейтрофилов называют нейтропенией.
Нейтрофилы происходят от полипотентной стволовой клетки. Конечные стадии гемопоэза характеризуются появлением клеток с различными морфологическими признаками. Миелобласт — это первая распознаваемая клетка-предшественник, за которой следует промиелоцит. Последний эволюционирует, когда образуются классические лизосомные гранулы, называемые первичными, или азурофильными. Первичная гранула содержит гидролазу, эластазу, миелопероксидазу и катионные белки. Пролимфоцит делится с образованием миелоцита—клетки, ответственной за синтез специфических, или вторичных, гранул, содержащих такие уникальные вещества, как лактоферрин, белки, связывающие витамин Biz и, вероятно, цитохром b, гистаминазу и рецепторы для некоторых хемоаттрактантов и факторов (промоторы), усиливающих адгезию. Вторичные гранулы не содержат кислые гидролазы и поэтому не относятся к классическим лизосомам. Они легко высвобождаются во внеклеточное пространство и их мобилизация, вероятно, важна для модуляции воспаления. На последних стадиях созревания деление клеток не происходит, но клетка через стадию метамиелоцита переходит в стадию нейтрофила с ядром в форме колбаски. Как только последний созревает, ядро приобретает сегментарную конфигурацию.
При тяжело протекающих острых бактериальных инфекциях в цитоплазме нейтрофилов становятся четко видны гранулы, получившие название токсических грануляций. Они представляют собой незрелые или аномально окрашивающиеся азурофильные гранулы. При инфекции обнаруживаются и цитоплазматические включения, так называемые тельца Доэля, по-видимому, представляющие собой фрагменты эндоплазматического ретикулума. При острых бактериальных инфекциях часто выявляют крупные нейтрофильные вакуоли, образованные в процессе пиноцитоза (интернализация) мембраны.
В течение продолжительного периода нейтрофилы считали гомогенной клеточной популяцией. Однако изучение их функции предполагает, что речь идет о гетерогенном пуле. Относительно недавно проведенные с помощью моноклоиальных антител исследования позволили распознать лишь субпопуляцию зрелых нейтрофилов. Значение гетерогенности нейтрофилов остается невыясненным.
Высвобождение нейтрофилов из костного мозга в систему циркуляции
Специфические сигналы, включая интерлейкин-1 (эндогенный пироген) или С3е-компонент комплемента, мобилизуют лейкоциты из костного мозга и способствуют их поступлению в кровь в нестимулированном состоянии. В норме около 90% пула нейтрофилов находится в костном мозге, 2—3% — в системе циркуляции, оставшаяся часть — в тканях. Нейтрофилы периферической крови существуют в виде двух составляющих: маргинальный, или краевой, пул, прикрепляющийся к клеткам эндотелия, и свободно циркулирующий. В ответ на хемотаксический тканевой стимул (например, компонент комплемента С5а, производный арахидоновой кислоты лейкотриен В4 или продукт бактериального происхождения М-формилметиониллейцилфенилаланин) адгезивность нейтрофилов усиливается и циркулирующие клетки агрегируют на эндотелии. Кроме того, увеличенное количество гликопротеинового рецептора для C3bi (CR3) служит признаком вовлечения клеток в процесс усиления адгезии. Рецепторы для хемоаттрактантов и опсонинов, вероятно, также мобилизуются; клетки, ориентированные на источник хемоаттрактанта во внесосудистом пространстве, активизируют свою подвижность (хемокинез) и миграцию (хемотаксис) в ткани. Процесс миграции в ткани, или диапедез, включает передвижение нейтрофилов сквозь слой посткапиллярных эндотелиальных клеток, чьи открытые стыки между соседними клетками способствуют прохождению лейкоцитов. Реакции эндотелия (усиление кровотока вторично по отношению к расширению и увеличению проницаемости сосудов) опосредованы анафилатоксином (включая и компоненты комплемента С3а и С5а) и в равной степени сосудорасширяющими факторами, такими как брадикинин и простагландины Е и I. У здоровых взрослых большая часть нейтрофилов выводится из организма путем миграции через слизистую оболочку желудочно-кишечного тракта. В норме нейтрофилы циркулируют в крови сравнительно непродолжительное время, их период полужизни составляет 6— 7 ч. В тканях нейтрофилы однократно высвобождают ферменты, например коллагеназу и эластазу, что позволяет определить локализацию полости абсцесса. Нейтрофилы поглощают (фагоцитоз) патогенный материал, который соответствующим образом перерабатывается (опсонируется) IgG и С3b. Фибронектин и тетрапептид туфтсин способствуют процессу фагоцитоза.
Фагоцитозу сопутствует значительное поглощение кислорода и активация гексозомонофосфатного шунта. Никотинамидадениндинуклеотида фосфат (NADPH) оксидаза активируется через сложную систему ферментов, содержащую флавопротеины и цитохром Ь, генерирует токсические производные кислорода (например, перекись водорода и гидроксильные радикалы). Комплекс перекиси водорода, хлорида и миелопероксидазы обеспечивает особую систему, обладающую токсическими свойствами, которая продуцирует хлорноватистую кислоту, гипохлорит и хлор. Эти продукты окисляют и галогенируют микроорганизмы и опухолевые клетки, но в неконтролируемой ситуации могут повредить ткань хозяина. Сильные катионные белки также участвуют в уничтожении микроорганизмов, а ферменты, например кислые протеазы и лизоцим, способствуют перевариванию их остатков. Через 1—4 дня нейтрофилы в тканях погибают. Вторая волна воспаления, скопление моноцитов, происходит через 6—12 ч после начала воспалительного процесса. Нейтрофилы, моноциты, а также в разной степени переработанные микроорганизмы и измененные клетки местной ткани образуют гнойную массу, -окрашенную за счет миелопероксидазы в характерный зеленоватый цвет. Миелопероксидазе и другим факторам принадлежит главная роль в прекращении интенсивного процесса воспаления путем инактивации хемоаттрактантов и иммобилизации клеток-фагоцитов.
Нарушение функции нейтрофилов
Возможные нарушения жизненного цикла нейтрофилов представлены на рис. 56-1. В качестве клинического результата следует отметить снижение защитных свойств организма, что проявляется рецидивирующими острыми бактериальными и грибковыми инфекциями, создающими новые и зачастую сложные проблемы.
Нейтропения. Последствия отсутствия нейтрофилов в значительной мере отражают драматизм ситуации и одновременно указывают на защитную роль этих клеток в организме. При уменьшении числа нейтрофилов до значения менее 1000 в 1 мм3 повышается риск развития инфекции; если же их число становится менее 200 в 1 мл3, то воспалительный процесс не развивается. Причины нейтропении многочисленны, к ним относятся подавление продукции нейтрофилов, их разрушение в периферической крови и депонирование (табл. 56-1).
При выраженной нейтропении у новорожденных развиваются острые бактериальные и вирусные инфекции, обусловленные недостаточностью резерва костного мозга. Известны врожденные формы нейтропении, в том числе синдром Костманна (менее 100 клеток в 1 мм ), часто приводящие к летальному исходу, более доброкачественная хроническая идиопатическая нёйтропения (300— 1500 клеток в 1 мм3), синдромы гипоплазии волос и хряща и Швахмана, связанные с недостаточностью поджелудочной железы, и нёйтропения на фоне иммунодефицита (Х-сцепленная а?глобулинемия, атаксия-телеангиэктазия, дефицит IgA). Циклическая нейтропения, наследуемая по аутосомно-доминантному типу, может встречаться у детей. Материнские факторы, ассоциирующие с нейтропенией у новорожденных, включают в себя трансплацентарный перенос IgG, направленного против антигенов фетальных нейтрофилов и лекарственных средств (например, тиазиды), которые получала беременная.
Таблица 56-1. Причины нейтропении

Иммуноглобулины (IgG), направленные против нейтрофилов, встречаются при синдроме Фелти (триада: ревматоидный артрит, спленомегалия и нейтропения). Больные с синдромом Фелти, реагирующие на спленэктомию увеличением числа нейтрофилов и существенным снижением уровня сывороточного, связанного гранулоцитами, IgG, дают основание предполагать, что одним из основных эффектов спленэктомии следует считать уменьшение числа антинейтрофильных антител. Лекарственные средства, вызывающие нейтропению, усиливая разрушение или секвестрацию нейтрофилов, по-видимому, действуют при условии реакции сывороточных антител с препаратом (антиген), абсорбированном на нейтрофиле. Препараты, вызывающие нейтропению именно с помощью этого механизма, обладают разным латентным периодом для проявления цитотоксичности, хотя при их последующем приеме нейтропения развивается в течение нескольких часов.
Нейтрофилия. Число нейтрофилов в периферической крови увеличивается при усилении их продукции в костном мозге или нарушении процесса маргинации (табл. 56-2). Усиленная продукция нейтрофилов связана с хроническим воспалением или инфекцией, некоторыми формами миелопролиферативных заболеваний. Усиление миграции клеток из костного мозга может происходить под влиянием кортикостероидов. Высвобождение адреналина как при физической нагрузке, так и при возбуждении, стрессе может обусловить перераспределение нейтрофилов, двукратное увеличение по сравнению с нормой их числа в периферической крови. Число лейкоцитов 10—25•109/л встречается как реакция организма на инфекцию или другие формы острого воспаления и обусловлено как высвобождением нейтрофилов из маргинального пула, так и мобилизацией резерва костного мозга. Устойчивую форму нейтрофилии (30—50•109/л или более) называют лейкемоидной реакцией; этот термин часто используют для дифференциации этой степени нейтрофилии от лейкоза. Следует иметь в виду, что при лейкемоидной реакции в периферической крови циркулируют обычно зрелые нейтрофилы.
Аномальные функции нейтрофилов
Врожденные и приобретенные нарушения функции фагоцитов представлены в табл. 56-3. Известны заболевания, рассматриваемые с точки зрения функциональных нарушений адгезии, хемотаксиса или бактерицидной активности нейтрофилов. Отличительные характеристики основных наследственных нарушении представлены в табл. 56-4, некоторые из них дискутируются далее.
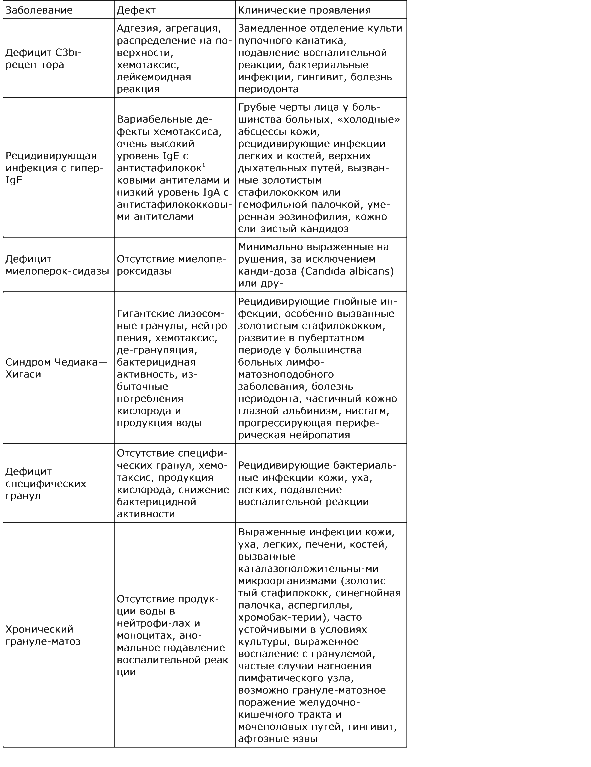
Недостаточность С3bi (СR3)-рецептора. У больных с врожденной аномальной адгезией фагоцитов (тип, наследования аутосомно-рецессивный) отсутствуют мембранные рецепторы для фрагмента С3-компонента комплемента, по другой терминологии называемого C3bi/CR3. Клинически большинство больных с этим синдромом страдают рецидивирующими бактериальными и грибковыми инфекциями, выраженным периодонтитом, устойчивым лейкоцитозом (15—20•109/л), в их анамнезе обычно есть указания на замедленное отделение культи пуповинного канатика. Нейтрофилы (и моноциты), выделенные от этих больных, отличаются аномалией адгезии, распространения, агрегации и хемотаксиса.
Таблица 56-3. Типы дисфункции нейтрофилов

Таблица 56-4. Отличительные признаки синдрома врожденного нарушения функции нейтрофилов

Рецидивирующая инфекция с гипериммуноглобулинемией Е (синдромом Джоба). Аномальный хемотаксис нейтрофилов и моноцитов отмечается при рецидивирующей инфекции на фоне гиперпродукции IgE. У больных при этом рецидивируют инфекции, вызванные золотистым стафилококком, часто они имеют характерные черты лица, у них выявляют «холодные» абсцессы кожи, дерматит, заметно повышенный уровень в сыворотке IgE, в том числе уровень антистафилококкового IgE, низкий уровень антистафилококкового IgA или его отсутствие, умеренно выраженную эозинофилню и недостаточность функции Т-супрессорных лимфоцитов. В течение многих лет считали, что «холодный» абсцесс отражает дефект хемотаксиса, когда некоторые фагоциты слишком поздно достигают очага воспаления, что, возможно, объясняется действием вторичного по отношению к лимфоцитам фактора ингибнции хемотаксиса. Однако, согласно новым представлениям, дефект хемотаксиса у этих больных вариабелен и основа для снижения защитной функции организма представлена целым комплексом факторов и их неадекватностью.
Дефицит миелопероксидазы. К основным общим дефектам нейтрофилов относят дефицит миелопероксидазы, который наследуется по аутосомно-рецесснвному типу и встречается с частотой примерно 1 на 2000. Изолированный дефицит миелопероксидазы обычно не связан с тяжелой и опасной для жизни формой нарушений, поскольку усиливается активность других систем защиты, таких как продукция перекиси водорода. Однако если речь идет о других состояниях, например о слабоконтролируемой форме сахарного диабета, сопровождаемого дефицитом миелопероксидазы, то защита организма может подвергаться значительному риску. Приобретенная форма дефицита миелопероксидазы встречается при миеломоноцитарном и остром миелобластном лейкозах. При остром миелогенном лейкозе выявляют окрашенные в розовый цвет атипично увеличенные первичные гранулы, называемые тельцами Ауэра.
Синдром Чедиака—Хигаси. Этот редко встречающийся синдром с аутосомно-рецессивным типом наследования клинически проявляется рецидивирующей пиогенной инфекцией, периодонтитом, частичным кожно-глазным альбинизмом, нистагмом и прогрессирующей периферической нейропатией. Почти у 50% больных в пубертатном периоде развивается лимфоматозная (ускоренная) фаза заболевания. Нейтрофилы и другие типы клеток, содержащие лизосомы, содержат крупные гранулы. При этом синдроме нарушается хемотаксис нейтрофилов и моноцитов и снижается интенсивность уничтожения микроорганизмов, что обусловлено замедленным слиянием лизосомных гранул с фагосомами.
Хронический гранулематоз. Хронический гранулематоз отмечается у больных с нарушением окислительного метаболизма нейтрофилов и моноцитов. Несмотря на то что это довольно редкое заболевание (один случай на 1 млн популяции), оно остается основной моделью аномалии окислительного метаболизма нейтрофилов. Чаще всего заболевание наследуется по сцепленному с Х-хромосомой рецессивному типу, но у 15% больных наследование происходит но аутосомно-рецессивному и аутосомно-доминантному тину, о чем сообщалось по отношению к членам одной семьи. В лейкоцитах больных заметно снижена продукция перекиси водорода. Дефекты в системе гексозомонофосфатного шунта или ферменты NADPH-оксидазы в лейкоцитах могут привести к клиническим проявлениям заболевания. Больные с хроническим гранулематозом более подвержены инфекциям, как правило, вызванным каталаза-положительными микроорганизмами (их разрушение зависит от собственной продукции перекиси водорода). К возбудителям инфекций относятся золотистый стафилококк, кишечная палочка, Serratia marcescens, Chromobacteriuin violaceum, нокардии и некоторые грибы (Aspergillus и Candida albicans). He отмечено увеличения числа случаев инфекционных заболеваний, обусловленных каталаза-отрицательным микроорганизмом, например пневмококком. После инфицирования у больного с хроническим гранулематозом часто развиваются выраженная реакция воспаления и нагноение лимфатического узла, несмотря на интенсивное лечение антибиотиками. Обычно появляются афтозные язвы, развиваются гингивит и хроническое воспаление в носовых ходах. Часто образуются гранулемы, которые могут обтурировать желудочно-кишечный тракт и мочеполовые пути. Чрезмерно выраженные воспалительные реакции, вероятно, отражают аномальный процесс переработки хемоаттрактантов и антигенов, что в конечном счете приводит к персистирующему скоплению нейтрофилов. Несостоятельность макрофагов в отношении действия на внутриклеточные микроорганизмы может привести к активации факторов клеточного иммунитета и образованию гранулемы. К помощи хирургических методов прибегают с целью дренажа полости абсцессов в легких, печени и костях.
Мононуклеарные фагоциты
Определяя систему мононуклеарных фагоцитов, следует отметить, что она объединяет связанные воедино монобласты, промоноциты, моноциты и различные по структуре тканевые макрофаги, которые ранее относили к ретикулоэндотелиальной системе. Макрофаги — это долгоживущие фагоцитарные клетки, обладающие большинством функций нейтрофилов. Они представляют собой важные секреторные клетки, которые с помощью своих рецепторов и продуктов секреции участвуют в целом комплексе иммунологических и воспалительных процессов, не опосредуемых нейтрофилами. Моноциты покидают кровеносное русло, через стенки сосудов путем диапедеза, причем значительно медленнее, чем нейтрофилы, их период полужизни составляет 12—24 ч.
После того как моноциты покинут кровоток, они мигрируют в ткани, в которых дифференцируются в макрофаги со специализированными функциями в соответствии с анатомической локализацией. Особыми функциями обладают альвеолярные макрофаги, звездчатые ретикулоэндотелиоциты печени (клетки Купфера), перитонеальные макрофаги, клетки микрогдии головного мозга, макрофаги костного мозга, селезенки, лимфатических узлов, дендритные макрофаги. Факторы, секретируемые макрофагами, включают лизоцим, нейтральные протеазы, кислые гидролазы, аргиназу, ряд компонентов комплемента, ингибиторы ферментов (плазмин, ?2-макроглобулин), связующие протеины (трансферрин, фибронектин, транскобаламин II), нуклеозиды, а также интерлейкин-1 (пироген). Последний выполняет многие важные функции, стимулирует гипоталамус, что сопровождается лихорадочной реакцией: мобилизует лейкоциты из костного мозга, а также активирует лимфоциты и нейтрофилы. Другая группа продуктов, секретируемых макрофагами, включает реактивные метаболиты кислорода, биологически активные липиды (метаболиты арахидоновой кислоты и факторы активации тромбоцитов), нейтрофильный хемоаттрактант, факторы регуляции синтеза белка других клеток, колониестимулирующий фактор относительно клеток костного мозга, факторы стимуляции фибробластов и пролиферации элементов микроциркуляции, а также факторы, ингибирующие процесс репликации лимфоцитов, опухолей, вирусов и некоторых видов бактерий (листерии). Макрофаги функционируют и как клетки-эффекторы, участвующие в элиминации внутриклеточных микроорганизмов. Их способность к слиянию с образованием гигантских клеток, которые формируются в гранулему в ответ на воспалительную реакцию, представляет собой важное звено в элиминации внутриклеточных микроорганизмов; этот процесс может находиться под контролем у-интерферона.
Макрофагам принадлежит важная роль в иммунном ответе. Они возбуждают антиген для представления его лимфоцитам, модулируют функцию лимфоидных клеток, участвуют в аутоиммунной реакции, удаляя иммунные комплексы и другие иммунологически активные вещества из кровотока. Кроме того, макрофаги играют определенную роль в заживлении ран, элиминации стареющих разрушающихся клеток и развитии атеромы.
Нарушения функции мононуклеарных фагоцитов
Большинство нарушений нейтрофилов распространяются на мононуклеарные фагоциты. Таким образом, лекарственные вещества, которые подавляют продукцию нейтрофилов в костном мозге, обычно приводят к моноцитопении. Транзиторную моноцитопению можно также наблюдать после стресса или лечения кортикостероидами. Моноцитоз связывают с некоторыми инфекциями, такими как туберкулез, бруцеллез, подострый бактериальный эндокардит, пятнистая лихорадка Скалистых гор (американский клещевой риккетсиоз) и малярия. Моноцитоз сопровождает также кала-азар, опухоли, лейкозы, миелопролиферативный синдром, гемолитическую анемию, хроническую идиопатическую нейтропению, гранулематозы, такие как саркоидоз, региональный энтерит (болезнь Крона) и некоторые сосудистые коллагенозы. У больных с недостаточностью рецептора С3bi нейтрофилов, рецидивирующими инфекциями, гипер-IgE, синдромом Чедиака—Хигаси и хроническим гранулематозом обнаруживают дефекты системы мононуклеарных фагоцитов.
Некоторые вирусные инфекции способствуют нарушению функции мононуклеарных фагоцитов. Например, инфекция вирусом гриппа связана с нарушением хемотаксиса моноцитов. Изменение хемотаксиса моноцитов и клиренса покрытых IgG эритроцитов (дискутируется далее) встречается при синдроме приобретенного иммунодефицита (СПИД), вызванном ретровирусом человека. Вероятно, дефекты моноцитарно-макрофагальной системы при СПИДе связаны с повышенной чувствительностью к возбудителям оппортунистических инфекций, таким как внутриклеточные формы пневмоцист и микобактерий. Фактор, вырабатываемый Т-лимфоцитами, дефицит которого возможен при СПИДе, способствует экспрессии Fc-рецептора и фагоцитозу, опосредованному мононуклеарными фагоцитами. При других заболеваниях, например при Т-клеточной лимфоме, усиленная продукция этого Т-клеточного фактора предпол.агает причинную связь с эритрофагоцитозом, обусловленным макрофагами селезенки.
Специфические дефекты мононуклеарных фагоцитов встречаются при некоторых аутоиммунных заболеваниях. Удаление меченых, покрытых IgG аутологичных эритроцитов, по-видимому, путем связывания на Fc-рецепторах макрофагов селезенки, указывает на основной дефект у больных с активной формой системной красной волчанки. Для больных с другими аутоиммунными заболеваниями типично отложение в тканях иммунных комплексов, что выявляется при синдроме Шегрена, смешанной форме криоглобулинемии, герпетиформном дерматите и хроническом прогрессирующем рассеянном склерозе, а также недостаточности функции Fc-рецептора, что следует из данных, свидетельствующих о снижении клиренса покрытых IgG эритроцитов. У клинически здоровых лиц с генетическими гаплотипами, связанными с аутоиммунными заболеваниями (HLA-B8/DRw3), также повышена частота случаев недостаточности Fc-рецептора, что предполагает склонность к этому функциональному дефекту при генотипе, встречающемся при болезнях иммунных комплексов.
Эозинофилы
Эозинофилы и нейтрофилы отличаются сходством морфологии, содержат многочисленные лизосомные включения, обладают хемотаксическими свойствами, способностью к фагоцитозу и окислительному метаболизму. Однако между ними существуют и значительные различия, недостаточно известно о естественной функции эозинофилов. По сравнению с нейтрофилами эозинофилы отличаются большей продолжительностью жизни, а тканевые эозинофилы могут рециркулировать. При большинстве инфекций эозинофилы не проявляют своих основных функций. Однако при инвазивных паразитарных инфекциях, например при анкилостомозе, шистосомозе, стронгилоидозе, токсокарозе, трихинозе, филариатозе, эхинококкозе и цистицеркозе эозинофилы играют центральную роль в защите организма хозяина. Эозинофилия сопровождает также бронхиальную астму, кожные аллергические реакции и другие состояния гиперчувствительности.
Характерные для эозинофилов, окрашиваемые в красный цвет, гранулы (окраска по Райту) содержат необычные включения. Отличительным признаком эозинофильной гранулы является кристаллическая центральная масса, состоящая из богатого аргинином белка (главный щелочной протеин) с активностью гистаминазы, который, по всей вероятности, играет главную роль в защите организма от паразитов. Эозинофильная гранула содержит также особую эозинофильную пероксидазу, катализирующую окисление большинства веществ с помощью перекиси водорода, которая может способствовать уничтожению микроорганизмов. Эозинофильная пероксидаза в присутствии перекиси водорода и соли галоидоводородной кислоты инициируют секрецию тучных клеток in vitro, тем самым способствуя развитию воспаления. Среди прочих веществ в эозинофилах содержатся катионные белки, некоторые из них связываются с гепарином, снижая его антикоагулянтную активность. В цитоплазме эозинофилов находятся белковые кристаллы Шарко—Лейдена, шестиугольные бипирамидальные кристаллы, впервые обнаруженные у больных лейкозом, а затем в мокроте больных астмой. Этот белок обладает активностью лизофосфолипазы и может функционально способствовать снижению токсичности некоторых лизофосфолипидов. Эозинофилы содержат также сильный нейротоксин. Поскольку больные с синдромом гиперэозинофилии и эозинофилией в спинномозговой жидкости страдают различными неврологическими нарушениями, нейротоксину эозинофилов может принадлежать важная роль в индукции заболеваний ЦНС.
Ряд факторов способствует усилению функции эозинофилов, участвующих в защите организма. Например, Т-клеточный фактор, стимулирующий эозинофилы, повышает их способность уничтожать паразитов. Происходящий из тучных клеток эозинофильный хемотаксический фактор анафилаксии (ECFa) увеличивает на эозинофилах число рецепторов к комплементу, в результате чего еще более усиливается их губительное воздействие на паразитов. И, наконец, синтезируемые макрофагами эозинофильные колониестимулирующие факторы могут не только усиливать продукцию эозинофилов в костном мозге, но и активировать их в качестве клеток-киллеров при паразитарных инфекциях.
Эозинофилия и эозинопения
Более 0,5•109/л эозинофилов содержится в крови при большинстве состояний, за исключением паразитарных инфекций. Наиболее часто причиной эозинофилии служат, вероятно, аллергические реакции на лекарственные препараты (йодиды, ацетилсалициловая кислота, сульфаниламиды). Эозинофилией сопровождаются такие аллергические заболевания, как сенная лихорадка, астма и экзема. Она определяется при сосудистых коллагенозах (ревматоидный артрит, эозинофильный фасцит, аллергический ангиит, гранулематоз) и злокачественных процессах (болезнь Ходжкина и грибовидный микоз), а также при рецидивирующих инфекциях с гипер-IgE и хроническом гранулематозе, однако механизм развития эозинофилии при этих заболеваниях еще недостаточно изучен. Наибольшее увеличение числа эозинофилов происходит при синдромах гиперэозинофилии, в том числе при синдроме Леффлера, эозинофильном лейкозе, а также идиопатическом гиперэозинофильном синдроме (с числом эозинофилов 50•109/л).
Идиопатический синдром гиперэозинофилии представлен гетерогенной группой нарушений с признаками пролонгированной эозинофилии неизвестного происхождения. При этом установлена связь с дисфункцией систем органов, включая сердце, ЦНС, почки, легкие, желудочно-кишечный тракт и кожу. Практически у всех больных в процесс вовлекается костный мозг, но наиболее тяжелые осложнения регистрируют при поражениях сердца и ЦНС. Учитывая тот факт, что эозинофилы обнаруживают в пораженных тканях, было высказано предположение о возможной причине повреждений, а именно о локальном депонировании токсических белков эозинофилов, таких как катионный и основной щелочной протеины. Патологические изменения при заболевании сердца приводят к тромбозу и в конечном итоге к эндокардиальному фиброзу и ограниченной эндомиокардиопатии. Сходные изменения происходят и в других тканях. Несмотря на то что механизм гиперэозинофилии неизвестен, было показано, что после лечения кортикостероидами у больного обычно наступает ремиссия. У больных, не чувствительных к кортикостероидам, число эозинофилов эффективно уменьшается при использовании цитотоксического препарата гидроокиси мочевины, более благоприятным становится и прогноз заболевания. При сердечно-сосудистых осложнениях возможны хирургический подход к лечению или более интенсивная медикаментозная терапия.
Эозинопения наступает при стрессе, обусловленном острой бактериальной инфекцией, а также после лечения кортикостероидами. Механизм эозинопении при острой инфекции неясен; что касается эндогенных кортикостероидов, то эозинопения развивалась независимо от них, так как отмечалась в эксперименте у животных после тотальной адреналэктомии. По-видимому, еще неизвестен в полной мере отрицательный эффект эозинопении.
Диагностика и коррекция дисфункции фагоцитов
При диагностике нарушений фагоцитарной системы исходят из клинических данных. Нейтропения или нарушение функции нейтрофилов часто связаны с подавлением процесса воспаления. Афтозные изъязвления слизистых оболочек (серые язвы без гноя) не составляют исключения. Довольно часто встречаются гингивит и болезнь периодонта. При дефектах клеток фагоцитарной системы больные страдают рецидивирующими и зачастую тяжелыми бактериальными и грибковыми инфекциями, что представляет сложную клиническую проблему. При врожденных дефектах инфекции развиваются уже в первые дни жизни ребенка. При некоторых нарушениях частота инфекций варьирует, а выраженные признаки заболевания могут отсутствовать в течение нескольких месяцев и даже лет. Больные в возрасте старше 30 лет с врожденными дефектами фагоцитов встречаются исключительно редко, что предполагает высокую смертность больных с этими типами нарушений в раннем возрасте. Однако в последние годы с помощью интенсивной терапии удалось повысить частоту встречаемости взрослых лиц с этими заболеваниями. Инфекции кожи, уха, верхних и нижних отделов дыхательных путей и костей встречаются часто, сепсис и менингит довольно редки.
При первичном обследовании больного подсчитывают общее число лейкоцитов, определяют лейкоцитарную формулу и сравнительно часто клеточный состав костного мозга с последующей оценкой резервных возможностей костного мозга (стероидный провокационный тест), маргинального циркулирующего клеточного пула (провокационный тест с адреналином), способность скопления лейкоцитов по краю участка воспаления (провокационный тест с эндотоксином). Оценка воспаления in vivo возможна с помощью теста кожного окна по методу, предложенному Rebuck, при котором определяют способность лейкоцитов мигрировать в очаг поражения и прилипать к поверхности покровного стекла. Учет in vivo клиренса покрытых IgG эритроцитов позволяет осуществлять контроль за системой мононуклеарных фагоцитов. Тесты in vitro по агрегации фагоцитов, адгезии, хемотаксису, фагоцитозу, дегрануляции, бактерицидности по отношению к золотистому стафилококку помогают точно определить нарушение клеточного или гуморального иммунитета, что в дальнейшем может быть оценено на молекулярном уровне. Недостаточность окислительного метаболизма определяют при скрининге с помощью теста с нитросиним тетразолием, основанного на способности продуктов окислительного метаболизма восстанавливать растворимый краситель желтого цвета до темно-синего формазана, нерастворимого вещества, преципитируемого внутри клеток, которое можно видеть под микроскопом. Дополнительные аспекты окислительного метаболизма нейтрофилов определяют путем изучения продукции супероксида и перекиси водорода.
К наиболее важным критериям наблюдения за больным относят замедленную воспалительную реакцию. По этой причине клинические проявления могут быть минимальными, несмотря на массивную инфекцию, поэтому нетипично протекающие инфекции у некоторых больных должны вызывать сомнение. При ранних признаках инфекции требуются немедленное лечение антибиотиками и хирургический дренаж абсцесса. Часто необходим пролонгированный курс антибиотикогерапии, а при угрожающей жизни инфекции ежедневно следует переливать лейкоцитную массу, обогащенную нейтрофилами, хотя вопрос об их использовании остается спорным. У больных с хроническим гранулематозом профилактическое введение антибиотиков (триметоприм-сульфаметоксазол, или бактрим), вероятно, снижает частоту особо опасных инфекций. Тщательная санация полости рта уменьшает, но не снимает полностью чувство дискомфорта при гингивите, болезни периодонта и афтозных язвах; помогает некоторым больным чистка зубов пастой, содержащей перекись водорода и гидробикарбонат натрий; Кетоконазол может привести к улучшению состояния при кожно-слизистом кандидозе у больных с рецидивирующими инфекциями и гипер-IgE (синдром Джоба). Лечение, направленное на восстановление миелопоэза у больных с нейтропенией, обусловленной снижением продукции клеток, предусматривает использование андрогенов, глюкокортикоидов, препаратов лития и иммуносунрессантов. Научно обосновано и лечение при некоторых врожденных дефектах фагоцитарной системы с помощью трансплантации костного мозга, и хотя при этом развиваются довольно серьезные осложнения, тщательный врачебный контроль и оптимальная терапия позволяют исключить развитие жизненно опасных инфекций в течение нескольких лет у больных с нарушениями клеток фагоцитарной системы.
Список литературы
Adams D. О. Macrophage activation and secretion. — Fed. Proc. 1982, 41:2193.
Anderson D. С. et al. The severe and moderate phenotypes of heritable Mad, LFA-1 deficiency: Their quantitative definition and relation to leukocyte dysfunction and clinical features. — J. Infect. Dis., 1985, 152:668.
ВаЫог В. М. The respiratory burst of phagocytes. — J- Clin. Invest., 1984, 73:599.
Buescher E. S. et al. Use of an X-linked human neutrophil marker to estimate timing of Lyonization and size of the dividing stem cell pool. — J. Clin. Invest., 1985, 76:1581.
Dale D. C. et al. Chronic neutropenia. — Medicine, 1979, 38:128.
Dinarello С. A. Interleukin I. — Rev. Infect. Dis., 1984, 6:51.
Donabedian П., Gallin J. I. The hyperimmunoglobulin E-recurrent infection (Job’s) syndrome. A review of the NIH experience and the literature. — Medicine, 1983, 62:195.
Dreskin S. С. et al. Immunoglobulins in the hyperimmunoglobulin E and recurrent infection (Job’s) syndrome. Deficiency of anti-Staphylococcus aureus immuno-globulin A. —J. Clin. Invest., 1985, 75:26.
Fauci A. S. et al. The idiopathic hypereosinophilic syndrome: Clinical pathophy-siologic, and therapeutic considerations. — Ann. Intern. Med., 1982, 97:78.
Gallin J. I. Abnormal phagocyte chemotaxis: Pathophysiology, clinical manifestations, and management of patients. — Rev. Infect. Dis„ 1981, 3:1196.
Gallin J. 1. Neutrophil heterogeneity exists, but is it meaningful? Blood, 1984, 63:977
Gallin J. I. Neutrophil specific granule deficiency. — Ann. Rev. Med., 1985, 36:
263.
Gallin J. /.. Eauci A. S. (eds) Advances in Host Defense Mechanisms. —Vol. 1. — Phagocytic Cells—New York: Raven, 1982.
Gallin J. I. et al. Recent advances in chronic granulomatous disease.—Ann. Intern. Med., 1983, 99:657.
Gleich G. /., Loegeung D. A. Immunobiology of eosinophils. — Ann. Rev. Irnmunol 1984, 2:429.
Smith P. D. et al. Monocyte function in the acquired immune deficiency syndrome.
Defective chemotaxis. — J. Clin. Invest., 1984, 74:2121.
Tauber A. I. et al. Chronic granulomatous disease: A syndrome of phagocyte oxida-se deficiences. — Medicine, 1983, 62:286
Источник: xn--80ahc0abogjs.com