Что делают рибосомы
Рибосомы (ribosome) является немембранные органелл клетки, состоящий из рРНК и рибосомных белков (протеинов). Рибосомы осуществляет биосинтез белков транслируя с мРНК полипептидную цепь. Таким образом, рибосому можно считать фабрикой, производящей белки, основываясь на имеющейся генетической информации. В клетке созревшие рибосомы находятся преимущественно в компартментах, для активного белкового синтеза. Они могут свободно плавать в цитоплазме или быть прикрепленными к цитоплазматического стороны мембран эндоплазматического ретикулума или ядра. Активные (те что есть в процессе трансляции) рибосомы находятся преимущественно в виде полисом. Существует ряд свидетельств, указывающих на то, что рибосома является рибозимов.
Исторический обзор
Рибосомы было обнаружено в начале 1950-х годов. Первое глубокое исследование и описание рибосом, как клеточных органелл, было совершено Джорджем Паладе (George E. Palade). По имени исследователя, рибосомы были названы «частицами Паладе», но впоследствии, в 1958 году, их было переименовано в «рибосомы», учитывая высокое содержание РНК. Роль рибосом в биосинтезе белков было установлено более десятилетием позже.
Синтетическая рибосома
После отсоединения от мРНК и началом нового раунда трансляции рибосомальные малая и большая субъединицы отделяются друг от друга. Поэтому, создание синтетической рибосомы было технически сложным, поскольку синтетические и имеющиеся в клетке субъединицы смешивались от раунда к раунду трансляции.
Начиная с конца 90-х годов 20 века удалось создать несколько видов мутантных малых субъединиц рибосомы, которые имели специфическую последовательность в 16S рРНК и соединялись с мРНК, в которой последовательность Шайна-Дальгарно была специфически синтезирована для взаимодействия с модифицированной 16S рРНК. Это позволило выполнять отбор мутировавших малых субъединиц РНК от нативных и интрудукуваты несколько мутаций для изучения свойств синтеза белка.
Однако большая рибосомальная субъединица представила проблемы, поскольку при создании синтетического варианта не бело возможности заставить его отделяться от мРНК или от малой субъединицы после завершения одного раунда трансляции. Большая субъединица содержит важные для изучения структуры, такие как канал для выхода синтезируемого белка и сайт PTC (англ. Peptidyl transferase centre), в котором происходит соединение аминокислоты, присоединена к тРНК, которая находятся на А-сайте рибосомы, к пептидильного цепи , который соединен к молекуле тРНК, которая находится на P-сайи рибосомы
В июле 2015 года удалось синтезировать первую полностью синтетическую рибосому. Для того, чтобы большая и малая субъединицы НЕ отсоединялись, их было связано в одну молекулу путем синтеза 16S-23S конструкта (Ribo-T). Такая синтетическая рибосома успешно выполняла синтез белка не только in vitro, но и поддерживала рост E.coli при вынужденной отсутствия нативных рибосом.
Строение рибосомы
Общее строение
Рибосомы прокариот и эукариот очень похожи по строению и функции, но отличаются размером. Они состоят из двух субъединиц: одной большой и одной малой. Для процесса трансляции необходимо слаженное взаимодействие обеих субъединиц, вместе составляют комплекс с молекулярной массой несколько миллионов Дальтон (Da). Субъединицы рибосом обычно обозначаются единицами Сведберга (S), является мерой скорости седиментации при центрифугирования и зависят от массы, размера и формы частицы. Обозначены в этих единицах, большая субъединица является 50S или 60S (прокариотические или эукариотические, соответственно), имела является 30S или 40S, и целая рибосома (комплекс малой вместе с большой) 70S или 80S.
Молекулярный состав
Молекулярный состав рибосом является достаточно сложным. Например, рибосома дрожжей "Saccharomyces cerevisiae" состоит из 79 рибосомных белков и 4 различных молекул рРНК. Биогенез рибосом также чрезвычайно сложным и многоступенчатым процессом, происходящим в ядре и ядрышке эукариотической клетки.
Атомная структура большой субъединицы (50S) организма Haloarcula marismortui была опубликована N. Ban et al. В журнале Science 11 августа 2000. Вскоре после этого, 21шого сентября 2000 года, BT Wimberly, et al., Опубликовали в журнале Nature структуру 30S субъединицы организма Thermus thermophilus. Используя эти координаты, MM Yusupov, et al. Сумели реконструировать целую 70S частичку Thermus thermophilus и опубликовать ее в журнале Science, в Мае 2001 В 2009 году профессор Джордж Чьорч (George Church) и коллеги из Гарварда создали полностью функциональную искусственную рибосому в обычных условиях , которые присутствуют в клеточном среде. Как конструкционные элементы использовались молекулы с расщепленной с помощью энзимов кишечной палочки. Созданная рибосома успешно синтезирует белок, отвечающий за биолюминесценцию.
Центры связывания РНК
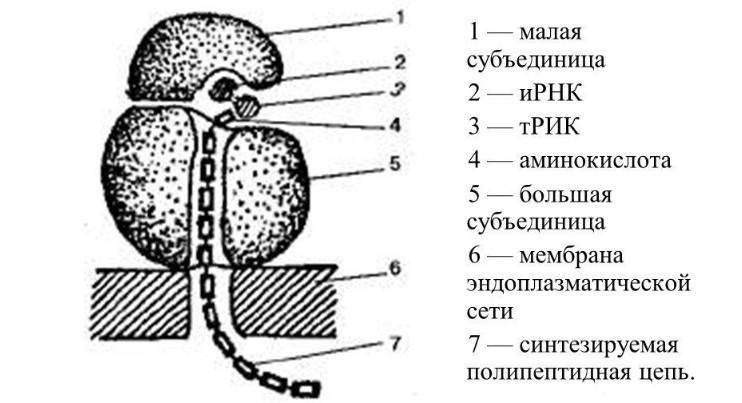
Рибосомы содержит четыре сайты связывания для молекул РНК: один для мРНК и три для тРНК. Первый сайт связывания тРНК называется сайтом 'аминоацил-тРНК ", или" А-сайтом ". В этом сайте содержится молекула тРНК "заряженная" "следующей" аминокислотой. Другой сайт, "пептидил-тРНК 'связывающий, или" P-сайт ", содержит молекулу тРНК, связывает растущий конец полипептидной цепи. Третий сайт, это "сайт выхода", или "E-сайт". В этот сайт попадает пустая тРНК которая избавилась растущего конца полипептида, после его взаимодействия с последующей "заряженной" аминокислотой в пептидильному сайте. Сайт связывания мРНК находится в малой субъединицы. Он удерживает рибосому "нанизанной" на мРНК которую рибосома транслирует.
Функция
Рибосомы являются органелл, на которой происходит трансляция генетической информации, закодированной в мРНК. Эта информация воплощается в синтезированный тут же полипептидную цепь. Рибосомы несет двоякую функцию: является структурной платформой для процесса декодирования генетической информации с РНК, и владеет каталитическим центром ответственным за формирование пептидной связи, так называемым "пептидил-трансферазним центром". Считается пептидил-трансферазна активность ассоциируется с рРНК, и поэтому рибосома является рибозимов.
Локализация рибосом
Рибосомы классифицируются как свободные (находятся в гиалоплазме) и несвободные или прикрепленные (связанные с мембранами эндоплазматической сети).
Свободные и прикреплены рибосомы отличаются только локализацией, но они структурно идентичны. Рибосому называют свободной или прикрепленной в зависимости от того белок синтезируемый имеет ЭР-нацеленную сигнальную последовательность, поэтому индивидуальная рибосома может быть прикрепленной создавая один белок, но свободной в цитозоле когда создает другой белок.
Рибосомы иногда называют органеллами, но использование термина органеллы ограничивается субклеточном компонентами которых фосфолипидную мембрану, а рибосома (being entirely particulate) таковой не является. Поэтому рибосомы иногда описывают как "немембранные органеллы".
Общая информация
В эукариотических организмах рибосомы можно найти не только в цитоплазме, но и внутри в некоторых крупных мембранных органеллах, в частности в митохондриях и хлоропластах. Строение и молекулярный состав этих рибосом отличается от состава обще-клеточных рибосом, и является близким в состав рибосом прокариот. Такие рибосомы синтезируют органелл-специфические белки, транслируя органелл-специфическую мРНК.
В эукариотических клетках долгое время считалось, что рибосомы, прикрепленные к эндоплазматического ретикулума выполняют синтез белков, которые будут секретируемого наружу или трансмембранных или других сигнальных белков, присоединенных к плазмалеммы. Рибонуклеопротеин SRP (англ. Signal recognition particle) выполняет распознавание тех белков в процессе синтеза, которые должны быть трансмембранными и присоединяет рибосому к эндоплазматического ретикулума. Однако в последнее время исследования указывают, что 50-75% рибосом могут быть прикреплены к ЭПР за не до конца выяснены механизмы и большинство белков в клетке проходит синтез в рибосомах, прилегающих к ЭПР. Так, в клеточной линии HEK-293 75% мРНК видповидяе цитозольным белкам, однако до 50% рибосом связанные с ЭПР.
Болезни
Считается, что генетические дефекты рибосомных белков и факторов биогенеза рибосом является летальными на ранних эмбриональных стадиях развития высших организмов. Экспериментальный мутагенез рибосомных белков в Drosophila melanogaster (мутации minute) вызывает общий фенотип: заниженная скорость митоза, уменьшен размер тела, заниженная фертильность, короткие реснички. Существует ряд свидетельств связывающих раковую трансформацию клеток млекопитающих с расстройствами трансляционной системы в целом и расстройствами системы биогенеза рибосом в частности.
Источник: info-farm.ru
План:
Введение
1. История исследований рибосомы
2. Строение и функции, разновидности рибосом
3. Принципы функционирования, роль РНК
4. Список литературы
Введение
Различают два осн. типа Р. Всем прокариотич. организмам (бактерии и синезеленые водоросли) свойственны т. наз. 70S Р., характеризующиеся коэф. (константой) седиментации ок. 70 единиц Сведберга, или 70S (по коэф. седиментации различают и Р. др. типов, а также субчастицы и биополимеры, входящие в состав Р.). Их мол. м. составляет 2,5 · 10 6 , линейные размеры 20-25 нм. По хим. составу это рибонуклеопротеиды; они состоят только из рРНК и белка (соотношение этих компонентов 2:1). Рибо-сомная РНК в Р. присутствует гл. обр. в виде Mg-соли (по-видимому, частично и в виде Са-соли); магния в Р. до 2% от сухой массы. Кроме того, в разл. кол-вах (до 2,5%) могут присутствовать также катионы аминов-спермина H 2 N(CH 2 ) 3 NH(CH 2 ) 4 NH(CH 2 ) 3 NH 2 , спермидина H 2 N(CH 2 ) 3 NH(CH 2 ) 4 NH 2 и др.
Цитоплазма клеток всех эукариотич. организмов содержит неск. более крупные 80S Р. Их мол. м. ок. 4·10 6 , линейные размеры 25-30 нм, содержание белка в них значительно больше, чем в прокариотической Р. (соотношение РНК: белок ок. 1:1). Рибосомная РНК 80S также связана в осн. с Mg и Са и с небольшим кол-вом полиаминов (спермин, спермидин и др.).
Хлоропласты и митохондрии эукариотич. клеток содержат Р., отличные от типа 80S. Р. хлоропластов высших растений принадлежат к истинному 70S типу. Митохонд-риальные Р. более разнообразны; их строение находится в зависимости от таксономич. принадлежности организма (т.е. от принадлежности к определенному виду, роду или семейству). Напр., митохондриальные Р. млекопитающих существенно мельче типичных 70S Р.; коэф. седиментации этих Р. составляет ок. 55S (т. наз. минирибосомы).
Р. из самых разнообразных организмов (как прокариотич., так и эукариотич.) имеют сходное строение. Они состоят из двух разделяемых субчастиц, или рибосомных субъединиц. При определенных условиях (напр., при понижении концентрации Mg 2 + в среде) Р. обратимо диссоциирует на две субчастицы с соотношением их мол. масс ок. 2:1. Прокарйотическая 70S Р. диссоциирует на субъединицы с коэф. седиментации 50S (мол. м. 1,5·10 6 ) и 30S (мол. м. 0,85·10 6 ). Эукариотическая Р. разделяется на субчастицы 60S и 40S. Две рибосомные субчастицы объединены в полную Р. строго определенным образом, предполагающим специфич. контакты их поверхностей.
Как прокариотические, так и эукариотические Р. содержат две разл. высокомол. рРНК (по одной на каждую субчастицу) и одну относительно низкомол. рРНК в большой субчастице.
Рибосомные белки большинства животных представлены в осн. умеренно основными полипептидами, хотя имеется неск. нейтральных и кислых белков. Мол. м. рибосомных белков варьирует от 6 тыс. до 60 тыс. В прокариотической Р. малая субчастица (30S) содержит ок. 20, большая (508)-ок. 30 разл. белков; в эукариотической P. 40S субчастица включает ок. 30 белков, а 60S-ок. 40 (обычно Р. не содержат двух или неск. одинаковых белков). Рибосомные белки характеризуются глобулярной компактной конформацией с развитой вторичной и третичной структурой; они занимают преим. периферич. положение в ядре, состоящем из рРНК. В отличие от вирусных нуклеопротеидов в структурно асим. рибосомном нуклеопротеиде рРНК не покрыта сплошной белковой оболочкой, а в ряде мест образует пов-сть Р. Плотность упаковки рРНК в Р. достаточно высока и приблизительно соответствует плотности кристаллич. упаковки гидратир. полинуклеотидов.
По-видимому, рРНК определяет осн. структурные и функцион. св-ва Р, в частности обеспечивает целостность рибосомных субъединиц, обусловливает их форму и ряд структурных особенностей. Специфич. пространств. структура рРНК детерминирует локализацию всех рибосомных белков, играет ведущую роль в организации функцион. центров Р.
Рибосомный синтез белка-многоэтапный процесс. Первая стадия (инициация) начинается с присоединения матричной РНК (мРНК) к малой рибосомной субчастице, не связанной с большой субчастицей. Характерно, что для начала процесса необходима именно диссоциированная Р. К образовавшемуся т. наз. инициаторному комплексу присоединяется большая рибосомная субчастица. В стадии инициации участвуют спец. инициирующий кодон (см. Генетический код), инициаторная транспортная РНК (тРНК) и специфич. белки (т. наз. факторы инициации). Пройдя стадию инициации, Р. переходит к последоват. считыванию кодонов мРНК по направлению от 5'- к 3'-концу, что сопровождается синтезом полипептидной цепи белка, кодируемого этой мРНК (подробнее о механизме синтеза полипептидов см. в ст. Трансляция). В этом процессе Р. функционирует как циклически работающая мол. машина. Рабочий цикл Р. при элонгации состоит из трех тактов: 1) кодонзави-симого связывания аминоацил-тРНК (поставляет аминокислоты в Р.), 2) транспептидации-переноса С-конца растущего пептида на аминоацил-тРНК, т.е. удлинения строящейся белковой цепи на одно звено, 3) транслокации-перемещения матрицы (мРНК) и пептидил-тРНК относительно Р. и переход Р. в исходное состояние, когда она может воспринять след. аминоацил-тРНК. Когда Р. достигнет специального терминирующего кодона мРНК, синтез полипептида прекращается. При участии специфич. белков (т. наз. факторов терминации) синтезир. полипептид освобождается из Р. После терминации Р. может повторить весь цикл с др. цепью мРНК или др. кодирующей последовательностью той же цепи.

Схема синтеза полипептидной цепи полирибосомой: I-начал о синтеза, II-окончание синтеза; а-мРНК, б-рибосома, в-большая субъединица рибосомы, г-малая субъединица рибосомы.
В клетках с интенсивной секрецией белка и развитым эндоплазматич. ретикулумом значит. часть цитоплазмати-ческой Р. прикреплена к его мембране на пов-сти, обращенной к цитоплазме. Эти Р. синтезируют полипептиды, к-рые непосредственно транспортируются через мембрану для дальнейшей секреции. Синтез полипептидов для внутриклеточных нужд происходит в осн. на свободных (не связанных с мембраной) Р. цитоплазмы. При этом транслирующие Р. не равномерно диспергированы в цитоплазме, а собраны в группы. Такие агрегаты Р. представляют собой структуры, где мРНК ассоциирована со многими Р., находящимися в процессе трансляции; эти структуры получили назв. полирибосом или полисом.
При интенсивном синтезе белка расстояние между Р. вдоль цепи мРНК в полирибосоме м. б. предельно коротким, т.е. Р. находятся почти вплотную друг к другу. Р., входящие в полирибосомы, работают независимо и каждая из них синтезирует полную полипептидную цепь (см. рис.).
Р ибосома — это округлая рибонуклеопротеиновая частица диаметром 20—30 нм. Она состоит из малой и большой субъединиц, объединение которых происходит в присутствии матричной (информационной) РНК (мРНК). Одна молекула мРНК обычно объединяет несколько рибосом наподобие нитки бус. Такую структуру называют полисомой. Полисомы свободно располагаются в основном веществе цитоплазмы или прикреплены к мембранам шероховатой цитоплазматической сети. В обоих случаях они служат местом активного синтеза белка. Сравнение соотношения количества свободных и прикрепленных к мембранам полисом в эмбриональных недифференцированных и опухолевых клетках, с одной стороны, и в специализированных клетках взрослого организма —с другой, привело к заключению, что на полисомах гиалоплазмы образуются белки для собственных нужд (для «домашнего» пользования) данной клетки, тогда как на полисомах гранулярной сети синтезируются белки, выводимые из клетки и используемые на нужды организма (например, пищеварительные ферменты, белки грудного молока). Рибосомы. Так же как и эндоплазматическая сеть, рибосомы были открыты только с помощью электронного микроскопа. Рибосомы — самые маленькие из клеточных органелл.
Рибосомы либо располагаются на поверхности мембраны гранулярной ЭПС в один ряд, либо образуют розетки и спирали. В тех клетках, где хорошо развита гранулярная ЭПС, например, в полностью дифференцированных клетках печени и поджелудочной железы, большинство рибосом связано с ее мембранами. В клетках же, где гранулярная ЭПС развита слабо, рибосомы преимущественно свободно располагаются в основном веществе цитоплазмы. К клеткам такого типа относятся плазмоциты лимфатических узлов и селезенки, овоциты человека и ряд других. Помимо цитоплазмы, рибосомы обнаружены и в клеточном ядре, где они имеют такую же округлую форму, строение и размеры, как и рибосомы цитоплазмы. Часть ядерных рибосом свободно располагается в кариоплазме, а часть их находится в связи с нитевидными структурами, из которых состоят остаточные хромосомы, обнаруживаемые обычно при электронномикроскопическом исследовании интерфазного ядра. В последнее время рибосомы обнаружены в митохондриях и пластидах клеток растений.
Биохимический анализ рибосом, полученных путем дифференциального центрифугирования клеточных гомогенатов, показал, что в состав их входит высокополимерная, так называемая рибосомальная РНК и белок. Соотношение этих двух компонентов в рибосомах почти одинаково.
Белок рибосом самых разнообразных клеток и разных организмов в общем одинаков по составу аминокислот, причем в нем часто преобладают основные аминокислоты, а следовательно, белки рибосом имеют …? свойства. Рибосомы содержат также Mg2+.
Функции рибосом. Исследование ультраструктуры клеток многочисленных видов многоклеточных растений и животных, бактерий и простейших показало, что рибосомы — обязательный органоид каждой клетки. Наличие этого органоида во всех клетках, однородность его строения и химического состава свидетельствуют о важной роли рибосом в жизнедеятельности клеток. Было выяснено, что на рибосомах происходит синтез белков.
В процессах биосинтеза белка роль рибосом заключается в том, что к ним из основного вещества цитоплазмы непрерывно подносятся с помощью т-РНК аминокислоты, и происходит укладка этих аминокислот в полипептидные цепи в строгом соответствии с той генетической информацией, которая передается из ядра в цитоплазму через и-РНК, постоянно поступающую к рибосомам. На основании такой функции рибосом в белковом синтезе можно назвать их своего рода "сборочными конвейерами", на которых в клетках образуются белковые молекулы.
Источник: mirznanii.com
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов [1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции» [2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона [9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Источник: dic.academic.ru
Особенности строения
Рибосомы находятся на гранулярном эндоплазматическом ретикулуме или свободно плавают в цитоплазме. Крепятся они к эндоплазматической сети своей большой субъединицей и синтезируют белок, который выводится за пределы клетки, используется всем организмом. Цитоплазменные рибосомы в основном обеспечивают внутренние потребности клетки.

Форма шаровидная или овальная, в диаметре около 20нм.
На этапе трансляции к мРНК может прикрепляться несколько рибосом, образуя новую структуру – полисому. Сами же они образуются в ядрышке, внутри ядра.
Выделяют 2 вида рибосом:
- Малые – находятся в прокариотических клетках, а также в хлоропластах и митохондриальном матриксе. Они не связаны с мембраной и имеют меньшие размеры (в диаметре до 15нм).
- Большие – находятся в эукариотических клетках, могут достигать в диаметре до 23нм, связываются с эндоплазматической сетью или крепятся к мембране ядра.

Строение обоих видов идентичное. В состав рибосомы входят две субъединицы — большая и малая, которые в сочетании напоминают гриб. Объединяются они при помощи ионов магния, сохраняя между соприкасающимися поверхностями небольшую щель. При дефиците магния субъединицы отдаляются, происходит дезагрегация и рибосомы уже не могут выполнять свои функции.
Химический состав
Рибосомы состоят из высокополимерной рибосомальной РНК и белка в соотношении 1:1. В них сосредоточено примерно 90% всей клеточной РНК. Малая и большая субъединицы содержат около четырех молекул рРНК, которая имеет вид нитей собранных в клубок. Окружены молекулы белками и формируют вместе рибонуклеопротеид.
Полирибосомы – это объединение информационной РНК и рибосом, которые нанизываются на нить иРНК. В период отсутствия синтезирующих процессов, рибосомы разъединяются и обмениваются субъединицами. При поступлении иРНК они снова собираются в полирибосомы.
Количество рибосом может изменяться в зависимости от функциональной нагрузки на клетку. Десятки тысяч находятся в клетках с высокой митотической активностью (меристема растений, стволовые клетки).
Образование в клетке
Субъединицы рибосом формируются в ядрышке. Матрицей для синтеза рибосомальной РНК является ДНК. Для полного созревания они проходят несколько этапов:
- Эосома – первая фаза, при этом в ядрышке на ДНК синтезируется лишь рРНК;
- неосома – структура включающая не только рРНК, но и белки, после ряда модификаций выходит в цитоплазму;
- рибисома – зрелая органелла, состоящая из двух субъединиц.
| Функции элементов рибосом | ||
|---|---|---|
| Большая субъединица | Большая субъединица Треугольная, в диаметре 16нм, состоит из 3 молекул РНК и 33 белковых молекул Трансляция, декодирование генетической информации | Трансляция, декодирование генетической информации |
| Малая субъединица | Вогнутая, овальная, в диметре 14нм, состоит из 1 молекулы РНК и 21 белковых молекул | Объединение аминокислот, создание пептидных связей, синтез новых молекул белка |
Биосинтез белков на рибосомах
Трансляция или синтез белков на рибосомах с матрицы иРНК – конечный этап преобразования генетической информации в клетках. Во время трансляции информация, закодированная в нуклеиновых кислотах, переходит в белковые молекулы со строгой последовательностью аминокислот.
Трансляция – весьма непростой этап (в сравнении с репликацией и транскрипцией). Для проведения трансляции в процесс включаются все виды РНК, аминокислот, множество ферментов, которые могут исправлять погрешности друг друга. Самые важные участники трансляции – это рибосомы.
После транскрипции, новообразованная молекула иРНК, выходит из ядра в цитоплазму. Здесь после нескольких преобразований она соединяется с рибосомой. При этом аминокислоты приводятся в действие после взаимодействия с энергетическим субстратом – молекулой АТФ.
Аминокислоты и иРНК имеют разный химический состав и без постороннего участия не могут взаимодействовать между собой. Для преодоления этой несовместимости существует транспортная РНК. Под действием ферментов аминокислоты соединяются с тРНК. В таком виде они переносятся на рибосому и тРНК, с определенной аминокислотой, прикрепляется на иРНК в предназначенном месте. Далее рибосомальные ферменты формируют пептидную связь между присоединенной аминокислотой и строящимся полипептидом. После рибосома перемещается по цепи информационной РНК, оставляя участок для прикрепления следующей аминокислоты.
Рост полипептида идет до того момента, пока рибосома не встретит «стоп-кодон», который сигнализирует об окончании синтеза. Для освобождения новосинтезированного пептида от рибосомы включаются факторы терминации, окончательно завершающие биосинтез. К последней аминокислоте прикрепляется молекула воды, а рибосома распадается на две субъединицы.
Когда рибосома продвигается дальше по иРНК, она освобождает начальный отрезок цепи. К нему снова может присоединиться рибосома, которая начнет новый синтез. Таким образом, используя одну матрицу для биосинтеза, рибосомы создают одномоментно множество копий белка.
Роль рибосом в организме
- Рибосомы синтезируют белок для собственных нужд клетки и за ее пределы. Так в печени образуются плазменные факторы свертывания крови, плазмоциты продуцируют гамма-глобулины.
- Считывание закодированной информации с РНК, соединение аминокислот в запрограммированном порядке с образованием новых белковых молекул.
- Каталитическая функция – формирование пептидных связей, гидролиз ГТФ.
- Свои функции в клетке рибосомы выполняют более активно в виде полирибосом. Эти комплексы способны одновременно синтезировать несколько молекул белка.
Источник: animals-world.ru