Тилакоиды хлоропластов
tilacoides они представляют собой компартменты в форме плоских мешочков, расположенных внутри хлоропластов в растительных клетках растений, у цианобактерий и водорослей. Они обычно организованы в структуру под названием grana-множественное число Granum- и похоже на стопку монет.
Тилакоиды считаются третьей мембранной системой хлоропластов, помимо внутренней и внешней мембран указанной органеллы. Мембрана этой структуры отделяет внутреннюю часть тилакоида от стромы хлоропласта и содержит ряд пигментов и белков, участвующих в метаболических путях..

В тилакоидах биохимические реакции необходимы для фотосинтеза, процесса, посредством которого растения принимают солнечный свет и превращают его в углеводы. В частности, у них есть необходимый механизм, прикрепленный к их мембране для проведения фазы, зависящей от солнечного света, где свет захватывается и преобразуется в энергию (АТФ) и НАДФН..
индекс
- 1 Общая характеристика
- 2 Структура
- 2.1 Тилакоидная мембрана
- 2.2 Липидный состав мембраны
- 2.3 Белковый состав мембраны
- 2.4 Люмен тилакоида
- 3 функции
- 3.1 Этапы фотосинтеза
- 3.2 Этап зависит от света
- 3.3 Фотофосфорилирование
- 4 Эволюция
- 5 ссылок
Общие характеристики
Тилакоиды — это внутренняя трехмерная мембранная система хлоропластов. Полностью зрелые хлоропласты имеют от 40 до 60 зерен с диаметром от 0,3 до 0,6 мкм..
Количество тилакоидов, составляющих граны, варьируется в широких пределах: от менее чем 10 мешков у растений, подверженных воздействию достаточного количества солнечного света, до более чем 100 тилакоидов у растений, которые живут в средах с экстремальной тенью..
Сложенные тилакоиды связаны друг с другом, образуя непрерывный компартмент внутри хлоропласта. Интерьер тилакоида представляет собой довольно просторное отделение водной природы.
Мембрана тилакоидов необходима для фотосинтеза, так как там происходит первая стадия процесса..
структура
Тилакоиды — это структуры, которые доминируют в полностью зрелом хлоропласте. Если хлоропласт визуализируется в традиционном оптическом микроскопе, можно наблюдать некоторые виды зерен.
Это тилакоидные стеки; поэтому первые наблюдатели этих структур назвали их «грана».

С помощью электронного микроскопа изображение можно было увеличить, и был сделан вывод о том, что в природе этих зерен на самом деле были сложены тилакоиды.
Образование и структура тилакоидной мембраны зависит от образования хлоропласта из пластиды, еще не дифференцированной, известной как протопластидий. Присутствие света стимулирует преобразование в хлоропласты, а затем образование сложенных тилакоидов.
Тилакоидная мембрана
У хлоропластов и цианобактерий тилакоидная мембрана не контактирует с внутренней частью плазматической мембраны. Однако формирование тилакоидной мембраны начинается с инвагинации внутренней мембраны.
У цианобактерий и некоторых видов водорослей тилакоиды образованы одним слоем ламелл. Напротив, в зрелых хлоропластах существует более сложная система..
В этой последней группе можно выделить две основные части: грану и ламеллу стромы. Первый состоит из небольших уложенных дисков, а второй отвечает за соединение этих стеков друг с другом, образуя непрерывную структуру: просвет тилакоида.
Липидный состав мембраны
Липиды, которые составляют мембрану, являются высоко специализированными и состоят почти из 80% галактозилдиацилглицерина: моногалактозилдиацилглицерина и дигалактозилдиацилглицерина. Эти галактолипиды имеют высоконенасыщенные цепи, типичные для тилакоидов.
Таким же образом, тилакоидная мембрана содержит липиды, такие как фосфатидилглицерин, в более низкой пропорции. Упомянутые липиды не распределены гомогенно в обоих слоях мембраны; Существует определенная степень асимметрии, которая, кажется, способствует функционированию структуры.
Белковый состав мембраны
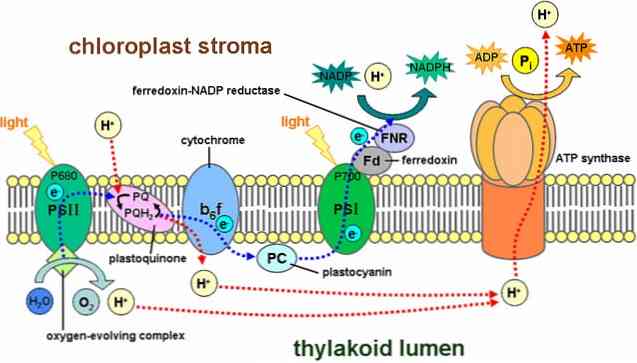
Фотосистемы I и II являются доминирующими белковыми компонентами в этой мембране. Они обнаружены связанными с комплексом цитохрома b6F и АТФ-синтетазы.
Было обнаружено, что большинство элементов фотосистемы II расположены в уложенных грана мембранах, в то время как фотосистема I находится в основном в не уложенных тилакоидных мембранах. То есть между двумя фотосистемами существует физическое разделение.
Эти комплексы включают цельные мембранные белки, периферические белки, кофакторы и различные пигменты..
Люмен тилакоида
Внутренняя часть тилакоида состоит из водного и густого вещества, состав которого отличается от состава стромы. Он участвует в фотофосфорилировании, сохраняя протоны, которые будут генерировать протон-моторную силу для синтеза АТФ. В этом процессе рН просвета может достигать 4.
В протеоме просвета модельного организма Arabidopsis thaliana более 80 белков были идентифицированы, но их функции не были полностью выяснены.
Белки люмена участвуют в регуляции биогенеза тилакоидов, а также в активности и обмене белков, образующих фотосинтетические комплексы, особенно фотосистемы II и NAD (P) H дегидрогены..
функции
Процесс фотосинтеза, жизненно важный для овощей, начинается в тилакоидах. Мембрана, которая ограничивает их с помощью хлоропластной стромы, обладает всеми ферментативными механизмами, необходимыми для протекания фотосинтетических реакций..
Этапы фотосинтеза
Фотосинтез можно разделить на две основные стадии: светлые реакции и темные реакции.
Как следует из названия, реакции, относящиеся к первой группе, могут протекать только в присутствии света, тогда как реакции во второй группе могут возникать с ним или без него. Обратите внимание, что не обязательно, чтобы среда была «темной», она не зависит только от света.
Первая группа реакций, «люминесцентная», происходит в тилакоиде и может быть обобщена следующим образом: свет + хлорофилл + 12 H2O + 12 NADP+ + 18 ADP + 18 PЯ а 6 о2 + 12 НАДФН + 18 АТФ.
Вторая группа реакций происходит в строме хлоропластов и принимает АТФ и НАДФН, синтезированные на первой стадии, для восстановления углерода от диоксида углерода до глюкозы (C6H12О6). Второй этап можно суммировать следующим образом: 12 НАДФН + 18 АТФ + 6 СО2 à C6H12О6 + 12 НАДП+ + 18 ADP + 18 PЯ + 6 ч2О.
Этап зависит от света
Световые реакции включают ряд структур, известных как фотосистемы, которые находятся в тилакоидной мембране и содержат около 300 молекул пигмента, включая хлорофилл..
Существует два типа фотосистем: первый имеет максимальный пик поглощения света 700 нанометров и известен как P700, в то время как второй называется P680. Оба встроены в тилакоидную мембрану.
Процесс начинается, когда один из пигментов поглощает фотон, и это «отскакивает» от других пигментов. Когда молекула хлорофилла поглощает свет, один электрон прыгает, а другая молекула поглощает его. Молекула, потерявшая электрон, теперь окисляется и имеет отрицательный заряд.
P680 улавливает световую энергию от хлорофилла а. В этой фотосистеме электрон брошен в систему с более высокой энергией в первичный акцептор электронов.
Этот электрон попадает в фотосистему I, проходя через цепь переноса электронов. Эта система реакций окисления и восстановления отвечает за перенос протонов и электронов из одной молекулы в другую..
Другими словами, существует поток электронов из воды в фотосистему II, фотосистему I и НАДФН..

фотофосфорилирование
Часть протонов, генерируемых этой системой реакций, находится внутри тилакоида (также называемого тилакоидным светом), создавая химический градиент, который генерирует протонно-моторную силу.
Протоны движутся из пространства тилакоида в строму, благоприятно следуя электрохимическому градиенту; то есть они покидают тилакоид.
Однако прохождение протонов не происходит нигде в мембране, они должны делать это через сложную ферментную систему, называемую АТФ-синтетазой..
Это движение протонов в направлении стромы вызывает образование АТФ, начиная с АДФ, процесс, аналогичный тому, который происходит в митохондриях. Синтез АТФ с использованием света называется фотофосфорилированием.
Эти упомянутые стадии происходят одновременно: хлорофилл в фотосистеме II теряет электрон и должен заменить его электроном, возникающим при разрыве молекулы воды; фотосистема I задерживает свет, окисляет и выпускает электрон, который улавливается НАДФ+.
Отсутствующий электрон фотосистемы I заменяется электроном, полученным в результате фотосистемы II. Эти соединения будут использоваться в последующих реакциях углеродной фиксации, в цикле Кальвина.
эволюция
Эволюция фотосинтеза как процесса выделения кислорода позволила нам жить так, как мы ее знаем.
Предполагается, что фотосинтез развился несколько миллиардов лет назад у предка, который дал начало нынешним цианобактериям из аноксического фотосинтетического комплекса..
Предполагается, что эволюция фотосинтеза сопровождалась двумя обязательными событиями: созданием фотосистемы Р680 и генезис системы внутренних мембран, без связи с клеточной мембраной.
Существует белок под названием Vipp1, необходимый для образования тилакоидов. Действительно, этот белок присутствует в растениях, водорослях и цианобактериях, но отсутствует в бактериях, которые осуществляют аноксический фотосинтез.
Считается, что этот ген может возникать путем дупликации гена у возможного предка цианобактерий. Существует только один случай цианобактерий, который способен к фотосинтезу с кислородом и не обладает тилакоидами: вид Gloeobacter violaceus.
ссылки
- Берг JM, Tymoczko JL, Страйер Л. (2002). Биохимия. 5-е издание. Нью-Йорк: Ш Фриман. Резюме. Доступно по адресу: ncbi.nlm.nih.gov
- Купер Г.М. (2000). Клетка: молекулярный подход. 2-е издание. Сандерленд (Массачусетс): Sinauer Associates. Фотосинтез. Доступно по адресу: ncbi.nlm.nih.gov
- Кертис Х. & Шнек А. (2006). Приглашение к биологии. Ed. Panamericana Medical.
- Ярви, С., Голлан, П. Й., & Аро, Э. М. (2013). Понимание роли тилакоидного просвета в регуляции фотосинтеза. Границы в науке о растениях, 4, 434.
- Staehelin, L.A. (2003). Структура хлоропласта: от хлорофилловых гранул до надмолекулярного строения тилакоидных мембран. Исследование фотосинтеза, 76(1-3), 185-196.
- Taiz, L. & Zeiger, E. (2007). Физиология растений. Университет Жауме I.
- Vothknecht, U. C. & Westhoff P. (2001). Биогенез и происхождение тилакоидных мембран. Biochimica et Biophysica Acta (BBA) — исследование молекулярных клеток, 1541(1-2), 91-101.
Источник: ru.thpanorama.com
Строение тилакоида
Тилакоиды — это ограниченные мембраной структуры, расположенные в строме хлоропласта.
Мембрана
Мембрана тилакоида собственно и является тем местом, где протекают светозависимые реакции фотосинтеза. Эти реакции идут при участии фотосинтетических пигментов, расположенных непосредственно на мембране в виде перемежающихся темных и светлых полос шириной около 1 нм[1].
Липидный бислой тилакоида по свойствам схож с бактериальными мембранами, а также с внутренней мембраной хлоропласта. В его состав, например, входят кислые липиды, (также как у цианобактерий и других бактерий, способных к фотосинтезу), которые используются для поддержания функциональной целостности фотосистемы[2].
Мембраны тилакоидов у высших растений в основном состоят из фосфолипидов[3] и галактолипидов, которые распределены по мембране неравномерно[4].
Процесс синтеза липидов для тилакоидной мембраны довольно сложен, он включает в себя обмен предшественниками липидов между эндоплазматическим ретикулумом и внутренней мембраной оболочки пластиды, откуда сами липиды передаются на тилакоиды через транспорт везикул[5].
Просвет
Просвет тилакоида (люмен) — это компартмент, ограниченный тилакоидной мембраной. Он играет существенную роль в фотофосфорилировании в процессе фотосинтеза. Во время протекания светозависимых реакций протоны накачиваются через мембрану тилакоида в его люмен. pH просвета при этом может снижаться до 4.
Граны
|
Основная статья: Граны |
Граны — это стопки из тилакоидов, имеющих форму дисков. Хлоропласты могут содержать от 10 до 100 гран. Граны соединены строматическими тилакоидами, которые иногда называют также межграновыми тилакоидами, или ламеллами. Гранальные и агранальные тилакоиды различаются своим белковым составом.
Образование тилакоидов
Хлоропласты развиваются из пропластид, когда росток поднимается над поверхностью почвы. Для образования тилакоидов обязательно наличие света. В зародыше растения, равно как и в отсутствие света, пропластиды превращаются в этиопласты, обладающие полукристаллическими мембранами, которые называют проламеллярными телами.
д воздействием света эти проламеллярные тела превращаются в тилакоиды. Это, однако, не происходит у ростков, прорастающих в темноте; такие ростки подвергаются этиоляции. Недостаточная освещенность может привести к нарушению формирования тилакоидов. Это приводит к нефункциональности хлоропластов и в результате — к гибели растения.
Для образования тилакоидов также требуется белок VIPP1 (белок пластид 1, индуцирующий везикулярный транспорт, англ. vesicle-inducing protein in plastids 1). Растение погибает без этого белка, а его сниженная концентрация замедляет рост растения и вызывает его бледную окраску, а также снижает фотосинтетическую активность. VIPP1 требуется для формирования собственно тилакоидной мембраны, но не для сборки белковых комплексов на этой мембране[6].
Этот белок очень консервативен у всех организмов, содержащих тилакоиды, даже у сине-зелёных водорослей,[7] зеленых водорослей, например, хламидомонады[8] и высших растений, таких как арабидопсис[9].
Выделение и фракционирование тилакоидов
Тилакоиды могут быть выделены из растительной клетки при помощи комбинации дифференциального и градиентного центрифугирования[10]. Разрушение выделенных тилакоидов, например, за счет механического воздействия, позволяет выделить вещество люмена. Из оставшихся фрагментов мембраны можно извлечь также поверхностные и интегральные белки: обработка карбонатом натрия (Na2CO3) вызывает отделение поверхностных мембранных белков, тогда как обработка детергентами и органическими растворителями позволяет извлечь и интегральные мембранные белки.
Белки тилакоидов
Тилакоиды содержат множество интегральных и поверхностных мембранных белков. Много белков содержится и в веществе люмена. Недавние протеомные исследования[11] тилакоидных фракций позволили накопить много информации по белковому составу тилакоидов. Эти данные обобщены в нескольких базах данных по пластидным белкам, доступных в Интернете[12][13].
Как показали упомянутые исследования, протеом тилакоида состоит, как минимум, из 335 различных белков. 89 из них содержатся в веществе люмена, 116 — интегральные мембранные белки, 68 — на поверхности внутренней мембраны (со стороны люмена), и 62 — поверхностные на внешней мембране (со стороны стромы хлоропласта). Кроме того, с помощью компьютерных методов предсказаны дополнительные редкие белки вещества люмена[10][14]. Из тилакоидных белков с известными функциями 42 % участвует в фотосинтезе. 11 % задействовано в транспорте, обработке и в поддержке фолдинга белков, 9 % — в реакции на окислительный стресс, и в 8 % — в трансляции[12].
Интегральные мембранные белки
Тилакоидные мембраны содержат интегральные белки, играющие важную роль в захвате светового фотона и в светозависимых фотосинтетических реакциях. На мембране есть четыре основных белковых комплекса:
- фотосистемы I и II
- Цитохром-b6f-комплекс
- АТФ-синтаза
Фотосистема II в основном встречается у грановых тилакоидов, тогда как фотосистема I и АТФ-синтаза — у строматических тилакоидов, а также у внешних слоев гранов. Цитохромный комплекс b6f распределен равномерно по всей мембране.
Поскольку две фотосистемы пространственно разделены на тилакоидной мембране, для обмена электронами между ними необходимы подвижные переносчики. В роли таких переносчиков выступают пластохинон и пластоцианин. Пластохинон переносит электроны от фотосистемы II к цитохромному комплексу b6f, тогда как пластоцианин переносит их от цитохромного комплекса b6f к фотосистеме I.
Все вместе эти белки преобразуют энергию света для работы электронтранспортных цепей, которые создают электрохимический потенциал через тилакоидную мембрану, а также синтезируют фосфат никотинамид-аденинового динуклеотида (НАДФ) — продукт конечной окислительно-восстановительной реакции. АТФ-синтаза использует этот электрохимический потенциал для синтеза АТФ в процессе фотофосфорилирования.
Фотосистемы
|
Основная статья: Фотосистема (биология) |
Фотосистемы тилакоида — центры осуществления окислительно-восстановительных светозависимых реакций. Каждая фотосистема содержит антенный комплекс, который улавливает свет различных длин волн с использованием хлорофилла и вспомогательных фотосинтетических пигментов, таких как каротиноиды и фикобилипротеины. На антенном комплексе имеется от 250 до 400 молекул пигмента. Поглощаемая ими энергия за счет резонансного переноса передается специализированному хлорофиллу a, расположенному в реакционном центре каждой фотосистемы. Когда любая из двух молекул хлорофилла a в реакционном центре получает энергию, электрон передается молекуле-акцептору.
Реакционный центр Фотосистемы I наиболее эффективно поглощает свет на длине волны 700 нм. Он содержит две молекулы хлорофилла a, обозначаемые P700. Фотосистема II содержит хлорофильный димер P680, максимум поглощения которого приходится на 680 нм (следует отметить, что обе эти длины волны лежат глубоко в красной области спектра, см. статью про видимый свет). В обозначениях хлорофиллов P — сокращение от «пигмент», а число показывает длину волны в нанометрах, на которой достигается максимум поглощения света.
Цитохром-b6f-комплекс
|
Основная статья: Цитохром-b6f-комплекс |
Цитохромный комплекс b6f входит в электронтранспортную цепь тилакоида и соединяет передачу электронов с прокачкой протонов в просвет тилакоида. В цепочке переносчиков он расположен между двумя фотосистемами и передает электроны от пластохинона фотосистемы II к пластоцианину фотосистемы I.
АТФ-синтаза
|
Основная статья: АТФ-синтаза |
Тилакоидная АТФ-синтаза — это АТФ-синтаза CF1FO, похожая на митохондриальную АТФ-синтазу. Она интегрирована в мембрану тилакоида, причем её компонент CF1 выступает в строму хлоропласта. Таким образом АТФ синтезируется на стромальной стороне тилакоида, где он необходим для светонезависимых реакций фотосинтеза.
Белки люмена
В люмене тилакоида содержится белок пластоцианин, осуществляющий транспорт электронов от цитохромного белкового комплекса b6f к фотосистеме I. В отличие от липидорастворимого пластохинона, который может перемещаться по мембране тилакоида, пластоцианин гидрофилен и перемещается в веществе люмена.
В люмене тилакоидов также происходит расщепление воды. Эту операцию выполняет водорасщепляющий комплекс, связанный с участком фотосистемы II, выступающим в люмен.
Белки люмена могут быть предсказаны на основании анализа их сигнальных последовательностей. У арабидопсиса была предсказана большая группа белков, имеющих сигнал «TAT», из них примерно 19 % задействована в обработке белков (протеолизе и сворачивании), 15 % в фотосинтезе, 11 % в метаболизме и 7 % в окислительно-восстановительных реакциях и защите от инфекции[10].
Экспрессия тилакоидных белков
Хлоропласты обладают собственным геномом, в котором хранятся гены некоторых тилакоидных белков. Однако в процессе эволюции пластид из их предшественников — эндосимбиотических цианобактерий — произошел перенос большого количества генов из хлоропластного генома в ядро клетки. В результате этого четыре основных тилакоидных белковых комплекса частично кодируются в геноме хлоропласта, а частично — ядерным геномом.
Растения выработали несколько механизмов совместной регуляции экспрессии белков, входящих в эти комплексы, гены которых хранятся в разных органеллах, чтобы достичь необходимой стехиометрии и необходимого качества сборки белковых комплексов. Например транскрипция ядерных генов, кодирующих части фотосинтетического аппарата, зависит от освещенности.
Жизненный цикл тилакоидных белковых комплексов управляется фосфорилированием специфическими киназами, чувствительными к окислению и восстановлению, которые располагаются на тилакоидных мембранах[15].
Скорость трансляции белков, кодируемых в геноме хлоропластов, контролируется присутствием или отсутствием сборочных белков[16]. Этот механизм содержит отрицательную обратную связь, реализуемую связыванием вспомогательного белка с 5′-концом нетранслированного участка хлоропластной мРНК[17].
Кроме того, хлоропласты должны поддерживать баланс между концентрациями фотосистем I и II для нормального функционирования электронтранспортной цепи. Состояние (окисленное/неокисленное) носителя электронов пластохинона на тилакоидной мембране непосредственно контролирует транскрипцию хлоропластных генов, кодирующих белки реакционных центров фотосистем, компенсируя разбалансировку электронтранспортной цепи[18].
Транспорт белков в тилакоидах
Белки тилакоидов направляются к местам их расположения при помощи сигнальных пептидов и механизмов секреции, похожих на прокариотические. Большинство белков тилакоидов, кодируемых ядерным геномом растения для нахождения места своего назначения нуждаются в двух сигналах: N-концевом хлоропластном маркере (показан на рисунке желтым), и тилакоидном маркере (показан синим). Белки вводятся в хлоропласт через транслоконные комплексы на внутренней и внешней мембранах (на рисунке — Tic и Toc).
После попадания внутрь хлоропласта первый маркер отщепляется протеазой, которая обрабатывает входящие белки. Это открывает доступ ко второму сигналу, и белок из стромы хлоропласта переносится в тилакоид в рамках второго этапа транспортировки. Этот второй этап требует работы компонентов тилакоида, ответственных за перенос белков, и происходит с затратами энергии.
Белки интегрируются в мембрану через механизм распознавания сигнальных участков (1), через механизм диаргининовой транслокации (ДАТ) (2) либо самопроизвольно за счет наличия в них трансмембранных доменов (на рисунке не показано). Белки вещества просвета переносятся в просвет через мембрану тилакоида через механизм ДАТ (2) либо через секреторный механизм (3), и высвобождаются за счет отщепления тилакоидного маркера.
Разные механизмы переноса белков используют разные сигнальные пептиды и источники энергии. Секреторный механизм в качестве источника энергии использует АТФ и реализуется маркером SecA, связывающимся с переносимым белком, и секреторным мембранным комплексом Sec, непосредственно осуществляющем перенос.
Белки с двумя аргининами в их тилакоидном сигнальном маркере переносятся с помощью ДАТ, который реализуется мембранным комплексом Tat (от англ. twin arginine translocation), использующим градиент pH в качестве источника энергии.
Некоторые другие белки интегрируются в мембрану при помощи механизма распознавания сигнальных пептидов. Хлоропластные белки-рецепторы могут распознавать целевые белки как после их трансляции, так и во время её, и таким образом они могут переносить как внешние белки, так и белки, транслируемые внутри хлоропласта. Этот механизм в качестве источников энергии использует ГТФ и градиент pH.
Некоторые трансмембранные белки могут также самопроизвольно интегрироваться в мембрану со стороны стромы без затрат энергии[19].
Функции тилакоидов
В тилакоидах осуществляются следующие светозависимые реакции фотосинтеза:
- Светозависимое расщепление воды, в результате которого происходит синтез молекул кислорода;
- Перенос протонов через тилакоидную мембрану, связанный с электронтранспортной цепью фотосистем и цитохромного комплекса b6f;
- Синтез АТФ, выполняемый АТФ-синтазой с использованием протонного градиента.
Фотолиз воды
Первый этап фотосинтеза — это расщепление воды под воздействием света. Эта реакция поставляет электроны для фотосинтетических электронтранспортных цепей, а также протоны для создания протонного градиента. Реакция расщепления воды происходит на стороне тилакоидной мембраны, обращённой к люмену, и происходит с затратами энергии, полученной фотосистемами от солнечного света. Интересно отметить, что это окисление (расщепление) воды происходит с выделением O2 как побочного продукта, который сбрасывается в атмосферу и затем может быть использован другими организмами для дыхания.
Электронтранспортная цепь
|
Основная статья: Цепь переноса электронов фотосинтеза |
В процессе фотосинтеза использованы две разновидности транспорта электронов:
- Нециклический электронный транспорт, или нециклическое фотофосфорилирование, при котором производится NADPH, протоны H+ и АТФ;
- Циклический электронный транспорт, или циклическое фотофосфорилирование, при котором производится только АТФ.
Нециклическая разновидность транспорта задействует обе фотосистемы, тогда как циклическая происходит только с использованием фотосистемы I.
- Фотосистема I использует энергию света для восстановления NADP+ до NADPH + H+. Она активна в обеих разновидностях электронного транспорта. В циклическом режиме возбужденный электрон отправляется по цепочке, которая в конце возвращает его обратно к хлорофиллу, который сообщил ему энергию возбуждения.
- Фотосистема II использует энергию света для расщепления молекул воды с выходом электронов (e−), протонов (H+) и молекулярного кислорода (O2). Она задействована только в нециклическом транспорте. Электроны в добываются этой системой из окисленного 2H2O (O2 + 4 H+ + 4 e−) и удаляются из неё с NADP+, когда он восстанавливается до NADPH.
Электрохимический потенциал
Основанной функцией тилакоидной мембраны и её интегральных фотосистем является создание электрохимического потенциала. Переносчики электронов, участвующие в электронном транспорте, используют некоторую часть энергии электронов для перекачки протонов из стромы в просвет тилакоида. Во время фотосинтеза вещество люмена приобретает кислую реакцию вплоть до pH 4 (тогда как строма имеет pH 8). Это соответствует 10 000-кратному градиенту концентрации протонов поперек тилакоидной мембраны.
Источник протонного градиента
Протоны в просвет поступают из трех источников:
- Фотолиз воды, осуществляемый фотосистемой II, в процессе которого вода в люмене тилакоида окисляется с выходом молекулярного кислорода, протонов и электронов.
- Передача электрона от фотосистемы II к пластохинону во время светозависимой реакции фотосинтеза, входящей в нециклическую электронтранспортную цепь, потребляет два протона из стромы. Они переносятся в просвет тилакоида, когда восстановленный пластохинон окисляется цитохромным комплексом b6f на стороне тилакоидной мембраны, обращенной к просвету. От пластохинона электроны передаются цитохромному комплексу b6f, который напоминает цитохром bc1.
- Восстановление пластохинона ферредоксином в процессе циклического электронного транспорта также вызывает перенос двух протонов из стромы в просвет тилакоида.
Протонный градиент также поддерживается потреблением протонов в строме при восстановлении NADP+ до NADPH, осуществляемом NADP-редуктазой.
Синтез АТФ
Молекулярный механизм синтеза АТФ в хлоропластах похож на аналогичный механизм в митохондриях. Он получает необходимую энергию от протон-движущей силы (ПДС). Однако хлоропласты используют большей частью на электрохимический потенциал ПДС. ПДС слагается из химического потенциала протонов (обусловленного градиентом их концентрации) и трансмембранного электрического потенциала (обусловленного распределением зарядов по разные стороны мембраны).
По сравнению с внутренними мембранами митохондрий, которые обладают существенно более высоким мембранным потенциалом, обусловленным разделением зарядов, градиент заряда на тилакоидных мембранах невелик. В то же время это компенсируется 10000-кратным градиентом концентрации протонов, который гораздо выше, нежели 10-кратный у митохондрий. Общий электрохимический потенциал между просветом тилакоида и стромой достаточно велик, чтобы подпитывать работу АТФ-синтазы. Когда протоны выходят обратно в строму в область сниженной концентрации через канал в АТФ-синтазе, происходит реакция синтеза АТФ. Именно через протонный градиент светозависимые реакции соединены с синтезом АТФ.
Источник: www.wikiwand.com
Строение тилакоида
Тилакоиды — это ограниченные мембраной структуры, расположенные в строме хлоропласта.
Мембрана
Мембрана тилакоида собственно и является тем местом, где протекают светозависимые реакции фотосинтеза. Эти реакции идут при участии фотосинтетических пигментов, расположенных непосредственно на мембране в виде перемежающихся темных и светлых полос шириной около 1 нм[1].
Липидный бислой тилакоида по свойствам схож с бактериальными мембранами, а также с внутренней мембраной хлоропласта. В его состав, например, входят кислые липиды, (также как у цианобактерий и других бактерий, способных к фотосинтезу), которые используются для поддержания функциональной целостности фотосистемы[2].
Мембраны тилакоидов у высших растений в основном состоят из фосфолипидов[3] и галактолипидов, которые распределены по мембране неравномерно[4].
Процесс синтеза липидов для тилакоидной мембраны довольно сложен, он включает в себя обмен предшественниками липидов между эндоплазматическим ретикулумом и внутренней мембраной оболочки пластиды, откуда сами липиды передаются на тилакоиды через транспорт везикул[5].
Просвет
Просвет тилакоида — это компартмент, ограниченный тилакоидной мембраной. Он играет существенную роль в фотофосфорилировании в процессе фотосинтеза. Во время протекания светозависимых реакций протоны накачиваются через мембрану тилакоида в его люмен. pH просвета при этом может снижаться до 4.
Граны
Граны — это стопки из тилакоидов, имеющих форму дисков. Хлоропласты могут содержать от 10 до 100 гран. Граны соединены строматическими тилакоидами, которые иногда называют также межграновыми тилакоидами, или ламеллами. Грановые и межграновые тилакоиды могут быть различены по своему белковому составу.
Образование тилакоидов
Хлоропласты развиваются из пропластид, когда росток поднимается над поверхностью почвы. Для образование тилакоидов обязательно наличие света. В зародыше растения, равно как и в отсутствие света, пропластиды превращаются в этиопласты, обладающие полукристаллическими мембранами, которые называют проламеллярными телами. Под воздействием света эти проламеллярные тела превращаются в тилакоиды. Это, однако, не происходит у ростков, прорастающих в темноте; такие ростки подвергаются этиоляции. Недостаточная освещенность может привести к нарушению формирования тилакоидов. Это приводит к нефункциональности хлоропластов и в результате — к гибели растения.
Для образования тилакоидов также требуется белок VIPP1 (белок пластид 1, индуцирующий везикулярный транспорт, англ. vesicle-inducing protein in plastids 1). Растение погибает без этого белка, а его сниженная концентрация замедляет рост растения и вызывает его бледную окраску, а также снижает фотосинтетическую активность. VIPP1 требуется для формирования собственно тилакоидной мембраны, но не для сборки белковых комплексов на этой мембране[6].
Этот белок очень консервативен у всех организмов, содержащих тилакоиды, даже у сине-зелёных водорослей,[7] зеленых водорослей, например, хламидомонады[8] и высших растений, таких как арабидопсис [9].
Выделение и фракционирование тилакоидов
Тилакоиды могут быть выделены из растительной клетки при помощи комбинации дифференциального и градиентного центрифугирования[10]. Разрушение выделенных тилакоидов, например, за счет механического воздействия, позволяет выделить вещество люмена. Из оставшихся фрагментов мембраны можно извлечь также поверхностные и интегральные белки: обработка карбонатом натрия (Na2CO3) вызывает отделение поверхностных мембранных белков, тогда как обработка детергентами и органическими растворителями позволяет извлечь и интегральные мембранные белки.
Белки тилакоидов
Тилакоиды содержат множество интегральных и поверхностных мембранных белков. Много белков содержится и в веществе люмена. Недавние протеомные исследования[11] тилакоидных фракций позволили накопить много инфомации по белковому составу тилакоидов. Эти данные обобщены в нескольких базах данных по пластидным белкам, доступных в Интернете[12][13].
Как показали упомянутые исследования, протеом тилакоида состоит, как минимум, из 335 различных белков. 89 из них содержатся в веществе люмена, 116 — интегральные мембранные белки, 68 — на поверхности внутренней мембраны (со стороны люмена), и 62 — поверхностные на внешней мембране (со стороны стромы хлоропласта). Кроме того, с помощью компьютерных методов предсказаны дополнительные редкие белки вещества люмена[14][10]. Из тилакоидных белков с известными функциями 42 % участвует в фотосинтезе. 11 % задействовано в транспорте, обработке и в поддержке фолдинга белков, 9 % — в реакции на окислительный стресс, и в 8 % — в трансляции[12].
Интегральные мембранные белки
Тилакоидные мембраны содержат интегральные белки, играющие важную роль в захвате светового фотона и в светозависимых фотосинтетических реакциях. На мембране есть четыре основных белковых комплекса:
- фотосистемы I и II
- Цитохромный комплекс b6f
- АТФ-синтаза
Фотосистема II в основном встречается у грановых тилакоидов, тогда как фотосистема I и АТФ-синтаза — у строматических тилакоидов, а также у внешних слоев гранов. Цитохромный комплекс b6f распределен равномерно по всей мембране.
Поскольку две фотосистемы пространственно разделены на тилакоидной мембране, для обмена электронами между ними необходимы подвижные переносчики. В роли таких переносчиков выступают пластохинон и пластоцианин. Пластохинон переносит электроны от фотосистемы II к цитохромному комплексу b6f, тогда как пластоцианин переносит их от цитохромного комплекса b6f к фотосистеме I.
Все вместе эти белки преобразуют энергию света для работы электронтранспортных цепей, которые создают электрохимический потенциал через тилакоидную мембрану, а также синтезируют фосфат никотинамид-аденинового динуклеотида (НАДФ) — продукт конечной окислительно-восстановительной реакции. АТФ-синтаза использует этот электрохимический потенциал для синтеза АТФ в процессе фотофосфорилирования.
Фотосистемы
Фотосистемы тилакоида — центры осуществления окислительно-восстановительных светозависимых реакций. Каждая фотосистема содержит антенный комплекс, который улавливает свет различных длин волн с использованием хлорофилла и вспомогательных фотосинтетических пигментов, таких как каротиноиды и фикобилипротеины. На антенном комплексе имеется от 250 до 400 молекул пигмента. Поглощаемая ими энергия за счет резонансного переноса передается специализированному хлорофиллу a, расположенному в реакционном центре каждой фотосистемы. Когда любая из двух молекул хлорофилла a в реакционном центре получает энергию, электрон передается молекуле-акцептору.
Реакционный центр Фотосистемы I наиболее эффективно поглощает свет на длине волны 700 нм. Он содержит две молекулы хлорофилла a, обозначаемые P700. Фотосистема II содержит хлорофилл P680, максимум поглощения которого приходится на 680 нм (следует отметить, что обе эти длины волны лежат глубоко в красной области спектра, см. статью про видимый свет). В обозначениях хлорофиллов P — сокращение от «пигмент», а число показывает длину волны в нанометрах, на которой достигается максимум поглощения света.
Цитохромный комплекс b6f
Цитохромный комплекс b6f входит в электронтранспортную цепь тилакоида и соединяет передачу электронов с прокачкой протонов в просвет тилакоида. В цепочке переносчиков он расположен между двумя фотосистемами и передает электроны от пластохинона фотосистемы II к пластоцианину фотосистемы II.
АТФ-синтаза
Тилакоидная АТФ-синтаза — это АТФ-синтаза CF1FO, похожая на митохондриальную АТФ-синтазу. Она интегрирована в мембрану тилакоида, причем ее компонент CF1 выступает в строму хлоропласта. Таким образом АТФ синтезируется на стромальной стороне тилакоида, где он необходим для светонезависимых реакций фотосинтеза.
Белки люмена
В люмене тилакоида содержится белок пластоцианин, осуществляющий транспорт электронов от цитохромного белкового комплекса b6f к фотосистеме I. В отличие от липидорастворимого пластохинона, который может перемещаться по мембране тилакида, пластоцианин гидрофилен и перемещается в веществе люмена.
В люмене тилакоидов также происходит расщепление воды. Эту операцию выполняет водорасщепляющий комплекс, связанный с участком фотосистемы II, выступающим в люмен.
Белки люмена могут быть предсказаны на основании анализа их сигнальных последовательностей. У арабидопсиса была предсказана большая группа белков, имеющих сигнал «TAT», из них примерно 19 % задействована в обработке белков (протеолизе и сворачивании), 15 % в фотосинтезе, 11 % в метаболизме и 7 % в окислительно-восстановительных реакциях и защите от инфекции[10].
Экспрессия тилакоидных белков
Хлоропласты обладают собственным геномом, в котором хранятся гены некоторых тилакоидных белков. Однако в процессе эволюции пластид из их предшественников — эндосимбиотических цианобактерий — произошел перенос большого количества генов из хлоропластного генома в ядро клетки. В результате этого четыре основных тилакоидных белковых комплекса частично кодируются в геноме хлоропласта, а частично — ядерным геномом.
Растения выработали несколько механизмов совместной регуляции экспрессии белков, входящих в эти комплексы, гены которых хранятся в разных органеллах, чтобы достичь необходимой стехиометрии и необходимого качества сборки белковых комплексов. Например транскрипция ядерных генов, кодирующих части фотосинтетического аппарата, зависит от освещенности.
Жизненный цикл тилакоидных белковых комплексов управляется фосфорилированием специфическими киназами, чувствительными к окислению и восстановлению, которые располагаются на тилакоидных мембранах[15].
Скорость трансляции белков, кодируемых в геноме хлоропластов, контролируется присутствием или отсутствием сборочных белков[16]. Этот механизм содержит отрицательную обратную связь, реализуемую связыванием вспомогательного белка с 5′-концом нетранслированного участка хлоропластной мРНК [17].
Кроме того, хлоропласты должны поддерживать баланс между концентрациями фотосистем I и II для нормального функционирования электронтранспортной цепи. Состояние (окисленное/неокисленное) носителя электронов пластохинона на тилакоидной мембране непосредственно контролирует транскрипцию хлоропластных генов, кодирующих белки реакционных центров фотосистем, компенсируя разбалансировку электронтранспортной цепи[18].
Транспорт белков в тилакоидах
Белки тилакоидов направляются к местам их расположения при помощи сигнальных пептидов и механизмов секреции, похожих на прокариотические. Большинство белков тилакоидов, кодируемых ядерным геномом растения для нахождения места своего назначения нуждаются в двух сигналах: N-концевом хлоропластном маркере (показан на рисунке желтым), и тилакоидном маркере (показан синим). Белки вводятся в хлоропласт через транслоконные комплексы на внутренней и внешней мембранах (на рисунке — Tic и Toc).
После попадания внутрь хлоропласта первый маркер отщепляется протеазой, которая обрабатывает входящие белки. Это открывает доступ ко второму сигналу, и белок из стромы хлоропласта переносится в тилакоид в рамках второго этапа транспортировки. Этот второй этап требует работы компонентов тилакоида, ответственных за перенос белков, и происходит с затратами энергии.
Белки интегрируются в мембрану через механизм распознавания сигнальных участков (1), через механизм диаргининовой транслокации (ДАТ) (2) либо самопроизвольно за счет наличия в них трансмембранных доменов (на рисунке не показано). Белки вещества просвета переносятся в просвет через мембрану тилакоида через механизм ДАТ (2) либо через секреторный механизм (3), и высвобождаются за счет отщепления тилакоидного маркера.
Разные механизмы переноса белков используют разные сигнальные пептиды и источники энергии. Секреторный механизм в качестве источника энергии использует АТФ и реализуется маркером SecA, связывающимся с переносимым белком, и секреторным мембранным комплексом Sec, непосредственно осуществляющем перенос.
Белки с двумя аргининами в их тилакоидном сигнальном маркере переносятся с помощью ДАТ, который реализуется мембранным комплексом Tat (от англ. twin arginine translocation), использующим градиент pH в качестве источника энергии.
Некоторые другие белки интегрируются в мембрану при помощи механизма распознавания сигнальных пептидов. Хлоропластные белки-рецепторы могут распознавать целевые белки как после их трансляции, так и во время ее, и таким образом они могут переносить как внешние белки, так и белки, транслируемые внутри хлоропласта. Этот механизм в качестве источников энергии использует ГТФ и градиент pH.
Некоторые трансмембранные белки могут также самопроизвольно интегрироваться в мембрану со стороны стромы без затрат энергии[19].
Функции тилакоидов
В тилакоидах осуществляются следу светозависимые реакции фотосинтеза:
- Светозависимое расщепление воды, в результате которого происходит синтез молекул кислорода;
- Перенос протонов через тилакоидную мембрану, связанный с электронтранспортной цепью фотосистем и цитохромного комплекса b6f;
- Синтез АТФ, выполняемый АТФ-синтазой с использованием протонного градиента.
Фотолиз воды
Первый этап фотосинтеза — это расщепление воды под воздействием света. Эта реакция поставляет электроны для фотосинтетических электронтранспортных цепей, а также протоны для создания протонного градиента. Реакция расщепления воды происходит на стороне тилакоидной мембраны, обращённой к люмену, и происходит с затратами энергии, полученной фотосистемами от солнечного света. Интересно отметить, что это окисление (расщепление) воды происходит с выделением O2 как побочного продукта, который сбрасывается в атмосферу и затем может быть использован другими организмами для дыхания.
Электронтранспортная цепь
В процессе фотосинтеза использованы две разновидности транспорта электроннов:
- Нециклический электронный транспорт или нециклическое фотофосфорилирование, при котором производится NADPH, протоны H+ и АТФ;
- Циклический электронный транспорт или циклическое фотофосфорилирование, при котором производится только АТФ.
Нециклическая разновидность транспорта задействует обе фотосистемы, тогда как циклическая происходит только с использованием фотосистемы I.
- Фотосистема I использует энергию света для восстановления NADP+ до NADPH + H+. Она активна в обеих разновидностях электронного транспорта. В циклическом режиме возбужденный электрон отправляется по цепочке, которая в конце возвращает его обратно к хлорофиллу, который сообщил ему энергию возбуждения.
- Фотосистема II использует энергию света для расщепления молекул воды с выходом электронов (e—), протонов (H+) и молекулярного кислорода (O2). Она задействована только в нециклическом транспорте. Электроны в добываются этой системой из окисленного 2H2O (O2 + 4 H+ + 4 e—) и удаляются из нее с NADP+, когда он восстанавливается до NADPH.
Электрохимический потенциал
Основанной функцией тилакоидной мембраны и ее интегральных фотосистем является создание электрохимического потенциала. Переносчики электронов, участвующие в электронном транспорте, используют некоторую часть энергии электронов для перекачки протонов из стромы в просвет тилакоида. Во время фотосинтеза вещество люмена приобретает кислую реакцию вплоть до pH 4 (тогда как строма имеет pH 8). Это соответствует 10 000-кратному градиенту концентрации протонов поперек тилакоидной мембраны.
Источник протонного градиента
Протоны в просвет поступают из трех источников:
- Фотолиз воды, осуществляемый фотосистемой II, в процессе которого вода в люмене тилакоида окисляется с выходом молекулярного кислорода, протонов и электронов.
- Передача электрона от фотосистемы II к пластохинону во время светозависимой реакции фотосинтеза, входящей в нециклическую электронтранспортную цепь, потребляет два протона из стромы. Они переносятся в просвет тилакоида, когда восстановленный пластохинон окисляется цитохромным комплексом b6f на стороне тилакоидной мембраны, обращенной к просвету. От пластохинона электроны передаются цитохромному комплексу b6f, который напоминает цитохром bc1.
- Восстановление пластохинона ферредоксином в процессе циклического электронного транспорта также вызывает перенос двух протонов из стромы в просвет тилакоида.
Протонный градиент также поддерживается потреблением протонов в строме при восстановлении NADP+ до NADPH, осуществляемом NADP-редуктазой.
Синтез АТФ
Молекулярный механизм синтеза АТФ в хлоропластах похож на аналогичный механизм в митохондриях. Он получает необходимую энергию от протон-движущей силы (ПДС). Однако хлоропласты используют большей частью на электрохимический потенциал ПДС. ПДС слагается из химического потенциала протонов (обусловленного градиентом их концентрации) и трансмембранного электрического потенциала (обусловленного распределением зарядов по разные стороны мембраны).
По сравнению с внутренними мембранами митохондрий, которые обладают существенно более высоким мембранным потенциалом, обусловленным разделением зарядов, градиент заряда на тилакоидных мембранах невелик. В то же время это компенсируется 10000-кратным градиентом концентрации протонов, который гораздо выше, нежели 10-кратный у митохондрий. Общий электрохимический потенциал между просветом тилакоида и стромой достаточно велик, чтобы подпитывать работу АТФ-синтазы. Когда протоны выходят обратно в строму в область сниженной концентрации через канал в АТФ-синтазе, происходит реакция синтеза АТФ. Именно через протонный градиент светозависимые реакции соединены с синтезом АТФ.
Мембраны тилакоидов цианобактерий
Цианобактерии — фотосинтетические прокариоты, обладающие высокодифференцированными мембранными системами. У этих бактерий имеется внутренняя система тилакоидных мембран, на которых расположены все компоненты действующих электронтранспортных цепей фотосинтеза и дыхания. За счет наличия таких систем эти бактерии сложнее, нежели другие. Им нужно уметь управлять этими мембранами, синтезировать специфические мембранные липиды, а также обеспечивать правильный транспорт белков. Внешняя или плазматическая мембрана, и мембраны тилакоидов играют разные роли в клетках цианобактерий. Организация, функции, состав и динамика белков мембранных систем остается одной из наиболее активно изучаемых областей в биологии цианобактерий[20].
См. также
- Хлоропласт
- Митохондрия
- Хемиосмос
- Электрохимический потенциал
- Эндосимбиоз
- Фотосинтез
Источники
- LIFE: The Science of Biology (seventh edition). — Sinauer Associates, Inc., 2004. — ISBN ISBN 0-7167-9856-5
- Peter H. Raven Biology of Plants, 7th Edition. — New York: W.H. Freeman and Company Publishers. — С. 115-127. — ISBN 0-7167-1007-2
- The Cyanobacteria: Molecular Biology, Genomics and Evolution. — 1st ed.. — Caister Academic Press, 2008. — ISBN 978-1-904455-15-8
Эта страница использует содержимое раздела Википедии на русском языке. Оригинальная статья находится по адресу: Тилакоид. Список первоначальных авторов статьи можно посмотреть в истории правок. Эта статья так же, как и статья, размещённая в Википедии, доступна на условиях CC-BY-SA .
Источник: vlab.wikia.org
Где располагаются тилакоиды?
Совокупность тилакоидов представляет собой дискообразную мембранную структуру. Скопление таких дисков называются граной.
Они расположены возле хлоропластов, клеток высших растений. Кроме этого, они содержатся в цитоплазматических мембранах цианобактерий, не имеющих самостоятельные хлоропласты. Пространство между хлоропластом и тилакоидом называется стромой. Она содержит молекулы РНК, ДНК, дополнительные компоненты.
Строение
В 1 хлоропласте содержится от 10 до 100 гран. Они соединены межграновыми органеллами, которые называются ламеллами. Они представляют собой мембранные выросты. Отличительная особенность органелл определяется белковым составом.
Представленные структуры состоят из следующих отделов:
- Мембрана.
За счет мембраны образование имеет четкие границы, и отделяется от других аналогичных структур. В мембране происходит светозависимая реакция фотосинтеза. В ней участвует ряд пигментных веществ, содержащихся непосредственно в мембране. Они состоят из неравномерно распределенных липидных веществ. - Люмен.
Представляет собой содержимое хлоропластов, которое ограничивается оболочкой. В нем происходит процесс выработки АТФ за счет световой энергии. Сквозь мембрану в люмен проникают световые частицы. Это главный этап фотосинтеза, при котором происходит обменный процесс.
Тилакоиды формируются при достаточном освещении из пропластид растительных клеток. В процессе участвуют белковые соединения, формирующие органеллы.
Функции
Выделяют 2 вида тилакоидов, которые различаются функциями. Первый вид – тилакоиды с люменом. Главная функция заключается в выработке энергии за счет воздействия солнечного ультрафиолета.
Светозависимые реакции протекают в виде нескольких этапов:
- Расщепление молекул воды под воздействием солнечного света
- Транспортировка световых частиц сквозь мембрану
- Выработка АТФ и его распределение по хролопластам
Другой вид – ламеллярные тилакоиды. Они представляют собой широкие пластины, в которых отсутствует люмен. Эти органеллы практически не участвуют в фотосинтезе. Главная задача заключается в создании прочной основы для тилакоидов с люменом и формирования целостных гран.
Световая стадия фотосинтеза в тилакоидах
Фотосинтез – это цикличный процесс, который протекает в 2 фазы: световую и темновую. Световой этап протекает в хлоропластах. Процесс сопровождается образованием АТФ и формированием молекул, которые его переносят. Побочным продуктом распада становится кислород, который в дальнейшем покидает клетки и попадает в окружающее пространство.
Эффективность фотосинтеза напрямую влияет не только от количества поглощаемого света, но и температурного показателя. Поэтому скорость протекающего процесса может меняться в темновую стадию.
Содержащийся в хлоропластах хлорофилл выполняет одновременно функцию поглощения и передачи световой энергии. Содержимое хлоропластов выполняет функцию светособирающего комплекса.
Внутри люмен происходит расщепление световой энергии, в результате чего также разрушаются транспортные молекулы хлорофилла. Для их восполнения в процессе фотосинтеза расщепляются молекулы воды, которые в дальнейшем выполняют транспортную функцию, а также участвуют в формировании электрохимического потенциала клетки.
После фотолиза воды мембраны перезаряжаются. Тилакоиды способны при переносе протонов иметь кислый рН, в то время как строма хлоропласта характеризуется слабощелочным рН. В результате разницы генерируется электрохимический потенциал, провоцирующий синтез АТФ.
Для выработки 1 молекулы глюкозы – органического вещества для питания клетки, требуется 18 молекул АТФ, 6 – углекислого газа, а также 24 протона водорода. Для утилизации 6 молекул газа требуется 24 молекулы воды, в результате чего высвобождается кислород. В дальнейшем он используется другими живыми организмами для восполнения собственных потребностей.
Тилакоиды – структурные элементы хлоропластов, внутри которых происходят основные этапы фотосинтеза. Помимо этого, такие образования выполняют опорные функции, образуя совокупность в виде гран. Тилакоиды содержатся внутри всех растительных клеток, способных к фотосинтезу, а также внутри цианобактерий, которые не имеют отдельных ядра и других органелл, ввиду чего относятся к числу прокариотов.
Источник: appteka.ru