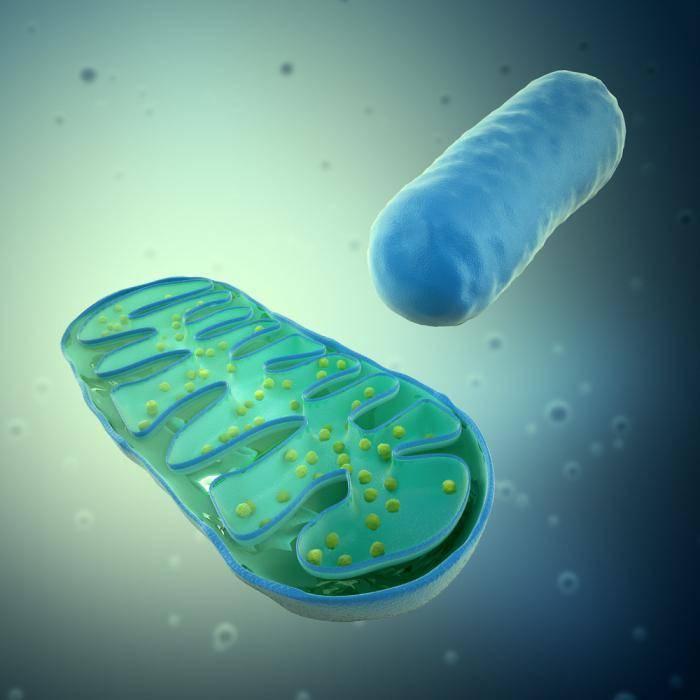
Роль митохондрии в клетке
Строение
Митохондрии состоят из трёх взаимосвязанных компонентов:
- наружной мембраны;
- внутренней мембраны;
- матрикса.
Внешняя гладкая мембрана состоит из липидов, между которых находятся гидрофильные белки, образующие канальцы. Сквозь эти канальцы проходят молекулы при транспорте веществ.
Наружная и внутренняя мембраны находятся на расстоянии 10-20 нм. Межмембранное пространство заполнено ферментами. В отличие от ферментов лизосом, участвующих в расщеплении веществ, ферменты межмембранного пространства переносят остатки фосфорной кислоты к субстрату с затратой АТФ (процесс фосфорилирования).
Внутренняя мембрана упакована под внешней мембраной в виде многочисленных складок – крист.
Они образованы:
- липидами, проницаемыми только для кислорода, углекислого газа, воды;
- ферментными, транспортными белками, участвующими в окислительных процессах и транспорте веществ.
Здесь за счёт дыхательной цепи происходит вторая стадия клеточного дыхания и образование 36 молекул АТФ.
Между складками находится полужидкое вещество – матрикс.
В состав матрикса входят:
- ферменты (сотни разных видов);
- жирные кислоты;
- белки (67 % белков митохондрий);
- митохондриальная кольцевая ДНК;
- митохондриальные рибосомы.
Наличие рибосом и ДНК свидетельствует о некоторой автономности органоида.

Рис. 1. Строение митохондрий.
Значение
Основная функция митохондрий в клетке – синтез АТФ, т.е. генерация энергии. В результате клеточного дыхания (окисления) образуется 38 молекул АТФ. Синтез АТФ происходит на основе окисления органических соединений (субстрата) и фосфорилирования АДФ. Субстратом для митохондрий являются жирные кислоты и пируват.

Рис. 2. Образование пирувата в результате гликолиза.
Общее описание процесса дыхания представлено в таблице.

Рис. 3. Процесс клеточного дыхания.
Источник: obrazovaka.ru
Происхождение митохондрий[править | править код]
В соответствии с теорией симбиогенеза, митохондрии появились в результате захвата примитивными клетками (прокариотами) бактерий. Клетки, которые не могли сами использовать кислород для генерации энергии, имели серьёзные ограничения в возможностях развития; бактерии же (прогеноты) могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот[2]. Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функционирования, кодируются ядерными хромосомами, синтезируются в цитоплазме клетки и только потом транспортируются в органеллы.
Митохондрии в клетке[править | править код]
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, у которых велика потребность в кислороде. По своему строению митохондрии представляют собой органеллы, обычно сферической формы, встречающиеся в эукариотической клетке в количестве от нескольких сотен до 1—2 тысяч и занимающие 10—20% её внутреннего объёма. Сильно варьируются также размеры (от 1 до 70 мкм) и форма митохондрий. В зависимости от того, в каких участках клетки в каждый конкретный момент времени происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки. В клетках растений и животных одновременно и примерно в равных количествах существуют три типа митохондриальных органелл: молодые протомитохондрии, зрелые митохондрии и старые постмитохондрии, деградирующие в липофусциновые гранулы[3].
Структура митохондрий[править | править код]
Наружная мембрана[править | править код]
Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок и замкнута сама на себя. На наружную мембрану приходится около 7% площади поверхности всех мембран клеточных органелл.
новная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из липидов с вкраплениями белков (соотношение 2 : 1). Особую роль играет порин — каналообразующий белок. Он образует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут проникать сквозь наружную мембрану только посредством активного транспорта с помощью транспортных белков митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство[править | править код]
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его размер — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Крупным же белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся не только во внутренней мембране, но и в периплазматическом пространстве, является цитохром c.
Внутренняя мембрана[править | править код]
Внутренняя мембрана состоит в основном из белковых комплексов (соотношение белок/липид — 3:1) и образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь её поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс[править | править код]
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Митохондриальная ДНК[править | править код]
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондриального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть транспортных РНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ATA вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны AGA и AGG, обычно кодирующие аргинин, являются стоп-кодонами, а кодон TGA, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70S-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
В специализированных (не делящихся) клетках митохондрии обычно не делятся. Обновление пула митохондрий в этом случае происходит путём созревания митохондрий из протомитохондрий, имеющих исходно диаметр 0,1-0,2 микрона. Откуда берутся протомитохондрии неизвестно, но предполагается, что затравкой для них служит ДНК постмитохондрий, высвобождающаяся в цитоплазму. Протомитохондрии обладают высокой скоростью дыхания, но невысоким дыхательным контролем (Векшин Н. Л. и др. 2004—2014).
Митохондриальные белки[править | править код]
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограничено. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S-рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране.
наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Функции митохондрий и энергообразование[править | править код]
Одной из основных функций митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий.
и этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
- Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
- Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН и двух молекул СО2;
- Перенос электронов с НАДН на кислород по дыхательной цепи с образованием Н2О;
- Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций гликолиза шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально декарбоксилируется и превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно так же жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацил-СоА-производных и подвергаются бета-окислению с образованием ацетил-СоА.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие распад ацетил-СоА на два атома углерода, в виде СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
- Большой олигомерный фермент, катализирующий перенос электронов;
- Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
- Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего как минимум из 26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (флавинмононуклеотид — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (цитохром bc1). Последний представляет собой димер с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в виде железосерных центров, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию окисления двух убихинолов до убихинонов, восстанавливая две молекулы цитохрома c (гемсодержащий переносчик, находящегося в межмембранном пространстве). Отщепляющиеся при этом от убихинолов четыре протона освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтаза[править | править код]
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
- Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
- Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Митохондрии и наследственность[править | править код]
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
История изучения[править | править код]
Митохондрия была открыта в середине XIX века. В конце XX века стало известно, что, выпуская сигнальные молекулы, митохондрии активируют смерть клетки[4].
См. также[править | править код]
- Симбиогенез
- Митохондриальная ДНК
- Митохондриальная Ева
- Митохондриальные заболевания
- Гидрогеносомы
Литература[править | править код]
- М. Б. Беркинблит, С. М. Глаголев, В. А. Фуралев. Общая биология. — М.: МИРОС, 1999.
- Д. Тейлор, Н. Грин, У. Стаут. Биология. — М.: МИР, 2006.
- Э. Уиллет. Генетика без тайн. — М.: ЭКСМО, 2008.
- Д. Г. Дерябин. Функциональная морфология клетки. — М.: КДУ, 2005.
- Белякович А.Г. Изучение митохондрий и бактерий с помощью соли тетразолия п-НТФ. — Пущино: ОНТИ НЦБИ АН СССР, 1990.
- Н. Л. Векшин. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон, 2009.
Источник: ru.wikipedia.org
Митохондрии
Автор: Андрей Антонов
Думаю, не погрешу против истины, сказав, что 3-4 года назад о самом таком понятии, как митохондрии в силовых видах спорта мало кто знал. Тем более об их роли в силовых упражнениях. Но с появлением в нашем журнале рубрики «Наука и спорт» и с опубликованием серии интервью с профессором В. Н. Селуяновым ситуация резко изменилась. Виктор Николаевич был первым ученым, досконально изучавшим проблемы локальной мышечной выносливости и доказавшим ее первостепенное значение в спорте. Ранее среди учёных превалирующим считалось развитие общей выносливости, которая определялась функциональными возможностями сердечнососудистой, дыхательной и нервной систем. Профессор доказал, что эти системы крайне редко являются причиной утомления, и что в основном работоспособность лимитирована самими мышцами, а именно количеством в них митохондриальной массы. По этой теме ученик Селуянова Евгений Борисович Мякинченко, автор более 40 научных и учебно-методических трудов в 1998 году защитил докторскую диссертацию. И речь шла о циклических видах спорта. А в силовых видах спорта об общей выносливости вообще надо забыть из-за крайне малого времени выполнения упражнения. Так кто же такие эти загадочные митохондрии, какова их роль и зачем они нужны спортсменам силовикам?
Митохондрии (от греч. μίτος — нить и χόνδρος — зёрнышко, крупинка) это клеточные органеллы ( так называют специализированные клеточные структуры), размером с бактерию. Они найдены в большом количестве почти во всех эукариотических клетках. Эукаритические клетки – это клетки, содержащие клеточное ядро. Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. По своему строению они представляют собой цилиндрические органеллы, встречающиеся в клетке в количестве от нескольких сот до 1—2 тысяч и занимающие 10—20 % её внутреннего объёма. Сильно варьируют так же размеры (от 1 до 70 мкм) и форма митохондрий. При этом ширина этих органелл относительно постоянна (0,5—1 мкм). Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок, и замкнута сама на себя. На наружную мембрану приходится около 7 % от площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Внутренняя мембрана образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь её поверхности и, например, в клетках печени составляет около трети всех клеточных мембран.
Пространство ограниченное внутренней мембраной называется матрикс. В матриксе митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии. Примечательно, что митохондрии содержат собственную цепочку ДНК, благодаря этому они, в отличие от других органелл, способны к самовоспроизведению. Правда, лишь частично. Митохондриальный белок синтезируется на 85-95% в цитоплазме и только 5-15% белкового содержимого является продуктом собственно митохондриальной трансляции. Белки, синтезируемые на митохондриальных рибосомах, включаются во внутреннюю митохондриальную мембрану. Внешняя мембрана, межмембранное пространство и матрикс комплектуются белками, продуцируемыми на цитоплазматических рибосомах.
Митохондрии часто называют энергетическими станции клетки. Они занимаются ресинтезом (то есть обратным восстановлением) молекул АТФ с помощью окислительного фосфорилирования. Все мы знаем что АТФ – универсальный источник энергии в клетках. Отдавая свой фосфатный остаток, АТФ превращается в АДФ с выделением энергии. Энергетическая цель потребляемых нами углеводов, жиров и белков состоит в том, чтобы восстановить АТФ из АДФ. Для этого и нужны митохондрии. Они поглощают АДФ, Ф, кислород, пируват, жирные кислоты, глицерол, ионы водорода и выделяют ресинтезированные молекулы АТФ, углекислый газ и воду.
Гликоген и глюкоза не могут проникнуть в митохондрию сквозь ее мембрану. Поэтому они ресентизируют АТФ без участия митохондрий, в саркоплазме МВ, образуя конечным продуктом распада пируват. Пируват имеет две возможности для преобразования:
1) подойти к митохондриям, превратиться в ацетил-коэнзим-А, подвергнуться окислительному фосфорилированию до образования углекислого газа, воды и молекул АТФ. Этот метаболический путь — гликоген-пируват-митохондрия-углекислый газ и вода — называют аэробным гликолизом;
2) с помощью фермента ЛДГ-М (лактат-дегидрогеназы мышечного типа) пируват превращается в молочную кислоту. Этот метаболический путь — гликоген-пируват- молочная кислота – называется анаэробным гликолизом .
Молочная кислота состоит из аниона – отрицательно заряженной молекулы лактата и катиона – положительно заряженного иона водорода. Лактат крупная молекула, она не может участвовать в химических реакциях без участия ферментов, поэтому не может повредить клетке. Ион водорода самый маленький атом, заряженный, поэтому проникает в сложные структуры и приводит к существенным химическим разрушениям. Мембраны МВ не выпускают в кровоток отдельные протоны и анионы, а выпускают только нейтральные молекулы, поэтому в кровь ионы водорода выйти не могут, а может только молочная кислота.
Жирные кислоты могут ресинтезировать АТФ только в митохондриях.
Исходя из этого, понятна крайняя важность большой митохондриальной массы в рабочих мышцах спортсменов циклических видов спорта. Без наличия должного количества митохондрий пируват , при работе требуемой интенсивности, начнет частично превращаться в лактат. А образовывающиеся ионы водорода будут постепенно закислять мышцу, и в ней, соответственно, будет развиваться утомление. Основная задача спортсменов этих видов спорта – переделать свои ПМВ и ГМВ в ОМВ, и тогда они станут практически неутомимыми, на той мощности, которую им позволят развить их силовые способности. Если этой мощности будет недостаточно, то у них единственный путь дальнейшего прогресса – гипертрофировать свои ОМВ. В ОМВ митохондрии находятся на предельном уровне развития. В два слоя митохондрии не могут окружать миофибриллу. Поэтому окислительные мышечные волокна не поддаются развитию в плане увеличения выносливости. А вот если их гипертрофировать, то есть если в мышечном волокне будут добавляться новые миофибриллы, вокруг новых миофибрилл будут появляться митохондрии, то тогда аэробные возможности будут расти.
А в чём польза митохондрий для спортсменов силовых видов спорта? В том, что они могут поглощать ионы водорода в ГМВ и ПМВ. А это позволяет более длительно выполнять упражнение и быстрее восстанавливаться между подходами. Даже в таких скоростно-силовых видах спорта, как тяжелая атлетика, когда отдых между подходами составляет 2-3-5 минут, возникает проблема с восстановлением мышц. А они могут восстановиться только в том случае если молочная кислота уходит. А она частично уходит в кровь, а частично попадает в соседние мышечные волокна. Либо в тех же МВ попадает в митохондрии и превращается в воду. Так вот, если нет собственных митохондрий, то процессы выхода молочной кислоты в кровь или в соседние мышечные волокна достаточно длительны и спортсмен долго восстанавливается. Поэтому правильно подготовленный спортсмен-штангист, для того чтобы показывать стабильные результаты должен иметь в своих гликолитических волокнах митохондрии. Особенно это актуально на высшем спортивном уровне, когда в финале соревнований два или один спортсмена остаются со штангой и выходят на свой следующий подход практически через 3 минуты.
Очень важны митохондрии во всех видах единоборств, армрестлинге, гиревом спорте, многоповторном жиме, кроссфите.
Возникает вопрос, как силовикам тренировать митохондрии в своих ГМВ? Методы тренировок были разработаны в НИИ Фундаментальных и прикладных проблем физкультуры и спорта группой ученых под руководством профессора В. Н. Селуянова. Модель опиралась непосредственно на физиологию. Во-первых, по закону физиологии, чтобы тренировать ГМВ их надо включить в работу. Отсюда сразу вытекают требования к интенсивности работы, она должна быть в районе 80% от максимума. При такой нагрузке включаются практически все двигательные единицы. Надо помнить, что мышечные волокна рекрутируются не от веса как такового, а от той интенсивности, с которой прикладывается сила. Поэтому вес используемого отягощения должен быть не 80% от максимума. Его надо сбавить до 60-50, и даже 40 кг, а приложить силу соответствующую 80% психического напряжения. То есть выполнить движение почти с максимально возможной скоростью. Во-вторых, необходимо чтобы работа продолжалась достаточное время для того, чтобы возбудить те самые механизмы, которые будут потом обеспечивать гипертрофию митохондрий. Необходимо легкое закисление, появление свободного креатина, повышение концентрации анаболических гормонов в крови и МВ. В. Н. Селуянов рекомендует делать 10 повторений в подходе, если спортсмен не может выполнить 10 повторений, то вес снижается, но психическое напряжение остается тем же. Спортсмен должен выполнять каждое движение более интенсивно. В этом случае рекрутируются все ДЕ (МВ), а степень накопления свободного креатина и ионов водорода становятся оптимальными для стимулирования транскрипции – считывания информации с ДНК. Во время такого упражнения тратится не более 30% АТФ и КрФ, поэтому во время 2 мин восстановления накопление ионов водорода и лактата не превысит критического уровня, разрушающего митохондрии. Увеличение количества подходов приводит к постепенному накоплению гормонов в крови и активной мышечной ткани, поэтому 10 подходов обеспечивают требуемую концентрацию гормонов в МВ. Главное условие – не перетренироваться! После 10-й серии должно ощущаться лишь легкое локальное утомление. Митохондрии поглощают ионы водорода, но при их избытке просто лопаются. Поэтому продолжительные тяжелые тренировки с сильным закислением не приводят к увеличению выносливости, а наоборот напрочь ее убивают.
Как часто нужно делать подобные тренировки? Не реже трех раз в неделю. Можно ежедневно. Новая митохондрия образуется за 4 дня. Период ее полужизни 7-10 дней. 3 недели без тренировок и вся приобретенная выносливость падает. Если человек по вынужденным обстоятельствам долго находится без движения, например в коме или в гипсе, то митохондрии уходят даже из ММВ, и они становятся меленными гликолитическими. Такой больной после выздоровления утомляется, сделав несколько шагов. Так что физическая работоспособность киногероев вышедших из долгой комы, спустя несколько дней после выздоровления, как например, у героини Умы Турман в фильме «Убить Билла», просто физически не возможна.
Организм устроен мудро и экономично. Если двигательные единицы задействованы постоянно, то миофибриллы в них просто оплетены митохондриями, и это ОМВ. Если в повседневной жизни они задействуются раз в неделю, а то и реже, то и митохондрий в них практически нет и это ГМВ. Зачем содержать и питать ненужные органеллы. Но, если образ жизни меняется на более интенсивный, выносливость растёт очень быстро. Как я уже писал, новые митохондрии образуются уже через 4 дня после тренировки. А через два месяца ежедневных тренировок достигают максимума своего развития.
Источник: nksport.ru
Что такое митохондрии?
Митохондрии – это энергетическая база клеток, их деятельность основана на окислении органических соединений и применении энергии, освободившейся при распаде молекул АТФ. Биологи на простом языке его называют станцией вырабатывания энергии для клеток. В 1850 г. митохондрии выявили в виде гранул в мышцах. Их число менялось в зависимости от условий роста: они скапливаются больше в тех клетках, где большой дефицит кислорода. Это происходит чаще всего при физических нагрузках. В таких тканях появляется острая нехватка энергии, которую восполняют митохондрии.
В 1850 г. митохондрии выявили в виде гранул в мышцах. Их число менялось в зависимости от условий роста: они скапливаются больше в тех клетках, где большой дефицит кислорода. Это происходит чаще всего при физических нагрузках. В таких тканях появляется острая нехватка энергии, которую восполняют митохондрии.
Появление термина и место в теории симбиогенеза

В 1897 г. Бенд впервые ввел понятие «митохондрия», чтобы обозначить зернистую и нитчатую структуру в цитоплазме клеток. По форме и величине они разнообразны: толщина составляет 0,6 мкм, длина – от 1 до 11 мкм. В редких ситуациях митохондрии могут быть большого размера и разветвленным узлом.
В теории симбиогенеза дается четкое представление о том, что такое митохондрии и как они появились в клетках. В ней говорится, что хондриосома возникла в процессе поражения клетками бактерий, прокариотами. Так как они не могли автономно применять кислород для выработки энергии, это препятствовало полному их развитию, а прогеноты могли развиваться беспрепятственно. В течение эволюции связь между ними дала возможность прогенотам передать свои гены теперь уже эукариотам. Благодаря такому прогрессу митохондрии теперь не являются независимыми организмами. Их генофонд не может быть реализован в полной мере, так как происходит его частичная блокировка ферментами, которые есть в любой клетке.
Где они живут?
Митохондрии сосредотачиваются в тех районах цитоплазмы, где появляется необходимость в АТФ. Например, в мышечной ткани сердца они располагаются неподалеку от миофибрилл, а в сперматозоидах формируют защитную маскировку вокруг оси жгута. Там они вырабатывают очень много энергии для того, чтобы «хвост» крутился. Именно таким образом сперматозоид двигается к яйцеклетке.
В клетках новые митохондрии образуются с помощью простого деления предыдущих органелл. Во время него сохраняется вся наследственная информация.
Митохондрии: как они выглядят
По форме митохондрии напоминает цилиндр. Они часто встречаются в эукариотах, занимая от 10 до 21 % объема клетки. Их размеры и формы во многом разнятся и способны меняться в зависимости от условий, но ширина постоянна: 0,5-1 мкм. Перемещения хондриосом зависят от того, в каких местах клетки совершается быстрая трата энергии. Передвигаются по цитоплазме, применяя для передвижения структуры цитоскелета. Заменой разных по габаритам митохондрий, работающих отдельно друг от друга и снабжающих энергией некоторые зоны цитоплазмы, являются длинные и разветвленные митохондрии. Они способны обеспечить энергией участки клеток, находящиеся далеко друг от друга. Подобная совместная работа хондриосом наблюдается не только у одноклеточных организмов, но и у многоклеточных. Самое сложное строение хондриосом встречается в мышцах скелета млекопитающих, где самые большие разветвленные хондриосомы стыкуются друг с другом, используя межмитохондриальные контакты (ММК).
Заменой разных по габаритам митохондрий, работающих отдельно друг от друга и снабжающих энергией некоторые зоны цитоплазмы, являются длинные и разветвленные митохондрии. Они способны обеспечить энергией участки клеток, находящиеся далеко друг от друга. Подобная совместная работа хондриосом наблюдается не только у одноклеточных организмов, но и у многоклеточных. Самое сложное строение хондриосом встречается в мышцах скелета млекопитающих, где самые большие разветвленные хондриосомы стыкуются друг с другом, используя межмитохондриальные контакты (ММК).
Они представляют собой узкие просветы между прилегающими друг к другу митохондриальными мембранами. Данное пространство обладает высокой электронной плотностью. ММК больше встречаются в клетках сердечной мышцы, где связываются вместе с работающими хондриосомами.
Чтобы лучше разобраться в вопросе, нужно кратко расписать значимость митохондрии, строение и функции этих удивительных органелл.
Как они устроены?
Для понимания, что такое митохондрии, необходимо узнать их строение. Этот необычный источник энергии имеет форму шара, но чаще вытянут. Две мембраны располагаются близко друг к другу:
- наружная (гладкая);
- внутренняя, которая образует выросты листовидной (кристы) и трубчатой (тубулы) формы.
Если не принимать во внимание размер и форму митохондрии, строение и функции у них одинаковые. Хондриосома разграничена двумя мембранами, размером 6 нм. Наружная мембрана митохондрии напоминает емкость, которая ограждает их от гиалоплазмы. Внутреннюю мембрану от внешней отъединяет участок шириной 11-19 нм. Отличающей чертой внутренней мембраны считается ее способность выпячиваться внутрь митохондрии, принимая форму сплющенных гребней. Внутреннюю полость митохондрии заполняет матрикс, который имеет мелкозернистую структуру, где иногда обнаруживают нити и гранулы (15-20 нм). Нити матрикса создают молекулы ДНК органеллы, а гранулы небольших размеров – рибосомы митохондрии.
Внутреннюю полость митохондрии заполняет матрикс, который имеет мелкозернистую структуру, где иногда обнаруживают нити и гранулы (15-20 нм). Нити матрикса создают молекулы ДНК органеллы, а гранулы небольших размеров – рибосомы митохондрии.
Синтез АТФ на первой стадии проходит в гиалоплазме. На данной ступени идет начальное окисление субстратов или глюкозы до пировиноградной кислоты. Данные процедуры проходят без кислорода — анаэробное окисление. Следующая стадия образования энергии заключается в аэробном окислении и распада АТФ, данный процесс происходит в митохондриях клеток.
Что делают митохондрии?
Основными функциями этой органеллы являются:
-
выработка энергии для клеток;
-
хранение наследственной информации в виде собственной ДНК.

Наличие в митохондриях своей дезоксирибонуклеиновой кислоты еще раз подтверждает симбиотическую теорию появления этих органелл. Также, помимо основной работы, они участвуют в синтезе гормонов и аминокислот.
Митохондриальная патология
Мутации, происходящие в геноме митохондрии, приводят к удручающим последствиям. Носителем наследственной информации человека является ДНК, которая передается потомкам от родителей, а митохондриальный геном передается только от матери. Объясняется данный факт очень просто: цитоплазму с заключенными в ней хондриосомами дети получают вместе с женской яйцеклеткой, в сперматозоидах они отсутствуют. Женщины с данным отклонением могут передать потомству митохондриальное заболевание, больной мужчина – нет.
В обычных условиях хондриосомы располагают одинаковой копией ДНК — гомоплазмия. В геноме митохондрии могут происходить мутации, вследствие совместного существования здоровых и мутированных клеток возникает гетероплазмия.
Благодаря современной медицине на сегодняшний день выявлены более 200 заболеваний, поводом возникновения чего послужила мутация митохондрии ДНК. Не во всех случаях, но терапевтическому поддержанию и лечению митохондриальные болезни поддаются хорошо.
Вот мы и разобрались с вопросом о том, что такое митохондрии. Как и все остальные органеллы, они очень важны для клетки. Они косвенно принимают участие во всех процессах, для которых нужна энергия.
Источник: fb.ru
Отличительные характеристики
Митохондрии имеют характерную продолговатую или овальную форму и покрыты двойной мембраной. Они встречаются как в животных, так и в растительных клетках. Количество митохондрий внутри клетки изменяется в зависимости от типа и функции клетки. Некоторые клетки, такие как зрелые эритроциты, вообще не содержат митохондрий. Отсутствие митохондрий и других органелл оставляет место для миллионов молекул гемоглобина, необходимых для транспортировки кислорода по всему телу. С другой стороны, клетки мышц могут содержать тысячи митохондрий, генерирующих энергию, необходимую для мышечной активности. Митохондрии также обильны в жировых клетках и клетках печени.
Митохондриальная ДНК
Митохондрии имеют собственную ДНК (мтДНК), рибосомы и могут синтезировать свои собственные белки. мтДНК кодирует белки, участвующие в переносе электронов и окислительном фосфорилировании, которые происходят при клеточном дыхании. При окислительном фосфорилировании в матрице митохондрий генерируется энергия в виде АТФ. Протеины, синтезированные из мтДНК, также кодируются для продуцирования молекул РНК, передающих РНК и рибосомную РНК.
Митохондриальная ДНК отличается от ДНК, обнаруженной в ядре клетки, тем, что она не обладает механизмами восстановления ДНК, которые помогают предотвратить мутации в ядерной ДНК. В результате мтДНК имеет гораздо более высокую скорость мутаций, чем ядерная ДНК. Воздействие реактивного кислорода, образующегося при окислительном фосфорилировании, также повреждает мтДНК.
Строение митохондрий
Митохондрии окружены двойной мембраной. Каждая из этих мембран представляет собой фосфолипидный бислой со встроенными белками. Внешняя мембрана гладкая, а внутренняя мембрана имеет много складок. Эти складки называются кристами. Они повышают «производительность» клеточного дыхания за счет увеличения доступной площади поверхности.
Двойные мембраны делят митохондрию на две различные части: межмембранное пространство и матрицу митохондрий. Межмембранное пространство представляет собой узкую часть между двумя мембранами, в то время как митохондриальная матрица является частью, заключенной внутри мембран.
Митохондриальная матрица содержит мтДНК, рибосомы и ферменты. Некоторые из этапов клеточного дыхания, включая цикл лимонной кислоты и окислительное фосфорилирование, происходят в матрице из-за высокой концентрации ферментов.
Митохондрии полуавтономны, так как лишь частично зависят от клетки, чтобы реплицировать и расти. У них есть свои ДНК, рибосомы, белки и контроль над их синтезированием. Подобно бактериям, митохондрии имеют циркулярную ДНК и реплицируются репродуктивным процессом, называемым бинарным делением. До репликации митохондрии сливаются вместе в процессе, называемом слияние. Это необходимо для поддержания стабильности, так как без него митохондрии будут уменьшаться по мере их деления. Уменьшенные митохондрии не способны продуцировать достаточное количество энергии, необходимой для нормального функционирования клетки.
Источник: natworld.info