Роль рибосом в клетке
Отличительные характеристики
Рибосомы обычно состоят из двух субъединиц: большой субъединицы и малой субъединицы. Рибосомные субъединицы синтезируются в ядрышко и пересекают ядерную мембрану в цитоплазме через ядерные поры. Эти две субъединицы объединяются, когда рибосома присоединяется к матричной РНК (мРНК) во время синтеза белка. Рибосомы вместе с другой молекулой РНК, транспортной РНК (тРНК), помогают преобразовать кодирующие белок гены мРНК в белки. Рибосомы связывают аминокислоты вместе для образования полипептидных цепей, которые модифицируются далее, прежде чем станут функциональными белками.
Расположение в клетке
Есть два места, где рибосомы обычно существуют в эукариотической клетке: суспендированы в цитозоле (свободные рибосомы) и связаны с эндоплазматическим ретикулумом (связанные рибосомы). В обоих случаях рибосомы обычно образуют агрегаты, называемые полисомами или полирибосомами во время синтеза белка. Полирибосомы представляют собой кластеры рибосом, которые присоединяются к молекуле мРНК во время биосинтеза белка.
Это позволяет синтезировать сразу несколько копий белка из одной молекулы мРНК. Свободные рибосомы обычно производят белки, функционирующие в цитозоле (жидкий компонент цитоплазмы), тогда как связанные рибосомы обычно синтезируют белки, которые экспортируются из клетки или включаются в мембраны клетки.
Интересно, что свободные рибосомы и связанные рибосомы взаимозаменяемы, и клетка может изменять их число в соответствии с потребностями метаболизма.
Органеллы, такие как митохондрии и хлоропласты в эукариотических организмах, имеют свои собственные рибосомы, которые больше похожи на рибосомы, обнаруженные у бактерий. Субъединицы, содержащие рибосомы в митохондриях и хлоропластах, меньше (30S — 50S), чем субъединицы, обнаруженные во всей остальной части клетки (40S — 60S).
Рибосомы и протеин
Синтез белка протекает под воздействием процессов транскрипции и трансляции. В транскрипции генетический код, содержащийся в ДНК, транскрибируется в версию РНК кода, известного как матричная РНК (мРНК). В трансляции вырабатывается растущая аминокислотная цепь, также называемая полипептидной цепью. Рибосомы помогают трансформировать мРНК и связывать аминокислоты вместе для получения полипептидной цепи, которая в конечном итоге становится полностью функционирующим белком. Белки — очень важные биологические полимеры в наших клетках, поскольку они задействованы практически во всех функциях.
Источник: natworld.info
Внешний вид рибосомы и ее другие особенности
Если внимательно рассмотреть клетку на электронных микрофотографиях, то можно увидеть небольшие частицы, расположенные в цитоплазме. Этими частицами и являются рибосомы.

Название «рибосома» состоит из двух частей. Первая походит от «рибонуклеиновая кислота», а вторая в переводе с греческого «сома» — тело.
Размер рибонуклеиновых частиц клетки колеблется в пределах 15-20 нм, а количество их полностью зависит от процесса биосинтеза белка, а именно — его интенсивности. Как правило, рибосом может быть около 5000 штук, в некоторых случаях – до 90 000. Если говорить о массе этого количества частиц, она порой может доходить до четверти массы самой клетки.
Форма рибосомы больше напоминает сферу, но однозначно констатировать этот факт невозможно. А вот функция рибосом в клетке связана с биосинтезом белка, и это подтвержденный факт.
По своей химической природе эти частицы относятся к нуклеопротеидам (комбинация нуклеиновых кислот с белком), которые состоят из рибонуклеиновой кислоты.
Прокариотический тип
Существует два типа рибосомы, строение и функции которых немного отличаются друг от друга.
Первый тип характерен для клеток бактерий и зеленых водорослей, то есть прокариотических организмов. Ее название — 70S рибосома, функции она выполняет все те же. Число в названии означает коэффициент седиментации (величина, которая определяет размер и форму макромолекул, а также скорость осаждения определенной микрочастицы, в данном случае рибосомы, в достаточно сильном гравитационном поле). Для этого типа он составляет 70 единиц Сведберга. Данные рибосомы состоят из двух неравноправных частиц: 30S и 50S. В первой составляющей находится одна молекула белка, во второй – две молекулы РНК. Основная функция, которую выполняют молекулы белка, входящие в состав рибосомы – структурная.

Эукариотический тип
Второй тип рибосом был обнаружен в клетках эукариотов (растительные или же животные организмы, у которых в клетках присутствует четко выраженное ядро). Название этой субчастицы – 80S. Рибосомы, функции которых заключаются в синтезе белка данного класса, состоят из равных частей РНК и белка. Но все те же две неравные субъединицы есть и в них (60S и 40S).
Рибосомы: строение и функции
Рибосома состоит из двух неравных субъединиц.
Большая субчастица, в свою очередь, состоит из:
- одной молекулы рибосомальной РНК, которая является высокополимерной;
- одной молекулы РНК, которая является низкополимерной;
- некоторого количества молекул белка, как правило, их около трех десятков.
Что касается меньшей субчастицы, то тут немного проще. В ее состав входят:
- молекула высокополимерной РНК;
- несколько десятков молекул белка, как правило, около 40 штук (молекулы при этом разнообразные по структуре и форме).

Молекула высокополимерной РНК необходима для того, чтобы все присутствующие белки соединить в одну целостную рибонуклеопротеидную составляющую клетки.
В процессе выполнения основной своей функции, то есть во время синтеза белка, рибосома выполняет и ряд дополнительных:
- Связка, а также удержание всех составляющих так называемой белоксинтезирующей системы. Принято называть данную функцию информационной, или матричной. Рибосома функции эти распределяет между двумя своими субчастицами, каждая из которых выполняет свою определенную задачу в данном процессе.
- Рибосомы выполняют функцию каталитическую, которая заключается в образовании особой пептидной связи (амидная связь, которая возникает как при образовании белков, так и при возникновении пептидов). Сюда же можно отнести и гидролиз ГТФ (субстрата для синтеза РНК). За выполнение этой функции отвечает большая субъединица рибосомы. Именно в ней находятся специальные участки, в которых и происходит процесс синтеза пептидной связи, а также центр необходимый для гидролиза ГТФ. Помимо этого именно большая субъединица рибосомы во время биосинтеза белка удерживает на себе цепь, которая постепенно вырастает.
- Выполняет рибосома функции механического передвижения субстратов, к коим относятся иРНК и тРНК. Иными словами, они отвечают за транслокацию.
В качестве заключения
Буквально каждая из субъединиц рибосомы, как большая, так и маленькая, может проявлять в некоторой степени те функции, которые непосредственно с ней связаны, отдельно от своей «соседки». Однако выполнять функцию транслокации может лишь рибосома в полном составе.
Можно смело сказать, что существует четкое разделение функций между частицами рибосомы. Малая часть отвечает за выполнение приема, а также расшифровку генетической информации. А вот большая частица принимает непосредственное участие в транслитерации.
Источник: www.syl.ru
Состав рибосомы[править | править код]
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК[править | править код]
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков.
ищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали.
состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы[править | править код]
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы[править | править код]
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки[править | править код]
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты[править | править код]
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции[править | править код]
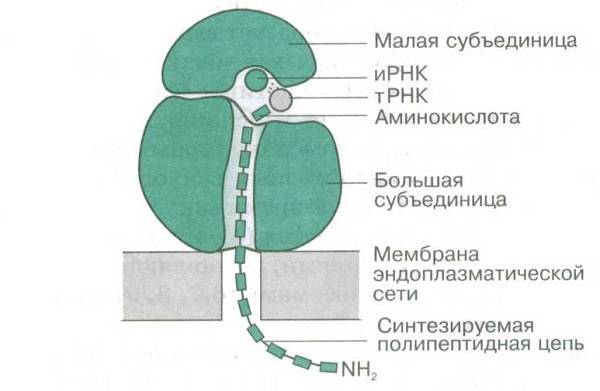
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы[править | править код]
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Литература[править | править код]
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Источник: ru.wikipedia.org
Какую функцию выполняют рибосомы
Назначение описываемого органоида в любой клетке заключается в осуществлении синтеза белков. Белки используются практически всеми клетками:
- в качестве катализаторов — ускоряют время реакции;
- в качестве волокон — обеспечивают стабильность клетки;
- многие белки имеют индивидуальные задачи.

Основным хранилищем информации в клетках служит молекула дезоксирибонуклеиновой кислоты (ДНК). Специальный фермент, РНК-полимераза, связывается с молекулой ДНК и создает «зеркальную копию» — матричную рибонуклеиновую кислоту (мРНК), свободно перемещающуюся из ядра в цитоплазму клетки.
Цепочка рибонуклеиновой кислоты обрабатывается при выходе из ядра; области РНК, которые не кодируют белки, удаляются; мРНК используется для дальнейшего синтеза белка.
Каждая мРНК состоит из 4 различных нуклеиновых кислот, тройки которых составляют кодоны. Каждый кодон определяет специфическую аминокислоту. В организме всех живых существ на Земле встречаются 20 аминокислот. Кодоны, используемые для спецификации аминокислот, почти универсальны.
Кодон, запускающий все белки — «AUG», последовательность нуклеиновых оснований:
- аденин;
- урацил;
- гуанин.
Специальная молекула РНК поставляет аминокислоты для синтеза — транспортная РНК или тРНК. К активному кодону подходит тРНК, несущая соответствующую аминокислоту, ассоциируется с ним. Происходит образование пептидной связи новой аминокислоты со строящимся белком.
Где образуются рибосомы
Составные части органоида образуются в ядрышке. Две субъединицы объединяются для начала химического процесса синтеза белка из цепи мРНК. Рибосома действует в качестве катализатора, образуя пептидные связи между аминокислотами. Использованная тРНК высвобождается обратно в цитозоль, в дальнейшем она может связываться с другой аминокислотой.

Органоид достигнет стоп-кодона мРНК (UGA, UAG и UAA), остановив процесс синтеза. Специальные белки (факторы терминации) прервут цепочку аминокислот, отделив ее от последней тРНК — формирование белка закончится.
Различные белки требуют некоторых модификаций, транспортировки в определенные области клетки до начала функционирования. Рибосома, прикрепленная к эндоплазматическому ретикулуму, поместит вновь образованный белок внутрь, он пройдет дополнительные модификации, будет должным образом свернут. Другие белки образуются непосредственно в цитозоли, где действуют как катализатор для различных реакций.
Рибосомы создают нужные клеткам белки, составляющие около 20 процентов состава клетки. Приблизительно в клетке находится 10 000 различных белков, приблизительно по миллиону копий каждого.
Рибосома эффективно и быстро участвует в синтезе, добавляя 3-5 аминокислот к белковой цепи в секунду. Короткие белки, содержащие несколько сотен аминокислот, могут быть синтезированы за считанные минуты.
Состав и строение рибосом
Рибосомы имеют схожую структуру в клетках всех организмов Земли, незаменимы при синтезе белков. В начале эволюции различных форм жизни рибосома была принята в качестве универсального способа перевода РНК в белки. Эти органоиды изменяются в различных организмах незначительно.

Описываемые органоиды состоят из большой и малой субъединицы, располагающихся вокруг молекулы мРНК. Каждая субъединица представляет собой комбинацию белков и РНК, называемых рибосомальной РНК (рРНК).
Длина рРНК в разных цепях разная. рРНК окружена белками, создающими рибосому. рРНК удерживает мРНК и тРНК в органоиде и действует в качестве катализатора для ускорения образования пептидных связей между аминокислотами.
Рибосомы измеряются в единицах Svedberg, означающих сколько времени требуется молекуле для осаждения из раствора в центрифуге. Чем больше число, тем больше молекула.
Различия между прокариотическими и эукариотическими рибосомами рассмотрены в таблице.
| Критерий | Прокариотические | Эукариотические |
| Размер в единицах Svedberg | 70S | 80S |
| содержание белков и РНК | меньше белков и меньше РНК | больше белков и больше РНК |
| содержание молекул РНК | 3 молекулы РНК | 4 молекулы РНК |
Рибосомы отвечают за процесс синтеза белка – двигательной силы организма и являются одним из ключевых органоидов живой клетки, представленной во всем многообразии живых существ на Земле.
Источник: 1001student.ru