Какие компоненты составляют тело рибосомы
Строение рибосом
Рибосомы относятся к немембранным органоидам. Они очень мелкие (около 20 нм), но многочисленные (тысячи и даже миллионы на клетку), состоят из двух частей – субъединиц. В состав субчастиц входят рибосомальные РНК (рРНК) и рибосомные белки, т. е. рибосомы по химическому составу являются рибонуклеопротеидами. Однако в них также присутствует небольшое количество низкомолекулярных соединений. Из-за многочисленности рибосом, рРНК составляет более половины от всей РНК клетки.
Одну из субъединиц называют «малой», вторую – «большой».
В собранной из субъединиц рибосоме выделят два (по одним источникам) или три (по другим) участка, которые называют сайтами. Один из участков обозначают A (aminoacyl) и называют аминоацильным, второй — P (peptidyl) — пептидильный. Данные сайты являются основными каталитическими центрами протекающих на рибосомах реакций. Третий участок обозначают E (exit), через него освободившаяся от синтезируемого полипептида транспортная РНК (тРНК), покидает рибосому.
Кроме перечисленных сайтов на рибосомах есть другие участки, используемые для связывания различных ферментов.
Когда субъединицы диссоциированы (разъединены) специфичность сайтов теряется, т. е. они определяются сочетанием соответствующих областей обеих субъединиц.
Отличие рибосом прокариот и эукариот
Соотношение по массе белков и РНК в рибосоме примерно поровну. Однако у прокариот белков меньше (около 40%).
Размеры как самих рибосом, так и субъединиц выражают в скорости их седиментации (осаждения) при центрифугировании. При этом S обозначает константу Сведберга — единицу, характеризующую скорость оседания в центрифуге (чем больше S, тем быстрее частица осаждается, а значит тяжелее). У прокариот рибосомы имеют размер в 70S, а у эукариот — в 80S (т. е. они тяжелее и крупнее). При этом субъединицы прокариотических рибосом имеют значения 30S и 50S, а эукариотических — 40S и 60S. Размеры рибосом в митохондриях и хлоропластах эукариот сходны с прокариотическими (хотя имеют определенную вариабельность по размерам), что может указывать на их происхождение от древних прокариотических организмов.
У прокариот в состав большой субъединицы рибосом входит две молекулы рРНК и более 30 молекул белка, в состав малой — одна молекула рРНК и около 20 белков. У эукариот в субъединицах больше молекул белка, а также в большой субъединице три молекулы рРНК. Составляющие рибосому белки и молекулы рРНК обладают способностью к самосборке и в итоге образуют сложную трехмерную структуру. Структуру рРНК поддерживают ионы магния.
Синтез рРНК
У эукариот в состав рибосом входят 4 вида рРНК. При этом три образуются из одного транскрипта-предшественника — 45S рРНК. Он синтезируется в ядрышке (на петлях хромосом его формирующем) при помощи РНК-полимеразы-1. Гены рРНК имеют много копий (десятки и сотни) и обычно располагаются на концах разных пар хромосом. После синтеза 45S рРНК разрезается на 18S, 5.8S и 28S рРНК, каждая из которых подвергается тем или иным модификациям.
Четвертый вид рРНК синтезируется вне ядрышка с помощью фермента РНК-полимеразы-3. Это 5S РНК, которая после синтеза не нуждается в процессинге.
Третичная структура рРНК в составе рибосом очень сложная и компактная. Она служит каркасом для размещения рибосомных белков, которые выполняют вспомогательные функции для поддержания структуры и функциональности.
Функция рибосом
Функционально рибосомы являются местом связывания молекул, участвующих в синтезе (мРНК, тРНК, различные факторы). Именно в рибосоме молекулы могут занять друг по отношению к другу такое положение, которое позволит быстро протечь химической реакции реакции.
В эукариотических клетках рибосомы могут находиться свободно в цитоплазме или быть прикрепленными с помощью специальных белков к ЭПС (эндоплазматическая сеть, она же ЭР — эндоплазматический ретикулум).
В процессе трансляции рибосома перемещается по мРНК. Часто по одной нитевидной мРНК двигаются несколько (или множество) рибосом, образуя так называемую полисому (полирибосому).
Источник: biology.su
Какую функцию выполняют рибосомы
Назначение описываемого органоида в любой клетке заключается в осуществлении синтеза белков. Белки используются практически всеми клетками:
- в качестве катализаторов — ускоряют время реакции;
- в качестве волокон — обеспечивают стабильность клетки;
- многие белки имеют индивидуальные задачи.

Основным хранилищем информации в клетках служит молекула дезоксирибонуклеиновой кислоты (ДНК). Специальный фермент, РНК-полимераза, связывается с молекулой ДНК и создает «зеркальную копию» — матричную рибонуклеиновую кислоту (мРНК), свободно перемещающуюся из ядра в цитоплазму клетки.
Цепочка рибонуклеиновой кислоты обрабатывается при выходе из ядра; области РНК, которые не кодируют белки, удаляются; мРНК используется для дальнейшего синтеза белка.
Каждая мРНК состоит из 4 различных нуклеиновых кислот, тройки которых составляют кодоны. Каждый кодон определяет специфическую аминокислоту. В организме всех живых существ на Земле встречаются 20 аминокислот. Кодоны, используемые для спецификации аминокислот, почти универсальны.
Кодон, запускающий все белки — «AUG», последовательность нуклеиновых оснований:
- аденин;
- урацил;
- гуанин.
Специальная молекула РНК поставляет аминокислоты для синтеза — транспортная РНК или тРНК. К активному кодону подходит тРНК, несущая соответствующую аминокислоту, ассоциируется с ним. Происходит образование пептидной связи новой аминокислоты со строящимся белком.
Где образуются рибосомы
Составные части органоида образуются в ядрышке. Две субъединицы объединяются для начала химического процесса синтеза белка из цепи мРНК. Рибосома действует в качестве катализатора, образуя пептидные связи между аминокислотами. Использованная тРНК высвобождается обратно в цитозоль, в дальнейшем она может связываться с другой аминокислотой.

Органоид достигнет стоп-кодона мРНК (UGA, UAG и UAA), остановив процесс синтеза. Специальные белки (факторы терминации) прервут цепочку аминокислот, отделив ее от последней тРНК — формирование белка закончится.
Различные белки требуют некоторых модификаций, транспортировки в определенные области клетки до начала функционирования. Рибосома, прикрепленная к эндоплазматическому ретикулуму, поместит вновь образованный белок внутрь, он пройдет дополнительные модификации, будет должным образом свернут. Другие белки образуются непосредственно в цитозоли, где действуют как катализатор для различных реакций.
Рибосомы создают нужные клеткам белки, составляющие около 20 процентов состава клетки. Приблизительно в клетке находится 10 000 различных белков, приблизительно по миллиону копий каждого.
Рибосома эффективно и быстро участвует в синтезе, добавляя 3-5 аминокислот к белковой цепи в секунду. Короткие белки, содержащие несколько сотен аминокислот, могут быть синтезированы за считанные минуты.
Состав и строение рибосом
Рибосомы имеют схожую структуру в клетках всех организмов Земли, незаменимы при синтезе белков. В начале эволюции различных форм жизни рибосома была принята в качестве универсального способа перевода РНК в белки. Эти органоиды изменяются в различных организмах незначительно.

Описываемые органоиды состоят из большой и малой субъединицы, располагающихся вокруг молекулы мРНК. Каждая субъединица представляет собой комбинацию белков и РНК, называемых рибосомальной РНК (рРНК).
Длина рРНК в разных цепях разная. рРНК окружена белками, создающими рибосому. рРНК удерживает мРНК и тРНК в органоиде и действует в качестве катализатора для ускорения образования пептидных связей между аминокислотами.
Рибосомы измеряются в единицах Svedberg, означающих сколько времени требуется молекуле для осаждения из раствора в центрифуге. Чем больше число, тем больше молекула.
Различия между прокариотическими и эукариотическими рибосомами рассмотрены в таблице.
| Критерий | Прокариотические | Эукариотические |
| Размер в единицах Svedberg | 70S | 80S |
| содержание белков и РНК | меньше белков и меньше РНК | больше белков и больше РНК |
| содержание молекул РНК | 3 молекулы РНК | 4 молекулы РНК |
Рибосомы отвечают за процесс синтеза белка – двигательной силы организма и являются одним из ключевых органоидов живой клетки, представленной во всем многообразии живых существ на Земле.
Источник: 1001student.ru
Эндоплазматическая сеть
Эндоплазматическая сеть (син.
доплазматический ретикулум) – органоид эукариотической клетки. В клетках разного типа и при различных функциональных состояниях этот компонент клетки может выглядеть по-разному, но во всех случаях – это лабиринтная протяженная замкнутая мембранная структура, построенная из сообщающихся трубкообразных полостей и мешочков, называемых цистернами. Снаружи от мембран эндоплазматической сети находится цитозоль (гиалоплазма, основное вещество цитоплазмы), а просвет эндоплазматической сети представляет собой замкнутое пространство (компартмент), сообщающееся посредством везикул (транспортных пузырьков) с комплексом Гольджи и внешней для клетки средой. Эндоплазматическая сеть делится на две функционально различные структуры: гранулярную (шероховатую) эндоплазматическую сеть и гладкую (агранулярную) эндоплазматическую сеть.
Гранулярная эндоплазматическая сеть, в клетках секретирующих белок, представлена системой многочисленных плоских мембранных цистерн с рибосомами на наружной поверхности. Комплекс мембран гранулярной эндоплазматической сети связан с наружной мембраной оболочки ядра и перинуклеарной (околоядерной) цистерной.
В гранулярной эндоплазматической сети происходит синтез белков и липидов для всех мембран клетки, синтезируются ферменты лизосом, а также осуществляется синтез секретируемых белков, т.е. предназначенных для экзоцитоза. (Остальные белки синтезируются в цитоплазме на рибосомах, не связанных с мембранами ЭС.) В просвете гранулярной ЭС белок окружается мембраной, и образующиеся пузырьки отделяются (отпочковываются) от несодержащих рибосомы областей ЭС, которые и доставляют содержимое в другую органеллу – комплекс Гольджи – путем слияния с ее мембраной.
Та часть ЭС, на мембранах которой рибосомы отсутствуют, называется гладким эндоплазматическим ретикулумом. Гладкая эндоплазматическая сеть не содержит уплощенных цистерн, а представляет собой систему анастомозирующих мембранных канал
ов, пузырьков и трубочек. Гладкая сеть является продолжением гранулярной, однако не содержит рибофоринов – гликопротеиновых рецепторов, с которыми соединяется большая субъединица рибосом и поэтому не связана с рибосомами.
Функции гладкой эндоплазматической сети многообразны и зависят от типа клеток. Гладкая эндоплазматическая сеть участвует в метаболизме стероидных, например, половых гормонов. В ее мембранах локализованы управляемые кальциевые каналы и энергозависимые кальциевые насосы. Цистерны гладкой эндоплазматической сети специализированы для накопления в них Са2+ путем постоянного откачивания Са2+ из цитозоля. Подобные депо Са2+ существуют в скелетной и сердечной мышцах, нейронах, яйцеклетке, эндокринных клетках и др. Различные сигналы (например, гормоны, нейромедиаторы, факторы роста) влияют на активность клеток путем изменения концентрации внутриклеточного посредника – Са2+. В гладкой эндоплазматической сети клеток печени происходит обезвреживание вредных веществ, (например ацетальдегида, образующегося из алкоголя), метаболическая трансформация лекарств, образование большей части липидов клетки и их накопление, например при жировой дистрофии. В полости ЭС содержится много различных молекул-компонентов. Среди них имеют большое значение белки шапероны.

Шапероны (англ. букв. – пожилая дама, сопровождающая молодую девушку на балах) – семейство специализированных внутриклеточных белков, обеспечивающих быстрое и правильное сворачивание (фолдинг) вновь синтезированных молекул белка. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия для формирования вторичной и третичной структуры растущего пептида. Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока (hsp 60, hsp 70, hsp 90). Синтез этих белков активируется при многих стрессах, в частности, при тепловом шоке (отсюда и название heart shook protein – белок теплового шока, а цифра обозначает его молекулярную массу в килодальтонах). Эти шапероны предотвращают денатурацию белков при высокой температуре и др. экстремальных факторах. Связываясь с аномальными белками, восстанавливают их нормальную конформацию и тем самым повышают выживаемость организма при резком ухудшении физико-химических параметров среды.
Источник: StudFiles.net
Эндоплазматическая сеть
Эндоплазматическая сеть (син. эндоплазматический ретикулум) – органоид эукариотической клетки. В клетках разного типа и при различных функциональных состояниях этот компонент клетки может выглядеть по-разному, но во всех случаях – это лабиринтная протяженная замкнутая мембранная структура, построенная из сообщающихся трубкообразных полостей и мешочков, называемых цистернами. Снаружи от мембран эндоплазматической сети находится цитозоль (гиалоплазма, основное вещество цитоплазмы), а просвет эндоплазматической сети представляет собой замкнутое пространство (компартмент), сообщающееся посредством везикул (транспортных пузырьков) с комплексом Гольджи и внешней для клетки средой. Эндоплазматическая сеть делится на две функционально различные структуры: гранулярную (шероховатую) эндоплазматическую сеть и гладкую (агранулярную) эндоплазматическую сеть.
Гранулярная эндоплазматическая сеть, в клетках секретирующих белок, представлена системой многочисленных плоских мембранных цистерн с рибосомами на наружной поверхности. Комплекс мембран гранулярной эндоплазматической сети связан с наружной мембраной оболочки ядра и перинуклеарной (околоядерной) цистерной.
В гранулярной эндоплазматической сети происходит синтез белков и липидов для всех мембран клетки, синтезируются ферменты лизосом, а также осуществляется синтез секретируемых белков, т.е. предназначенных для экзоцитоза. (Остальные белки синтезируются в цитоплазме на рибосомах, не связанных с мембранами ЭС.) В просвете гранулярной ЭС белок окружается мембраной, и образующиеся пузырьки отделяются (отпочковываются) от несодержащих рибосомы областей ЭС, которые и доставляют содержимое в другую органеллу – комплекс Гольджи – путем слияния с ее мембраной.
Та часть ЭС, на мембранах которой рибосомы отсутствуют, называется гладким эндоплазматическим ретикулумом. Гладкая эндоплазматическая сеть не содержит уплощенных цистерн, а представляет собой систему анастомозирующих мембранных канал
ов, пузырьков и трубочек. Гладкая сеть является продолжением гранулярной, однако не содержит рибофоринов – гликопротеиновых рецепторов, с которыми соединяется большая субъединица рибосом и поэтому не связана с рибосомами.
Функции гладкой эндоплазматической сети многообразны и зависят от типа клеток. Гладкая эндоплазматическая сеть участвует в метаболизме стероидных, например, половых гормонов. В ее мембранах локализованы управляемые кальциевые каналы и энергозависимые кальциевые насосы. Цистерны гладкой эндоплазматической сети специализированы для накопления в них Са2+ путем постоянного откачивания Са2+ из цитозоля. Подобные депо Са2+ существуют в скелетной и сердечной мышцах, нейронах, яйцеклетке, эндокринных клетках и др. Различные сигналы (например, гормоны, нейромедиаторы, факторы роста) влияют на активность клеток путем изменения концентрации внутриклеточного посредника – Са2+. В гладкой эндоплазматической сети клеток печени происходит обезвреживание вредных веществ, (например ацетальдегида, образующегося из алкоголя), метаболическая трансформация лекарств, образование большей части липидов клетки и их накопление, например при жировой дистрофии. В полости ЭС содержится много различных молекул-компонентов. Среди них имеют большое значение белки шапероны.

Шапероны (англ. букв. – пожилая дама, сопровождающая молодую девушку на балах) – семейство специализированных внутриклеточных белков, обеспечивающих быстрое и правильное сворачивание (фолдинг) вновь синтезированных молекул белка. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия для формирования вторичной и третичной структуры растущего пептида. Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока (hsp 60, hsp 70, hsp 90). Синтез этих белков активируется при многих стрессах, в частности, при тепловом шоке (отсюда и название heart shook protein – белок теплового шока, а цифра обозначает его молекулярную массу в килодальтонах). Эти шапероны предотвращают денатурацию белков при высокой температуре и др. экстремальных факторах. Связываясь с аномальными белками, восстанавливают их нормальную конформацию и тем самым повышают выживаемость организма при резком ухудшении физико-химических параметров среды.
Источник: StudFiles.net

Общее представление о трансляции, то есть сборке протеина по чертежу матричной РНК, было дано раньше, в главе 16. Центральной фигурой в этом сложном процессе является рибосома. Именно она является прорабом, ответственным за создание сложных протеиновых конструкций. Она собирает в одном месте всех участников, необходимых для совершения процесса трансляции: матричную РНК (мРНК), которая является чертежом для построения протеина, а также транспортные РНК (тРНК), каждая из которых несет с собой строительный материал в виде конкретной аминокислоты.
Механизм создания протеинов, который будет описан ниже, настолько древний, что даже в клетках млекопитающих и прокариот, эволюционно максимально удаленных друг от друга, он практически идентичен. Различия есть, конечно, но очевидно, что они эволюционировали от единственного набора органелл и молекул, позволившего в далеком Катархее выжить и размножиться некой клетке-«прародительнице». В ходе эволюции живых организмов общий план строения рибосомы почти не менялся. Тем не менее рибосомы бактерий, рибосомы цитоплазмы эукариот и рибосомы органелл имеют множество различий: по размеру, молекулярному составу и т.п. Некоторые из органелл клетки имеют свои собственные рибосомы, чтобы осуществлять синтез протеинов внутри себя и не утруждаться протаскиванием их снаружи через свою шкуру-мембрану.
Рибосома бактерий немного меньше и проще устроена, чем рибосома эукариот, но в целом они очень похожи. Поэтому если речь идет о рибосоме без уточнения, какая из них имеется в виду, значит данный факт подходит к обеим. Если описание будет касаться только одной из них, то будет пояснение, к чему оно относится. Рибосомы органелл могут быть нескольких видов, и различия между ними и клеточными рибосомами более существенные, поэтому речь о них пойдет в посвященных этим органеллам главах.

На этой картинке показаны сравнительные размеры рибосомы (большая желтая штука), тРНК (две запутанные изогнутые синие молекулы) и участка мРНК, состоящего из 35 нуклеотидов. Для наглядности можно вспомнить, что диаметр орбиты электрона в невозбуждённом атоме водорода равен 0,1 нанометра, так что можно оценить, насколько малы изображенные здесь рибосома и молекулы. Например, высота тРНК равна длине цепочки всего лишь из 60 атомов водорода.
Рибосомы очень малы и погружены во внутриклеточную жидкость, поэтому важной их характеристикой является скорость их осаждения (то есть выпадения в осадок). Представь себе две молекулы, составленные из одинакового набора атомов, но скомпонованы они по-разному: одна имеет форму компактного шара, а другая — широкой пластины. Очевидно, что раз площадь их поверхности настолько отличается, то и их движение сквозь жидкость будет отличаться: шар будет перемещаться быстрее, чем пластина, так как сила сопротивления окружающей среды для шара будет намного меньше. С другой стороны, если две молекулы имеют одинаковый размер площади сечения, но разную массу, то более тяжелая молекула будет выпадать в осадок быстрее, так как она имеет большую инерцию, и частицы окружающей среды будут оказывать на нее меньшее воздействие. Таким образом, скорость осаждения молекул и частиц дает представление об их пространственной протяженности и об их массе. В зависимости от быстроты осаждения частицам присваивается коэффициент седиментации ( sedimentation coefficient [sedɪmen’teɪʃn kəu’fɪʃnt] ): чем быстрее осаждаются частицы, тем этот коэффициент выше. Для совершенно одинаковых молекул этот коэффициент будет одним и тем же, поэтому например каждая рибосома эукариот имеет коэффициент седиментации, равный 80S, и ее принято обозначать как 80S-частицу. Это гораздо удобнее, чем каждый раз писать «рибосома эукариотической клетки». Бактериальная рибосома имеет коэффициент седиментации 70S и обозначается как 70S-частица, что указывает на меньшую скорость осаждения.

На картинке вверху рибосома изображена очень схематично, так что заметно только разделение ее на две субъединицы ( subunit [‘sʌbjuːnɪt] ): большую и малую. Справа ты видишь гораздо более подробную схему эукариотической рибосомы. Несмотря на то, что на первый взгляд это выглядит как спутанная разноцветная мочалка ( loofah [‘luːfə] ), она демонстрирует как разделение рибосомы на 2 субъединицы, так и молекулярный состав этих частей.
Основу каждой субъединицы составляют молекулы РНК: малой субъединице хватает одной рРНК (рибосомальной РНК), а в большой их 3. У бактериальной рибосомы, меньшей по размеру, большая субъединица обходится только двумя рРНК. Рибосомальные РНК большой субъединицы здесь обозначены синим цветом, а рРНК малой субъединицы — оранжевым. Для каждой из молекул подписан коэффициент седиментации, цвет подписи соответствует цвету молекулы на картинке. Например, три рибосомальных РНК большой субъединицы имеют коэффициенты 28S, 5,8S и 5S. По этим цифрам понятно, что в большой субъединице одна рРНК значительно крупнее двух других.
Остальные молекулы в составе эукариотической рибосомы являются небольшими протеинами. На схеме они обозначены черными спиралями. Заметно, что из РНК состоит больше половины «тела» рибосомы. Они образуют ее каркас, в который встраиваются протеины. С помощью различных опытов было установлено, что рРНК и протеины работают слаженно, и каждое движение рибосомы, каждый инициированный ею процесс требует участия обоих видов молекул.
На этой схеме указано, что большая субъединица имеет коэффициент седиментации, равный 60S, а малая — 40S. Получается, что коэффициент седиментации полной рибосомы (80S) меньше, чем сумма коэффициентов двух ее субъединиц. Причина этого в том, что получающаяся при соединении субъединиц рибосома более протяженна в пространстве, чем это было бы, если бы эти субъединицы просто были бы вложены друг в друга так, чтобы занимаемый ими объем не увеличился. То есть, когда мы складываем две отдельные субъединицы вместе, то их совокупная масса конечно равняется сумме их отдельных масс, но и площадь сечения тоже увеличивается. Чтобы это было яснее, рассмотрим простой пример. Допустим, что мы сделали что-то с рибосомой, не добавляя никаких атомов к ней и не отнимая от нее никакие атомы, после чего измерили её коэффициент седиментации и обнаружили, что он теперь равняется не 80S, а 70S. Что бы нам это сказало? Так как коэффициент уменьшился, значит скорость осаждения уменьшилась, а значит сопротивление среды выросло. Значит в результате нашего воздействия рибосома стала менее компактной, площадь ее сечения выросла.

Слева — схема 30S-частицы, или малой субъединицы ( small subunit [smɔːl ‘sʌbjuːnɪt] ) бактериальной рибосомы. Ее коэффициент седиментации немного меньше, чем у малой субъединицы эукариотической рибосомы. При этом их функция одинакова: они служат каркасом, на котором молекулы тРНК, каждая из которых несет какую-то определенную аминокислоту, могут быть точно сопоставлены с кодонами мРНК. Малая субъединица не просто предоставляет тРНК и мРНК «место для встречи», но и располагает мРНК удобным образом, и придерживает нижнюю часть тРНК, содержащую антикодон, для лучшего закрепления ее на соответствующем ей кодоне мРНК.
Таким образом, только рибосома создает такие условия, при которых возможно присоединение нижнего конца тРНК к кодонам, составляющим мРНК, и в этом есть огромный смысл: если бы тРНК и мРНК могли соединяться запросто, без создания им таких комфортных условий, то в клетке наступил бы полный хаос: не успеет только что построенная мРНК осмотреться, найти свою рибосому, как со всех сторон ее уже облепили бы тРНК и просто висели бы на ней, потому что сами они протеин из принесенных аминокислот построить не в состоянии. Для этого им нужна большая субъединица.

В то время как малая субъединица контактирует с нижними концами тРНК, удерживая их внутри рибосомы и сопоставляя с мРНК, большая субъединица занимается их верхними концами, на которых тРНК несут аминокислоты. Деление на «нижний» и «верхний» концы транспортной рибосомы конечно же условно: просто именно так их принято изображать на схемах трансляции. Большая субъединица создает для тРНК полости внутри себя, так называемые «сайты связывания», и работает с аминокислотами. Недостаточно просто поднести две аминокислоты друг к другу, чтобы они соединились: необходимо отсоединить их от тРНК и придать им некий «импульс», потратить энергию для создания между аминокислотами специальной, так называемой «пептидной связи» ( peptide bond [‘pɛptʌɪd bɔnd] ). Именно сопоставлением аминокислот и сообщением им необходимой для соединения энергии и занимается большая субъединица. Здесь показана большая субъединица бактериальной рибосомы, или 50S-частица.

Очевидно, что рибосома как-то развивалась, эволюционировала до появления таких сложнозакрученных молекул, ювелирно перемещающих внутри себя транспортные и матричную РНК. Эволюционный путь, пройденный животными и растениями, можно восстановить по частям их ископаемых предков, но пока не найдены гигантские окаменелые рибосомы, приходится искать другие пути. Канадские биохимики Константин Боков и Сергей Штейнберг нашли способ узнать, как могла сформироваться настолько сложная органелла клетки. Исследование заключалось в последовательном выполнении следующих действий:
1. отделить мелкую часть рибосомы (один из протеинов, или часть рибосомальной РНК)
2. оценить изменения в пространственной структуре рибосомы, оставшейся без этой части. Если оставшиеся молекулы продолжали держаться вместе, если конфигурация их оставалась такой же, как в полной рибосоме, то выдвигалась гипотеза, что именно такой состав молекул имел более древний вариант рибосомы до того, как она эволюционировала, отрастив у себя как раз ту мелкую часть, которая была удалена в процессе опыта.
3. изучить, какую функцию, или часть функции, рибосома утратила вместе с удаленной частью. Вполне вероятно, что именно для реализации этой функции эта часть и была присоединена когда-то.
4. изучить функционирование оставшихся молекул рибосомы, понять — что она может делать, могла ли древняя клетка использовать такую рибосому для поддержания своей жизнедеятельности.
5. после проделывания всех этих процедур можно откинуться в кресле с бутером в зубах, ну а потом продолжить: отделить следующую часть рибосомы, оценить пространственную структуру остатка, посмотреть, на что этот остаток будет способен…
Повторяя эти действия, ученые шаг за шагом «раздевали» рибосому, удалив 93% составляющих ее молекул. И в итоге добрались до той ее части, с которой предположительно и началось существование этих синтезирующих протеины органелл: дальнейшее удаление частей молекул приводило к тому, что остаток просто разваливался на нефункциональные части. Эта часть в современной рибосоме отвечает за создание связи между аминокислотами, когда новая аминокислота присоединяется к строящемуся протеину.
Оставшиеся 7% рибосомы представляют собой РНК длиной в 110 нуклеотидов, которая имеет сайт для присоединения одной транспортной РНК. Если этот фрагмент удвоить, он может опознавать и удерживать уже не одну, а две тРНК. И не просто удерживать, а переносить аминокислоту с одной тРНК на другую, так что этот двойной фрагмент является самой простой, но уже функционально активной проторибосомой, которая может синтезировать протеины. То, что она именно функционально активна, подтвердил эксперимент: созданный учеными удвоенный минимальный остаток рибосомы был способен проводить реакцию присоединения одной аминокислоты к другой.
Той части, которой современная рибосома удерживает матричную РНК, в проторибосоме нет. Поэтому последовательность аминокислот в первичной молекуле протеина на том этапе ничем не задавалась, она была случайной. Постепенно проторибосома обрастала новыми и новыми элементами, и чтобы понять, в какой последовательности это происходило, какие свойства приносила каждая новая часть, достаточно «промотать в обратном направлении» результаты разбиения рисобомы на части. Первые восемь элементов, присоединенные к проторибосоме, придали ей дополнительную устойчивость. Следующие 12 элементов увеличили массу. На ранних стадиях рибосомы существовали как тела, построенные исключительно из РНК, но когда они «наработали» какое-то количество протеинов, то стали использовать их для усложнения своей структуры, приобретения новых функций. Когда все элементы были собраны воедино, сформировались две субъединицы рибосомы, состоящих как из РНК, так и из протеинов — именно в том виде, в котором мы можем их наблюдать в современных клетках. «Наши результаты продемонстрировали, — пишет Сергей Штейнберг, — что такая сложная структура, как рибосома, могла самостоятельно построиться из простых молекул, которые взаимодействовали между собой по очень простым химическим правилам. Это могло произойти в эволюции за относительно короткое время».
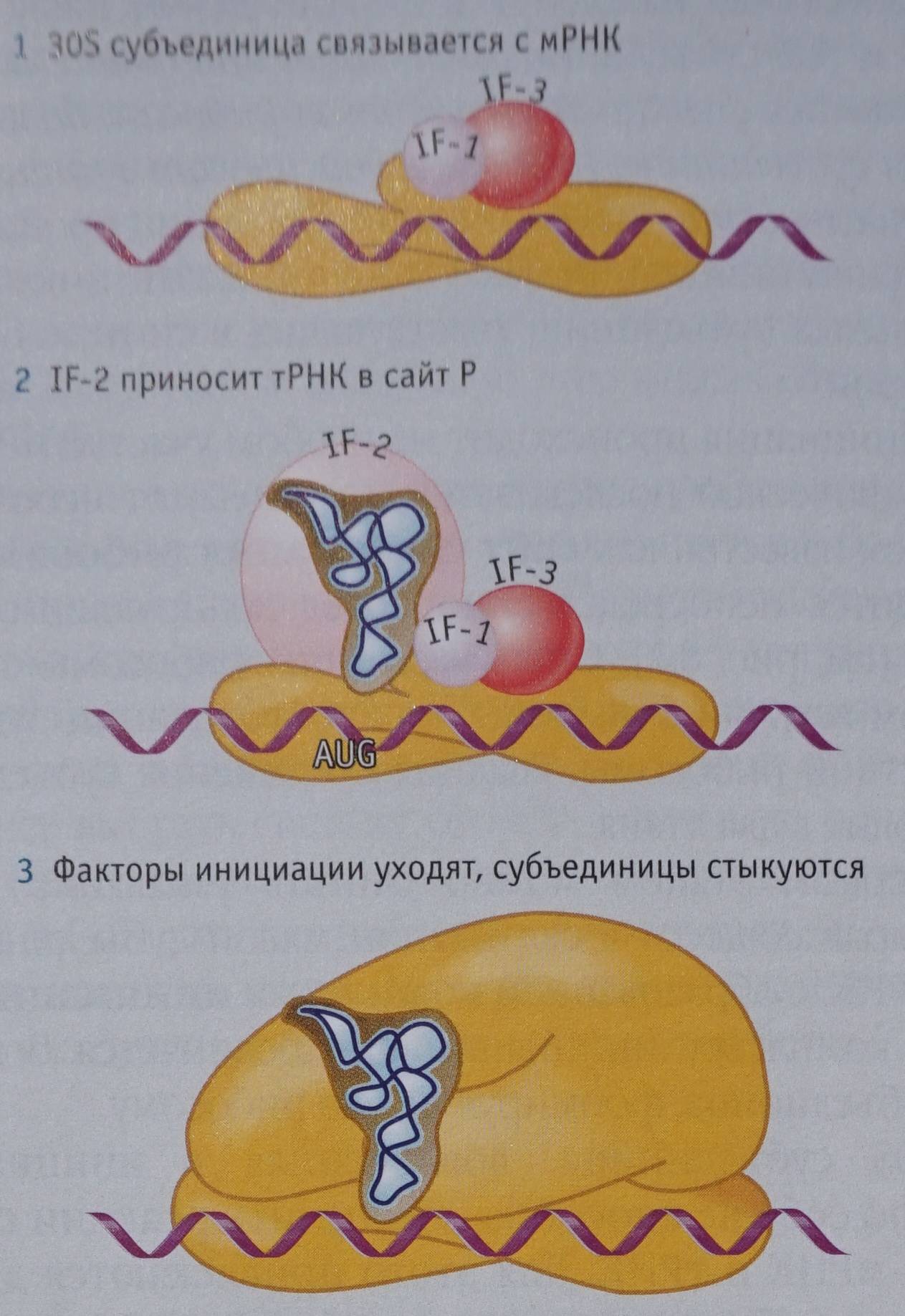
Есть существенное отличие рибосомы от других органелл клетки: она существует в том виде, который здесь описан, только во время выполнения своей функции синтеза протеина. Все остальное время отдыхающая рибосома находится в клетке в разобранном состоянии: большая и малая субъединица плавают отдельно друг от друга, и только после обнаружения малой субъединицей готовой к трансляции мРНК большая субъединица присоединяется к ней. Субъединицы неразлучны во время синтеза протеина, но как только он завершен, они разъединяются и расплываются в разные стороны. У бактериальных и эукариотических рибосом соединение субъединиц и начало трансляции протекает по-разному. Процесс начала, или инициации ( initiation [ɪnɪʃɪ’eɪʃn] ), синтеза протеина бактериальной рибосомой немного проще, поэтому стоит начать с него. Все, что написано ниже, касается именно бактериальной рибосомы:
1. Пока малая субъединица плавает в одиночестве, к ней не могут присоединиться ни матричная РНК, ни большая субъединица. Процесс трансляции начинается с того, что малая субъединица сталкивается с молекулами протеинов, которые называют факторами инициации ( initiating factor [ɪnɪʃɪ’eɪʃn ‘fæktə] ). Именно эти протеины запускают цепочку процессов, необходимых для старта трансляции. Факторов инициации у бактериальной рибосомы найдено только 3, их так и обозначают: IF-1, IF-2 и IF-3. Каждый из них имеет определенное место на малой субъединице, к которому может присоединиться. Для начала синтеза протеина необходимо, чтобы все 3 фактора инициации выполнили свою функцию.

Первым из них «садится» на малую субъединицу IF-3, и в результате его присутствия к ней может присоединиться мРНК. Только IF-3 может присоединиться к свободно плавающей малой субъединице. Только после этого присоединения другие частицы могут начать присоединяться к полученному комплексу.
2. К комплексу «малая субъединица + IF-3» может присоединиться мРНК. А вот большая субъединица все еще не может вступить в процесс, так как не все условия для ее присоединения на данном этапе присутствуют.

3. К комплексу «малая субъединица + IF-3 + мРНК» присоединяются еще два фактора инициации: IF-1 и IF-2, при этом последний несет с собой особую транспортную РНК, которую называют инициаторной РНК ( initiation RNA [ɪnɪʃɪ’eɪʃn ɑ:r en eɪ] ). Про нее речь пойдет в следующей главе генетической линии учебника, а пока достаточно знать, что только инициаторная тРНК может быть связана с IF-2 и начать трансляцию. Любая другая тРНК просто не способна взаимодействовать с IF-2.
Малая субъединица уже начала выполнять свою функцию придерживания мРНК для удобства вставания на нее тРНК. Она подставляет для считывания два кодона, и на первом из них протеин IF-2 закрепляет инициаторную тРНК. Присоединение любой тРНК на второй открытый кодон сейчас нежелательно (причина этого будет объяснена позже), поэтому требуется его закрыть на время. Для этого и используется протеин IF-1, садящийся на этот кодон, перекрывая к нему доступ. Очень простое и эффективное решение.
4. Как только малая субъединица, мРНК и инициаторная тРНК прочно сцепились, IF-3 проверяет: является ли присоединенная тРНК инициаторной и присоединилась ли она в нужном месте мРНК. Такие дополнительные проверки часто встречаются при синтезе протеинов. Первый раз IF-3 проверил, что эта тРНК является именно инициаторной, в момент соединения с ней, но тогда могла произойти ошибка, которая и будет исправлена во время второй проверки.
Если результат проверки положительный, все три фактора инициации уходят, и только тогда большая субъединица может соединиться с малой, «накрывая» собой инициаторную тРНК и мРНК. Очевидно, что здесь требуется большая точность стыковки: большая субъединица должна «приземлиться» так, чтоб инициаторная тРНК проскользнула внутрь, встав в один из сайтов внутри собравшейся рибосомы. Если бы IF-1 не блокировал второй открытый для считывания кодон и на него бы села вторая тРНК, большая субъединица испытывала бы сложности с присоединением. Ведь ей пришлось бы изворачиваться так, чтобы в нужные места внутри рибосомы встали уже две тРНК. Чем сложнее действие, тем больше вероятность промедлений и ошибок, поэтому в процессе эволюции и возник IF-1, блокирующий один из кодонов мРНК и таким образом упрощающий процесс присоединения большой субъединицы.
Такое соединение субъединиц бактериальной рибосомы может осуществляться только на одном участке мРНК, который называют сайтом связывания ( binding site [‘baɪndɪŋ saɪt] ) рибосомы. Он находится непосредственно перед участком, кодирующим протеин. В одной из следующих глав будет подробно рассмотрено строение матричной РНК, а пока просто прими как факт, что кроме кодирующих участков на ней есть еще и «служебные», подающие разные сигналы таким участникам трансляции, как вспомогательные факторы и рибосома.
На этом инициация трансляции завершена, рибосома собрана, спокойна и готова к работе.
Источник: bodhi.name