Строение рибосомы рисунок
Строение и функции рибосом необходимо знать любому современному человеку. Функционирование клетки живого организма – сложный процесс, продолжающийся в течение жизни организма.
Рибосомы представляют собой органоиды клетки, участвующие в сложном клеточном механизме трансляции генетического кода в цепи аминокислот. Длинные цепи аминокислот соединяются между собой, образуя белки, выполняющие различные функции. Схема строения рибосомы показана на рисунке ниже.
- Какую функцию выполняют рибосомы
- Где образуются рибосомы
- Состав и строение рибосом
Какую функцию выполняют рибосомы
Назначение описываемого органоида в любой клетке заключается в осуществлении синтеза белков. Белки используются практически всеми клетками:
- в качестве катализаторов — ускоряют время реакции;
- в качестве волокон — обеспечивают стабильность клетки;
- многие белки имеют индивидуальные задачи.

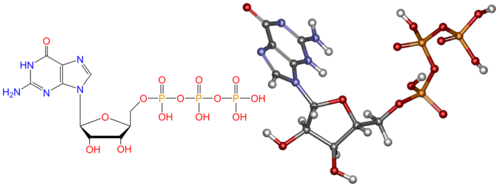
Основным хранилищем информации в клетках служит молекула дезоксирибонуклеиновой кислоты (ДНК). Специальный фермент, РНК-полимераза, связывается с молекулой ДНК и создает «зеркальную копию» — матричную рибонуклеиновую кислоту (мРНК), свободно перемещающуюся из ядра в цитоплазму клетки.
Цепочка рибонуклеиновой кислоты обрабатывается при выходе из ядра; области РНК, которые не кодируют белки, удаляются; мРНК используется для дальнейшего синтеза белка.
Каждая мРНК состоит из 4 различных нуклеиновых кислот, тройки которых составляют кодоны. Каждый кодон определяет специфическую аминокислоту. В организме всех живых существ на Земле встречаются 20 аминокислот. Кодоны, используемые для спецификации аминокислот, почти универсальны.
Кодон, запускающий все белки — «AUG», последовательность нуклеиновых оснований:
- аденин;
- урацил;
- гуанин.
Специальная молекула РНК поставляет аминокислоты для синтеза — транспортная РНК или тРНК. К активному кодону подходит тРНК, несущая соответствующую аминокислоту, ассоциируется с ним. Происходит образование пептидной связи новой аминокислоты со строящимся белком.
Где образуются рибосомы
Составные части органоида образуются в ядрышке. Две субъединицы объединяются для начала химического процесса синтеза белка из цепи мРНК. Рибосома действует в качестве катализатора, образуя пептидные связи между аминокислотами. Использованная тРНК высвобождается обратно в цитозоль, в дальнейшем она может связываться с другой аминокислотой.

Органоид достигнет стоп-кодона мРНК (UGA, UAG и UAA), остановив процесс синтеза. Специальные белки (факторы терминации) прервут цепочку аминокислот, отделив ее от последней тРНК — формирование белка закончится.
Различные белки требуют некоторых модификаций, транспортировки в определенные области клетки до начала функционирования. Рибосома, прикрепленная к эндоплазматическому ретикулуму, поместит вновь образованный белок внутрь, он пройдет дополнительные модификации, будет должным образом свернут. Другие белки образуются непосредственно в цитозоли, где действуют как катализатор для различных реакций.
Рибосомы создают нужные клеткам белки, составляющие около 20 процентов состава клетки. Приблизительно в клетке находится 10 000 различных белков, приблизительно по миллиону копий каждого.
Рибосома эффективно и быстро участвует в синтезе, добавляя 3-5 аминокислот к белковой цепи в секунду. Короткие белки, содержащие несколько сотен аминокислот, могут быть синтезированы за считанные минуты.
Состав и строение рибосом
Рибосомы имеют схожую структуру в клетках всех организмов Земли, незаменимы при синтезе белков. В начале эволюции различных форм жизни рибосома была принята в качестве универсального способа перевода РНК в белки. Эти органоиды изменяются в различных организмах незначительно.

Описываемые органоиды состоят из большой и малой субъединицы, располагающихся вокруг молекулы мРНК. Каждая субъединица представляет собой комбинацию белков и РНК, называемых рибосомальной РНК (рРНК).
Длина рРНК в разных цепях разная. рРНК окружена белками, создающими рибосому. рРНК удерживает мРНК и тРНК в органоиде и действует в качестве катализатора для ускорения образования пептидных связей между аминокислотами.
Рибосомы измеряются в единицах Svedberg, означающих сколько времени требуется молекуле для осаждения из раствора в центрифуге. Чем больше число, тем больше молекула.
Различия между прокариотическими и эукариотическими рибосомами рассмотрены в таблице.
| Критерий | Прокариотические | Эукариотические |
| Размер в единицах Svedberg | 70S | 80S |
| содержание белков и РНК | меньше белков и меньше РНК | больше белков и больше РНК |
| содержание молекул РНК | 3 молекулы РНК | 4 молекулы РНК |
Рибосомы отвечают за процесс синтеза белка – двигательной силы организма и являются одним из ключевых органоидов живой клетки, представленной во всем многообразии живых существ на Земле.
Источник: 1001student.ru
Строение рибосом
Рибосомы относятся к немембранным органоидам. Они очень мелкие (около 20 нм), но многочисленные (тысячи и даже миллионы на клетку), состоят из двух частей – субъединиц. В состав субчастиц входят рибосомальные РНК (рРНК) и рибосомные белки, т. е. рибосомы по химическому составу являются рибонуклеопротеидами. Однако в них также присутствует небольшое количество низкомолекулярных соединений. Из-за многочисленности рибосом, рРНК составляет более половины от всей РНК клетки.
Одну из субъединиц называют «малой», вторую – «большой».
В собранной из субъединиц рибосоме выделят два (по одним источникам) или три (по другим) участка, которые называют сайтами. Один из участков обозначают A (aminoacyl) и называют аминоацильным, второй — P (peptidyl) — пептидильный. Данные сайты являются основными каталитическими центрами протекающих на рибосомах реакций. Третий участок обозначают E (exit), через него освободившаяся от синтезируемого полипептида транспортная РНК (тРНК), покидает рибосому.
Кроме перечисленных сайтов на рибосомах есть другие участки, используемые для связывания различных ферментов.
Когда субъединицы диссоциированы (разъединены) специфичность сайтов теряется, т. е. они определяются сочетанием соответствующих областей обеих субъединиц.
Отличие рибосом прокариот и эукариот
Соотношение по массе белков и РНК в рибосоме примерно поровну. Однако у прокариот белков меньше (около 40%).
Размеры как самих рибосом, так и субъединиц выражают в скорости их седиментации (осаждения) при центрифугировании. При этом S обозначает константу Сведберга — единицу, характеризующую скорость оседания в центрифуге (чем больше S, тем быстрее частица осаждается, а значит тяжелее). У прокариот рибосомы имеют размер в 70S, а у эукариот — в 80S (т. е. они тяжелее и крупнее). При этом субъединицы прокариотических рибосом имеют значения 30S и 50S, а эукариотических — 40S и 60S. Размеры рибосом в митохондриях и хлоропластах эукариот сходны с прокариотическими (хотя имеют определенную вариабельность по размерам), что может указывать на их происхождение от древних прокариотических организмов.
У прокариот в состав большой субъединицы рибосом входит две молекулы рРНК и более 30 молекул белка, в состав малой — одна молекула рРНК и около 20 белков. У эукариот в субъединицах больше молекул белка, а также в большой субъединице три молекулы рРНК. Составляющие рибосому белки и молекулы рРНК обладают способностью к самосборке и в итоге образуют сложную трехмерную структуру. Структуру рРНК поддерживают ионы магния.
Синтез рРНК
У эукариот в состав рибосом входят 4 вида рРНК. При этом три образуются из одного транскрипта-предшественника — 45S рРНК. Он синтезируется в ядрышке (на петлях хромосом его формирующем) при помощи РНК-полимеразы-1. Гены рРНК имеют много копий (десятки и сотни) и обычно располагаются на концах разных пар хромосом. После синтеза 45S рРНК разрезается на 18S, 5.8S и 28S рРНК, каждая из которых подвергается тем или иным модификациям.
Четвертый вид рРНК синтезируется вне ядрышка с помощью фермента РНК-полимеразы-3. Это 5S РНК, которая после синтеза не нуждается в процессинге.
Третичная структура рРНК в составе рибосом очень сложная и компактная. Она служит каркасом для размещения рибосомных белков, которые выполняют вспомогательные функции для поддержания структуры и функциональности.
Функция рибосом
Функционально рибосомы являются местом связывания молекул, участвующих в синтезе (мРНК, тРНК, различные факторы). Именно в рибосоме молекулы могут занять друг по отношению к другу такое положение, которое позволит быстро протечь химической реакции реакции.
В эукариотических клетках рибосомы могут находиться свободно в цитоплазме или быть прикрепленными с помощью специальных белков к ЭПС (эндоплазматическая сеть, она же ЭР — эндоплазматический ретикулум).
В процессе трансляции рибосома перемещается по мРНК. Часто по одной нитевидной мРНК двигаются несколько (или множество) рибосом, образуя так называемую полисому (полирибосому).
Источник: biology.su
Рибосомы — это уникальные природные фабрики, синтезирующие белок. Небольшие шарообразные органоиды, диаметр которых составляет 10-30 нм. Рибосомы представляют собой комплексы рибосомальной РНК с белками.

Рибосомы всех живых организмов состоят из двух субъединиц — малой субъединицы, и большой субъединицы.
Рибосомы формируются в ядрышках ядра, а затем выходят в цитоплазму, где и начинают выполнять свою главную функцию – синтез белков.
Рассмотрим процесс участия рибосом в синтезе белков.
Мы ранее говорили о том что генетический код записан на языке нуклеотидов..
В состав которых входят азотистые основания аденин, гуанин, цитозин, которые входят в состав как ДНК, так и РНК. Тимин (T) входит в состав только ДНК, а урацил встречается только в РНК.
Азотистые основания — это 4 строительных кирпичика молекулы ДНК.

Синтез белков начинается с того что в ядре цепь ДНК расплетается с одной из её цепей происходит считывание информации (то есть ДНК выступает как матрица).
Другими словами, происходит перенос генетической информации (ее копирование) с ДНК на РНК.

Такая РНК называется матричной (или информационной) так как она несёт информацию из ядра в цитоплазму на рибосомы.
Сама матричная РНК состоит из кодонов триплетов (в последствии 1 кодон будет кодировать 1 аминокислоту). А из аминокислот как вы знаете состоят белки. И уже в цитоплазме – рибосомы, захватывают матричную РНК.

Однако сперва к матричной РНК присоединяется малая субъединица рибосомы.
Ещё одна важная молекула (транспортная РНК). Она доставляет к рибосомам аминокислоты.
Транспортная РНК выглядит в форме "клеверного листа" и содержит в своём составе тройку нуклеотидов, которую называют антикодоном.

Антикадон взаимосоответствует, то есть комплементарен кодону в матричной РНК с которым он связывается. К концу транспортной РНК присоединена соответствующая аминокислота.
Присоединяясь большая субъединица рибосомы формирует пептидильный (или П-участок) и аминоацильный (или А-участок).

Входящая в А участок вторая транспортная РНК взаимосоответствует, то есть комплементарна второму кодону. Аминокислота первой транспортной РНК переноситься на аминокислоту второй транспортной РНК.
Первая транспортная РНК уходит, и рибосома продвигается дальше до конца матричной РНК.

Таким образом происходит присоединение аминокислот, которые на поверхности рибосомы формируются в полипептидную цепочку.
Таким образом малая субъединица опознает подходящую РНК и место на ней, с которого нужно начать синтез белка. А большая субъединица, содержащая каталитический центр, присоединяется ко всей конструкции и ускоряет образование пептидной связи между растущей полипептидной цепочкой будущего белка и каждой последующей аминокислотой.
Рибосомы могут свободно перемещаться в цитоплазме. Либо прикрепляться к эндоплазматической сети.
Рассмотрим строение и функции эндоплазматической сети.
Эндоплазматическая сеть или эндоплазматический ретикулум как её ещё называют − это внутриклеточный органоид эукариотической клетки, который представляет собой разветвлённую систему из окружённых мембраной уплощённых полостей, пузырьков и канальцев.

Каналы эндоплазматической сети могут пронизывать всю цитоплазму клетки. Они могут ветвиться и соединяться друг с другом, образуя транспортную систему клетки.
Структура эндоплазматической сети не является стабильной и подвержена частым изменениям.
Мембрана эндоплазматической сети морфологически идентична оболочке клеточного ядра и составляет с ней одно целое. Таким образом, её полости открываются в межмембранную полость ядерной оболочки.
Выделяют два вида эндоплазматической сети.
Часть мембран сети покрыта рибосомами – эту часть эндоплазматической сети называют шероховатой (гранулярной).
На шероховатой эндоплазматической сети происходит синтез белков в рибосомах.
Другая часть эндоплазматической сети называется гладкой (агранулярной). Она выполняет транспортную функцию белков.
Посмотрим, как это происходит.
Синтезированный рибосомами белок подходит к мембране эндоплазматической сети в это время она выгибается, захватывает белок и таким образом образуется пузырёк с белком − везикула.
Агранулярная эндоплазматическая сеть также участвует во многих процессах метаболизма. Также она играет важную роль в углеводном обмене, нейтрализации ядов и запасании ионов кальция. Ферменты агранулярной эндоплазматической сети участвуют в синтезе различных липидов и фосфолипидов, жирных кислот и стероидов.
Эндоплазматическая сеть — это транспортная система клетки. В которой происходит синтез белков, липидов и других веществ которые необходимы как самой клетке, так и многим другим клеткам. Если речь идёт о многоклеточно организме.
Также эндоплазматическая сеть принимает участие в том числе и в создании новой ядерной оболочки (например, после митоза).
Строение и функции комплекса Гольджи.
Синтезированные на рибосомах белки проходят через эндоплазматическую сеть и в виде везикул транспортируются в комплекс Гольджи.

Который представлен в виде полостей, уложенных своеобразными стопками.
В отделах комплекса Гольджи белки изменяют свои формы (дозревают). Здесь к ним при помощи специальных ферментов присоединяются такие материалы как липиды и углеводы. Такие белки используются клеткой.
Комплекс Гольджи выполняет роль сортировщика белков. Белки с одинаковой сигнальной последовательностью будут отправлены в одинаковые части клетки, либо за пределы клетки.
Каким же образом это происходит?
От расширений цистерн комплекса Гольджи отщепляются пузырьки, содержащие эти белки. В дальнейшем они могут сливаться друг с другом и увеличиваться в размерах, образуя секреторные гранулы.
После этого секреторные гранулы начинают двигаться к поверхности клетки, соприкасаются с плазмолеммой, с которой сливаются их собственные мембраны, и таким образом содержимое гранул оказывается за пределами клетки.
Так изменённые и сортированные белки выходят из комплекса Гольджи в виде пузырьков.
Из пузырьков комплекса Гольджи содержащей ферменты образуются и (удалить и) пищеварительные органеллы лизосомы.
Рассмотрим строение и функции лизосом.
Лизосома – это окружённый мембраной клеточный органоид, который содержит в себе большой набор ферментов, способных разрушать пищевые вещества.
Данные ферменты формируются из белков в комплексе Гольджи.
Как вы уже знаете клетка захватывает необходимые ей вещества либо при помощи фагоцитоза, либо при помощи пиноцитоза. Поступившие питательные вещества необходимо расщепить (переварить).
Как вы знаете белки расщепляются до аминокислот, полисахариды до глюкозы, а липиды – до глицерина и жирных кислот. И для того что бы, например, полисахарид расщепился, и клетка получила необходимые ей молекулы глюкозы. Ему необходимо встретиться с лизосомой, которая содержит необходимые ферменты для расщепления.
Участие лизосомы в процессе питания простейших, также имеют немаловажную роль. Амёба питается путём фагоцитоза, поглощая бактерий, одноклеточные водоросли и мелких простейших.

Крупные частицы пищи захватываются в пищеварительные вакуоли, которые сливаются с лизосомами. Куда начинают поступать ферменты для переваривания.
Продукты переваривания проникают в цитозоль и используются в качестве пищи. Ферменты лизосомы очень активны, однако они не разрушают окружающую их мембрану.
Иногда лизосомы способны разрушить клетку, в которой они находятся.
Такой процесс разрушения − автолиз просто необходим будущей лягушке.
Лизосомы постепенно переваривают все клетки хвоста головастика во время его превращения в лягушку. А образовавшиеся во время этого процесса вещества всасываются и используются другими клетками тела.

Так же лизосомы можно назвать сборщиками мусора. Они уничтожают повреждённые или изношенные части клетки. К примеру, во время замены старых органоидов новыми, или переваривание белков и других веществ, произведённых внутри самой клетки. Лизосомы своими ферментами расщепляют весь клеточный мусор.
Такой процесс называется аутофагией — уничтожение ненужных клетке структур.
Источник: videouroki.net
Оглавление
1. Введение
2. Информационная РНК
3. Генетический код
4. Транспортные РНК и аминоацил-тРНК-синтетазы
5. Рибосомы
6. Трансляция
7. Сворачивание и транспорт белков
8. Заключение
9. Список литературы
1. Введение
Жизнь есть способ существования белковых тел. Это определение, данное Фридрихом Энгельсом, указывает на исключительную роль белков в функционировании организмов. Биосинтез белка – чрезвычайно сложный и энергозатратный процесс. Он является основой жизнедеятельности клетки.
Синтез белка осуществляется в рибосомах и проходит в несколько этапов по схеме ДНК→РНК→белок. Двухцепочечная молекула ДНК на основе принципа комплементарности транскрибируется в одноцепочечную молекулу РНК. В результате получается матричная РНК, которая содержит информацию об аминокислотной последовательности белка. Далее мРНК поступает в рибосому и по ней, как по матрице, синтезируется белок, путем перевода генетической информации с языка нуклеотидной последовательности на язык аминокислотной последовательности. Шаг за шагом строится полипептидная цепь, которая в процессе синтеза и после него модифицируется в биологически активный протеин. Синтезированный белок транспортируется в разные участки клетки для выполнения своих функций.
Кодирование аминокислотной последовательности белков осуществляется по определенным правилам, называемых генетическим кодом. Расшифровка генетического кода – очень значимое достижение науки. Код объясняет механизм синтеза белка, происхождение мутаций и другие биологические явления.
Рентгеноструктурный анализ и другие современные методы исследования позволили далеко продвинутся в изучении биосинтеза белка и других аспектов молекулярной биологии. Но тем не менее все еще не установлены пространственные структуры некоторых жизненно важных макромолекул. Науке предстоит ответить на многие вопросы, касающиеся белкового синтеза.
Общая схема биосинтеза белка
Общая схема биосинтеза белков в клетке: ДНК→РНК→белок (Рисунок 1).

Рисунок 1. Общая схема биосинтеза белков в клетке
Транскрипция. Отдельные участки двухцепочечной ДНК (гены) служат матрицами для синтеза на них однотяжевых цепей РНК по принципу комплементарности. Транскрипция проходит в три стадии: инициация, элонгация, терминация.
Процессинг и транспорт. В процессе синтеза РНК подвергается изменениям, в результате которых превращается в зрелую молекулу, пригодную для синтеза белка. Получающаяся информационная (матричная) РНК (мРНК) затем поступает к рибосомам в качестве программы, определяющей аминокислотную последовательность в синтезируемом белке.
Активация и акцептирование аминокислот. Белки состоят из аминокислот, но свободные аминокислоты клетки не могут быть непосредственно использованы рибосомой. Каждая аминокислота сначала активируется с помощью АТФ, а затем присоединяется к специальной молекуле РНК – трансферной (транспортной) РНК (тРНК) вне рибосомы. Получающаяся аминоацил-тРНК поступает в рибосому в качестве субстрата для синтеза белка.
Трансляция. Поток информации в виде мРНК и поток материала в виде аминоацил-тРНК поступают в рибосомы, которые осуществляют перевод (трансляцию) генетической информации с языка нуклеотидной последовательности мРНК на язык аминокислотной. Каждая рибосома движется вдоль мРНК от одного конца к другому и соответственно выбирает из среды те аминоацил-тРНК, которые соответствуют (комплементарны) триплетным комбинациям нуклеотидов, находящимся в данный момент в рибосоме. Аминокислотный остаток выбранной аминоацил-тРНК каждый раз ковалентно присоединяется рибосомой к растущей полипептидной цепи, а деацилированная тРНК освобождается из рибосомы в раствор. Так последовательно строится полипептидная цепь.
Формирование функционального белка. По ходу синтеза полипептидная цепь высвобождается из рибосомы и сворачиваться в глобулу. Сворачивание и транспорт белка сопровождаются ферментативными модификациями (процессинг белка).
Несмотря на большую сложность аппарата биосинтеза белков, он протекает с чрезвычайно высокой скоростью. Синтез тысяч различных белков в каждой клетке строго упорядочен – при данных условиях метаболизма синтезируется лишь необходимое число молекул каждого белка.
2. Информационная РНК
Информационная (матричная) РНК (мРНК) – РНК, являющаяся комплементарной копией участков значащих цепей генов ДНК, содержащих информацию об аминокислотных последовательностях полипептидных цепей белков.
Структура мРНК
Первичная структура

Рисунок 2. Химическое строение полинуклеотида РНК
Матричная РНК — одноцепочечный полинуклеотид (Рисунок 2). Он состоит из четырех нуклеотидов. Нуклеотид ы состоят из азотистого основания (аденин – А, гуанин – G, цитозин – C и урацил – U), сахара рибозы и фосфатной группы. 5'-гидроксил концевого нуклеозида (молекула, содержащая азотистое основание, связанное с сахаром) не образует связи между нуклеотидами. Он обозначается как 5'-конец РНК, а другой концевой нуклеозид со свободным З'-гидроксилом называют З'-концом РНК. мРНК читается рибосомой в направлении от 5'-конца к З'-концу .
В природных мРНК 5'-концевой гидроксил всегда замещен. мРНК эукариотов в большинстве случаев несут на 5'-конце специальную группу – кэп (Рисунок 3). Кэп представляет собой остаток 7-метилгуанозина (Рисунок 4).

Рисунок 3. Строение 5'-конца кэпированной мРНК

Рисунок 4. Модель молекулы 7-метилгуанозина
Функциональные участки мРНК
Чаще всего началом (инициаторным кодоном) кодирующей части мРНК яв¬ляется AUG. Не любой триплет может стать инициаторным. Это определяется собственной структурой кодона и положением в структуре мРНК.
мРНК может содержать нуклеотидные последовательности для кодирования нескольких белков. Это характерно для прокариот. Такие мРНК называются полицистронными. У эукариот мРНК обычно кодируют одну полипептидную цепь (моноцистронные мРНК).
Пространственная структура

Рисунок 5. Вторичная структура РНК
Трехмерная структура мРНК еще не установлена. Измерения физических параметров мРНК свидетельствуют о том, что они являются сильно свернутыми структурами, с внутрицепными взаимодействиями между азотистыми основаниями. Вторичная структура мРНК образована благодаря комплементарному спариванию отдельных участков одной и той же цепи друг с другом, с образованием большого набора относительно коротких двуспиральных участков (Рисунок 5).
Вторичная и третичная структуры мРНК играют определенную роль в трансляции. Однако роль вторичной и третичной структуры мРНК в скорости считывания цепи не установлена.
Некодирующие последовательности мРНК участвуют в определении специальных пространственных структур, ответственных за регулирование инициации трансляции, элонгации и других процессов.
3. Генетический код
Так как существует только 4 нуклеотида в мРНК и 20 аминокислот в белке, то трансляция не может быть осуществляется на основе прямого соотношения между нуклеотидами РНК и аминокислотами в белке. Нуклеотидная последовательность гена через посредничество мРНК транслируется в аминокислотную последовательность по правилам, известным как генетический код.
Генетический код – способ сохранения наследственной информации в виде последовательности нуклеотидов в молекулах нуклеиновых кислот. Этот код был расшифрован в 1960-ых. Генетический код, основан на использовании алфавита, состоящего из четырех букв: А, Г, Ц и Т. Эти буквы соответствуют нуклеотидам, найденным в ДНК: аденин, гуанин, цитозин, тимин.
Последовательность нуклеотидов в молекуле мРНК читается непрерывными группами из трех нуклеотидов, называемых триплетами или кодонами. РНК представляет собой линейные полимер, состоящий из четырех разных нуклеотидов, поэтому возможны 4•4•4=64 комбинации трех нуклеотидов. Белки состоят из 20 аминокислот. Поэтому либо некоторые триплеты не используются, либо некоторые аминокислоты кодируются более, чем одним триплетом.
Различают два типа кодонов— смысловые, или значащие кодоны, и бессмысленные кодоны, или нонсенс-кодоны. Большинство (61) кодонов — значащие и только 3 (UAA, UAG, UGA) – нонсенс-кодоны. Смысловые кодоны соответствуют аминокислотам, а кодон AUG, помимо кодирования митионина, является инициирующим, или стартовым кодоном. Нонсенс-кодоны являются терминирующими кодонами, или стоп-кодонами.
Свойства генетического кода
Генетический код является неперекрываемым, непрерывным, специфичным, универсальным и вырожденным.
Неперекрываемость кода означает, что каждый нуклеотид входит только в один кодон, и поэтому изменения любого нуклеотида изменяют смысл только одного кодона.
Генетический код непрерывен. Он имеет линейный непрерывающийся порядок считывания. Кодоны транслируются всегда целиком. Расположение остатков аминокислот в синтезируемом полипептиде определяется антикодоном тРНК (триплет нуклеотидов, комплементарный одному из кодонов) .
Специфичность кода означает, что код является однозначным, поскольку каждый кодонный триплет кодирует только одну аминокислоту, и с одной мРНК можно синтезировать только одинаковые пептиды,
Генетический код универсален для всех живых существ – у всех живых организмов, включая вирусы и бактерии, одинаковые кодоны (триплеты нуклеотидов) кодируют одинаковые аминокислоты. Исключение составляют 4 кодона митохондрий грибов и животных, имеющих информационный смысл, отличный от универсального кода.
Вырожденность кода означает его избыточность, синонимичность, то есть одну аминокислоту может кодировать более одного триплета. Однако вырожденность не абсолютна. Например, метионину соответствует только один кодон.
До расшифровки генетического кода было невозможно понять механизм синтеза белка и объяснить происхождение мутаций. Открытие генетического кода позволило ответить на вопрос о том, как связаны между собой дефекты определенных белков человека и наследственные заболевания.
Генетический код
|
1-ая позиция (5’ конец) |
3-ая позиция (3’ конец) |
||||
| A C D E F G H I K L M N P A R S T V W Y |
Ala Cys Asp Glu Phe Gly His Ile Lys Leu Met Asn Pro Gln Arg Ser Thr Val Trp Tyr |
Alanine Cysteine Aspartic acid Glutamic acid Phenylalani Glycine Histidine Isoleucine Lysine Leucine Methionine Asparagine Proline Glutamine Arginine Serine Threonine Valine Tryptophan Tyrosine |
Аланин Цистеин Аспарагиновая кислота Глутаминовая кислота Фенилаланин Глицин Гистидин Изолейцин Лизин Лейцин Метионин Аспарагин Пролин Глутамин Аргинин Серин Треонин Валин Триптофан Тирозин |
GCA GCC GCG GCU |
4. Транспортные РНК и аминоацил-тРНК-синтетазы
Транспортные РНК (тРНК) небольшие по размеру молекулы (73- 97 нуклеотидных остатков в цепи). Все тРНК имеют одинаковый 3'-конец, построенный из двух остатков цитозина и одного аденозина (CCA-конец). В середине цепи тРНК находится антикодон. В молекулах тРНК присутствет множество разнообразных модифицированных нуклеозидов (минорные нуклеозиды), образующиеся путем ферментативной модификации обычных нуклеозидных остатков.
Вторичная структура

Рисунок 6. Вторичная структура тРНК
Вторичная структура тРНК складывается за счет взаимокомплементарности участков цепи. Они формируют структуру «клеверного листа», состоящую из четырех стеблей и трех петель. Стебель с петлей формируют ветвь. В дополнение к трем петлям клеверного листа в структуре тРНК выделяют также дополнительную, или вариабельную, петлю (V петлю). Двухцепочечные стебли с постоянным числом спаренных нуклеотидов представляют собой двойную спираль.
Пространственная структура

Рисунок 7. Третичная структура тРНК
Третичная структура формируется за счет взаимодействия элементов вторичной структуры. Пространственная структура тРНК называется L-формой (из-за сходства с латинской буквой L).
Третичные взаимодействия (стекинг оснований и другие) скрепляют разные участки L-структуры в непрерывные двойные спирали.
Молекулам тРНК присущи индивидуальные различия, проявляющиеся на уровне вторичной и третичной структур, например, разная величина угла между доменами L-структуры.
Функции тРНК
Две основные функции тРНК:
- Акцепторная функция – способность ковалентно связываться с аминоацильным остатком, превращаясь в аминоацил-тРНК;
- Адапторная функция – способность узнавать триплет генетического кода, соответствующий транспортируемой аминокислоте, и обеспечивать поступление аминокислоты на «законное» место в растущей цепи белка.
Аминоацилирование тРНК
Аминоацилирование тРНК – процесс активации аминокислот. Он происходит на первом этапе биосинтеза белка – двадцать различных аминокислот присоединяются эфирной связью к соответствующим тРНК под действием двадцати различных активирующих ферментов, называемыми аминоацил-тРНК-синтетазами. Каждый фермент специфичен по отношению к определенной аминокислоте и к соответствующей тРНК.

Рисунок 8. Обобщенная структура аминоацил-тРНК
Аминоацилирование состоит из двух стадий, проходящих в каталитическом центре фермента. На первой стадии в результате взаимодействия АТР и аминокислоты образуется промежуточное соединение – аминоациладенилат. На второй стадии аминоацильный остаток переносится с аминоациладенилата, связанного с ферментом, на соответствующую специфическую тРНК (Рисунок 8).
Аминоацилирование может быть выражено схемой:

АТФ – аденозинтрифосфат, АМФ – аденозинмонофосфат, PPi – пирофосфаты.
Исключительно низкая частота ошибок при аминоацилировании тРНК является непременным условием реализации генетического кода – если на предрибосомном этапе произошла ошибка и к тРНК присоединилась аминокислота, не соответствующая специфичности антикодона, то эта ошибка уже не может быть исправлена на последующих этапах белкового синтеза.
В ходе эволюции выработались специфические механизмы отбора «правильных» субстратов для аминоацил-тРНК-синтетаз, обеспечивающие безошибочное аминоацилирование тРНК.
Узнавание тРНК аминоацил-тРНК-синтетазами
Каждая тРНК, сохраняя универсальную L-образную форму, имеет отличительные признаки, безошибочно распознаваемые «своим» ферментом как «притягательные», а остальными 19 ферментами – как «отталкивающие».
Это следующие участки тРНК (Рисунок 9):
- Антикодон
- Нуклеотид, предшествующий CCA-концу.
- Первые три пары нуклеотидов акцепторного стебля

Рисунок 9. Участки, по которым происходит узнавание тРНК аминоацил-тРНК-синтетазами
5. Рибосомы

Рисунок 10. Комплекс 80S рибосома-мРНК-тРНК клетки дрожжей
Синтез белка происходит в рибосоме. Рибосома – сложный макромолекулярный аппарат, состоящий из более 50 белков, называемых рибосомными белками, и нескольких молекул РНК, называемых рибосомными РНК. Число рибосом в клетке различно. Оно зависит от интенсивности белкового синтеза в данном типе клеток. Обычная эукариотческая клетка содержит миллионы рибосом. Эукариотические и прокариотические рибосомы схожи в строении и функциях и различаются лишь числом и размером рРНК и рибосомных протеинов.
Строение рибосомы приведено на рисунке 10 на примере рибосомы дрожжей (Рисунок 10).
Рибосомы имеют размер 25-30 нм. Они состоят из двух неравных субъединиц. Субъединицы эукариотических рибосом формируются в ядре из рРНК, ассоциированных с рибосомными белками, которые транспортируются в ядро после синтеза в цитоплазме. Две субъединицы рибосомы затем выходят в цитоплазму, где соединяются воедино для участия в синтезе белка.
Рибосомные рибонуклеиновые кислоты (рРНК) – основные компоненты рибосом, составляют большую часть их массы. Молекулы рРНК определяют структуру, физические и химические свойства, функции рибосом, а также расположение рибосомных белков в субчастицах рибосом.
Малые субчастицы рибосом содержат одну молекулу рРНК, большие – две.
Молекулы рРНК являются совокупностью коротких одноцепочечных и двухспиральных участков, образующихся за счет комплементарного спаривания участков одной и той же полинуклеотидной цепи.
В субъединицах рибосом рРНК компактно упакованы благодаря ионам двухвалентных металлов и рибосомным белкам. Основная часть рРНК располагается внутри рибосомных субчастиц. Отдельные участки рРНК находятся на поверхности субчастиц. Они выполняют важную биололическую роль, формируя функциональные центры рибосом (центры связывания матричных и транспортных РНК и белковых факторов трансляции).
Рибосомная РНК концентрируется в основном ближе к центру частиц, тогда как масса рибосомных белков занимает в среднем более периферическое положение. Можно сделать вывод, что свернутая молекула высокополимерной рибосомной РНК – это структурное ядро рибосомной субчастицы, определяющее и ее компактность, и ее форму, и организацию на ней рибосомных белков. То есть рибосома есть прежде всего ее РНК (Рисунок 11).

Рисунок 11. Рибосомные белки и рибосомная РНК
Многочисленные рибосомные белки могут участвовать в функциях связывания субстратов и каталитических функциях рибосомы, локализуясь в соответствующих функциональных центрах и обеспечивая их своими активными группами; рибосомные белки могут служить стабилизаторами или модификаторами определенных локальных структур рибосомной РНК и таким образом поддерживать их в функционально активном состоянии или способствовать их переключениям из одного состояния в другое.
Когда рибосома не участвует в синтезе белков, две субъединицы разделены. Они соединяются с мРНК (обычно возле 5'-конца) для инициации синтеза белков. Затем мРНК продвигается через рибосому, и по мере вхождения кодонов в ядро рибосомы, нуклеотидная последовательность мРНК транслируется в аминокислотную поледовательность с помощью тРНК в качестве адаптора, чтобы приоединять каждую аминокислоту в правильном порядке к концу растущего белка. Когда считывается терминаторный кодон, из рибосомы выходит синтезированный белок, и две субъединицы снова разделяются. Эти субъединицы могут снова быть использованы для синтеза другого белка по другой молекуле мРНК.
Обычно одна молекула мРНК читается сразу несколькими рибосомами, двигающимися вдоль мРНК друг за другом и, таким образом, независимо синтезирующими идентичные молекулы белка, но с соответствующим отставанием. Такой динамический комплекс одной мРНК с несколькими рибосомами называется полирибосомой.

Рисунок 12. Функциональные участки рибосомы
Рибосомы работают чрезвычайно продуктивно: в секунду одна рибосома эукариотической клетки присоединяет 2 аминокислоты к полипептидной цепи, рибосомы бактериальных клеток функционируют еще быстрее — около 20 аминокислот в секунду. Такая продуктивность объясняется наличием четырех функциональных участков (сайтов) для РНК молекул (Рисунок 12) – один для мРНК и три для тРНК:
- А-сайт (aminoacyl-tRNA — аминоацил-тРНК)
- Р-сайт (peptidyl-tRNA — пептидил-тРНК)
- Е-сайт (exit — выход)
- мРНК-связывающий участок
Молекула тРНК крепится к А- и Р-сайтам только если её антикодон образует пары оснований с комплементарным кодоном молекулы мРНК. А- и Р-сайты расположены близко друг к другу чтобы две их тРНК молекулы формировали пары нуклеотидов с примыкающим кодоном молекулы мРНК. Эта особенность рибосомы обеспечивает правильное считывание мРНК.
Рибосомы разных клеток различаются по размерам, которые определяются по скорости осаждения при центрифугировании. Скорость осаждения измеряется в единицах Сведберга (S). Сведберг – это отношение скорости седиментации к центробежному ускорению, 1S = 10-13 секунд. Коэффициенты седиментации разных рибосом варьируют от 5S до 80S. У прокариот рибосомы имеют коэффициент 70S, а рибосомы цитоплазмы эукариот — 80S.
Диссоциация рибосом в случае прокариот и эукариот соответственно:
70S→50S + 30S
80S→60S + 40S
6. Трансляция
Трансляция – непосредственный процесс синтеза белка рибосомой. Трансляция проходит в три стадии: инициация, элонгация, терминация.
Стадия инициации
Трансляция у бактерий и в эукариотических клетках в общем схожи, но различаются механизмом инициации. Для инициация белкового синтеза в бактериях необходимы 30S и 50S рибосомные единицы, мРНК, молекула тРНК, аминоацилированная N-формилметионином – fMet-tRNAfMet, три белка, называемые факторами инициации, гуанозинтрифосфат (ГТФ), Mg2+. В процессе работы рибосома потребляет энергию гидролиза гуанозинтрифосфата (Рисунок 13).

Рисунок 13. Структура гуанозинтрифосфата
Комплекс 30S субъединицы с факторами инициации распознает участки связывания рибосомы (сайты), которые содержат инициаторный кодон AUG, и специальную последовательность Шайна- Дальгарно, служащую для отличия AUG от внутренних кодонов, кодирующих метионин. В результате инициации образуется 70S рибосома – инициирующий комплекс, содержащий мРНК и fMet-tRNAfMet, связанную с P-участком рибосомы. Комплекс готов к элонгации.
В эукариотических клетках имеется как минимум девять факторов инициации. Инициирующий кодон AUG распознается не последовательностью Шайна-Дальгарно, а сканированием мРНК с 5'-конца до первого AUG и соответствующим расположением рамки считывания.
Стадия элонгации
Стадия элонгации требует комплекс инициации, аминоацил-тРНК, факторы элонгации (растворимые цитозольные белки) и гуанозинтрифосфат (ГТФ).
Синтез происходит на рибосоме путем последовательного добавления одного аминокислотного остатка за другим к строящейся полипептидной цепи; таким путем осуществляется элонгация (удлинение) пептида. Каждый новый аминокислотный остаток добавляется к карбоксильному концу (С-концу) пептида, т. е. С-конец пептида является растущим. Добавление одного аминокислотного остатка соответствует прочтению одного нуклеотидного триплета.
Элонгация проходит в три этапа, которые повторяются пока есть остатки аминокислот для присоединения.
На первом шаге аминоацил-тРНК молекула, нагруженная аминокислотой крепится к А-сайту рибосомы, а "отработавшая" тРНК высвобождается с Е-сайта (от exit — выход).
На втором шаге формируется новая пептидная связь под действием фермента пептидилтрансферазы.
На третьем шаге происходит транслокация: большая субъединица занимает позицию относительно малой субъединицы, оставляя две тРНК в гибридных сайтах: в Р-сайте на большой субъединице и А-сайте на малой для одной тРНК и в E-сайте на большой субъединице и Р-сайте на малой для другой. Затем малая субъединица перемещается вместе с мРНК на три нуклеотида, освобождая А-сайт для следующей тРНК и цикл повторяется снова. Молекула мРНК транслируется с 5'-конца к 3'-третьему, а синтез протеина начинается с N-конца. С началом каждого цикла аминокислота крепится к C-концу полипептидной цепи.
Стадия терминации
Элонгация продолжается до тех пор пока рибосома не присоединит последнюю аминокислоту. Терминация начинается при присутствии одного из трех терминаторных кодонов в мРНК (UAA, UAG, UGA), которые следуют сразу за последней аминокислотой. Когда рибосома достигнет терминирующего кодона мРНК, синтез полипептида прекращается. В бактериях, если терминаторный кодон имеет место быть в А-сайте рибосомы, в дело вступают три фактора терминации, которые участвуют в гидролизе пептидил-тРНК связи; освобождении полипептида и последней, уже ненагруженной тРНК из Р-сайта; диссоциации 70S рибосомы на 30S и 50S субъединицы, готовых начать новый цикл синтеза белка.
Таким образом, каждая рибосома проходит полный цикл трансляции, включающий инициацию, элонгацию и терминацию; в результате такого эпицикла прочитывается вся кодирующая последовательность мРНК и синтезируется законченная полипептидная цепь белка. После этого рибосома может повторить цикл с другой цепью мРНК или другой кодирующей последовательностью той же цепи.
7. Сворачивание и транспорт белков
Процесс экспрессии генов не заканчивается на построении аминокислотной последовательности, составляющей протеин, с помощью генетического кода. Чтобы быть полезным клетке, новый пептид должен подвергнутся процессингу: свернутся в трехмерную нативную конформацию, присоединить какие-либо молекулы, необходимые для его активности, модифицироваться под действием протеинкиназ и других энзимов и правильно соединиться с другими частями белка, с которыми он функционирует.
Информация, нужная для всех этих процессов содержится в последовательности связанных аминокислот, которые производит рибосома, когда транслирует мРНК в полипептидную цепь. Когда протеин сворачивается в компактную структуру, гидрофобные звенья обращаются внутрь глобулы. Формируется большая часть нековалентных взаимодействий между различными участками молекул. Итогом всех этих энергетически выгодных взаимодействий, определяющих свернутую структуру полипептидной цепи является конформация с самой низкой энергией.
За миллионы лет эволюции аминокислотная последовательность каждого протеина была выбрана определенным образом не только для конформации, которую он принимает, но также для быстрого сворачивания. Для некоторых белков сворачивание начинается с N-конца сразу после выхода полипептида из рибосомы. В этом случае, как только протеин покидает рибосому, через несколько секунд он формирует компактное строение, содержащее окончательную вторичную структуру (спирали и β-листы).
Большинство белков не сворачиваются во время синтеза. Вместо этого они "встречаются" у рибосомы с отдельным классом белков, называемых шаперонами. Связывание с шаперонами обеспечивает правильное сворачивание белка в нативную конформацию.
Основные этапы процессинга:
- Модификация N-конца и С-конца
- Удаление сигнальных последовательностей
- Фосфорилирование гидраксиаминокислот
- Реакции карбоксилирования
- Метилирование групп
- Присоединение боковых углеводных цепей
- Добавление простетических групп
- Образование дисульфидных мостиков
Внутриклеточная сортировка белков
Эукариотические клетки состоят из множества структур, органелл и отсеков со специфичными функциями, которые требуют определенный набор белков. Эти белки (за исключением тех, которые синтезируются в митохондрих и пластидах) производятся рибосомами в цитозоле.
Белки предназначенные для секреции, интеграции в плазматическую мембрану, включения в лизосомы, обычно проходят первые несколько стадий внутриклеточной сортировки. Белки для митохондрий, пластид и ядра используют при отдельных механизм. Белки, предназначенные для цитозоля, остаются там, где были синтезированы.
Важнейшим элементом в процессе сортировки белков является короткая последовательность аминокислот – сигнальная последовательность белка (лидер). Она направляет белок на предназначенное ему место и удаляется во время транспорта или по прибытию белка в конечный пункт.
В процессе синтеза любого белка, в том числе предназначенного на «экспорт», сигнальные лидеры, будучи расположены на N-конце, образуются первыми. Такие лидеры узнаются особыми рецепторными участками на внешней поверхности эндоплазматического ретикулума, причем это происходит даже раньше, чем рибосома полностью завершит синтез белка. Гидрофобная жирорастворимая часть лидирующей последовательности проникает сквозь мембрану внутрь цистерн эндоплазматического ретикулума, протаскивая за собой растущую полипептидную цепь. Внутри цистерн под действием особой пептидазы сигнальный лидер отщепляется. После этого зрелый белок направляется в аппарат Гольджи, инкапсулируется и в виде секреторного пузырька покидает наконец клетку.
8. Заключение
Белки являются структурными блоками клетки, а также осуществляют большую часть её функций. Биосинтез белка является одним из основополагающих процессов клетки.
Расшифровка генетического кода, правил, по которым нуклеотидная последовательность РНК переводится в аминокислотную последовательность полипептида, позволила понять принцип биосинтеза белка и связанные с этих явления.
Синтез протеина начинается с построения цепи матричной РНК из ДНК по принципу комплементарности.
После определенных преобразований молекула матричной РНК становится матрицей для построения по ней белка.
Биосинтез белка происходит в рибосомах, которые состоят из белков и рРНК. Рибосомы диссоциируют на две неравные субъединицы.
- Прокароты: 70S→50S + 30S
- Эукариоты: 80S→60S + 40S
Транспортная РНК состоит из небольшого числа нуклеотидов (73-97), некоторые из которых могут быть модифицированы. тРНК имеют общее строение:
- универсальная CCA последовательность
- акцепторный стебель
- D шпилька
- T шпилька
- Антикодоновая шпилька
Транспортные РНК выполняют акцепторную и адапторную функции.
Рост полипептида в рибосоме начинается с N-конца добавлением новых аминокислотных остатков и завершается на C-конце.
Для синтез белка необходима активация аминокислот. Аминокислоты активируются в цитозоле аминоацил-тРНК синтетазой. Эти ферменты катализируют образование аминоацил-тРНК и расщепление АТФ на АМФ и пирофосфаты (PPi). Точность белкового синтеза зависит от правильного протекания этой реакции.
Непосредственный синтез белка (трансляция) проходит в три стадии.
- Инициация белкового синтеза включает в себя образование комплекса из малой рибосомной субъединицы, мРНК, ГТФ, fMet-tRNAfMet, факторов инициации и большой рибосомной субъединицы. ГТФ гидролизуется с образованием ГМФ и фосфата.
- На стадии элонгации ГТФ и факторы элонгации учавствуют в процессе связывания аминоацил-тРНК, нагруженной аминокислотой, с А-участком рибосомы. Под действием фермента пептидилтрансферазы образуется пептидная связь. Движение рибосомы вдоль мРНК транслоцирует тРНК из А-сайта в Р-сайт за счет энергии гидролиза ГТФ. "Отработавшая" тРНК высвобождается из Е-участка.
- После повторения нескольких циклов элонгации, на стадии терминации, синтез полипептида останавливается факторами терминации.
Полипептид сворачивается в биологически активную конформацию и транспортируется к "рабочему месту".
Несмотря на множество открытий в биохимии и значимую работу, проделанную разными учеными в области этой науки, некоторые аспекты синтеза белков еще не установлены. Например, зачем нужны молекулы рРНК и как случилось, что они приобрели главенствующую роль в структуре и функции рибосом? На этот и другие вопросы науке предстоит ответить.
Источник: studentoriy.ru