Некоторые виды молекул образуют рибосомы
Рибосо́ма — важнейший немембранный органоид живой клетки, служащий для биосинтеза белка из аминокислот по заданной матрице на основе генетической информации, предоставляемой матричной РНК (мРНК). Этот процесс называется трансляцией. Рибосомы имеют сферическую или слегка эллипсоидную форму, диаметром от 15—20 нанометров (прокариоты) до 25—30 нанометров (эукариоты), состоят из большой и малой субъединиц.
В эукариотических клетках рибосомы располагаются на мембранах эндоплазматической сети, хотя могут быть локализованы и в неприкреплённой форме в цитоплазме. Нередко с одной молекулой мРНК ассоциировано несколько рибосом, такая структура называется полирибосомой (полисомой). Синтез рибосом у эукариот происходит в специальной внутриядерной структуре — ядрышке.
Рибосомы представляют собой нуклеопротеид, в составе которого соотношение РНК/белок составляет 1:1 у высших животных и 60-65:35-40 у бактерий. Рибосомная РНК составляет около 70 % всей РНК клетки.
босомы эукариот включают четыре молекулы рРНК, из них 16S, 5,8S и 28S рРНК синтезируются в ядрышке РНК-полимеразой I в виде единого предшественника (45S), который затем подвергается модификациям и нарезанию. 5S рРНК синтезируются РНК-полимеразой III в другой части генома и не нуждаются в дополнительных модификациях. Почти вся рРНК находится в виде магниевой соли, что необходимо для поддержания структуры; при удалении ионов магния рибосома подвергается диссоциации на субъединицы.
Константа седиментации (скорость оседания в ультрацентрифуге) у цитоплазматических рибосом эукариотических клеток равняется 80S (большая и малая субъединицы 60S и 40S, соответственно), у рибосом бактериальных клеток (а также у рибосом митохондрий и пластид) — 70S (большая и малая субъединицы 50S и 30S, соответственно).
Состав рибосомы[править | править код]
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК[править | править код]
Структурно и функционально рибосома — это, прежде всего, её РНК.[1] Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют.[2] Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК.
етичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.[1]
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы[править | править код]
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).[3]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.[3]
РНК большой субъединицы[править | править код]
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.[4]
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК.
отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).[4]
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.[4]
Рибосомные белки[править | править код]
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки.[5] Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков.[6] Рибосома на 30—50 % состоит из белка.[7]
Низкомолекулярные компоненты[править | править код]
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы),[8] ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).[8]
Механизм трансляции[править | править код]
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК).
прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)[9]
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза[10]
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[11][12]
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона[13]
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
История исследований рибосомы[править | править код]
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов[14]. В 1974 г. Джордж Паладе и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка[15]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками.
о крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы[16].
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, высказали обоснованное предположение, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы[17].
Литература[править | править код]
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Источник: ru.wikipedia.org
Эндоплазматическая сеть
Эндоплазматическая сеть (син. эндоплазматический ретикулум) – органоид эукариотической клетки. В клетках разного типа и при различных функциональных состояниях этот компонент клетки может выглядеть по-разному, но во всех случаях – это лабиринтная протяженная замкнутая мембранная структура, построенная из сообщающихся трубкообразных полостей и мешочков, называемых цистернами. Снаружи от мембран эндоплазматической сети находится цитозоль (гиалоплазма, основное вещество цитоплазмы), а просвет эндоплазматической сети представляет собой замкнутое пространство (компартмент), сообщающееся посредством везикул (транспортных пузырьков) с комплексом Гольджи и внешней для клетки средой. Эндоплазматическая сеть делится на две функционально различные структуры: гранулярную (шероховатую) эндоплазматическую сеть и гладкую (агранулярную) эндоплазматическую сеть.
Гранулярная эндоплазматическая сеть, в клетках секретирующих белок, представлена системой многочисленных плоских мембранных цистерн с рибосомами на наружной поверхности. Комплекс мембран гранулярной эндоплазматической сети связан с наружной мембраной оболочки ядра и перинуклеарной (околоядерной) цистерной.
В гранулярной эндоплазматической сети происходит синтез белков и липидов для всех мембран клетки, синтезируются ферменты лизосом, а также осуществляется синтез секретируемых белков, т.е. предназначенных для экзоцитоза. (Остальные белки синтезируются в цитоплазме на рибосомах, не связанных с мембранами ЭС.) В просвете гранулярной ЭС белок окружается мембраной, и образующиеся пузырьки отделяются (отпочковываются) от несодержащих рибосомы областей ЭС, которые и доставляют содержимое в другую органеллу – комплекс Гольджи – путем слияния с ее мембраной.
Та часть ЭС, на мембранах которой рибосомы отсутствуют, называется гладким эндоплазматическим ретикулумом. Гладкая эндоплазматическая сеть не содержит уплощенных цистерн, а представляет собой систему анастомозирующих мембранных канал
ов, пузырьков и трубочек. Гладкая сеть является продолжением гранулярной, однако не содержит рибофоринов – гликопротеиновых рецепторов, с которыми соединяется большая субъединица рибосом и поэтому не связана с рибосомами.
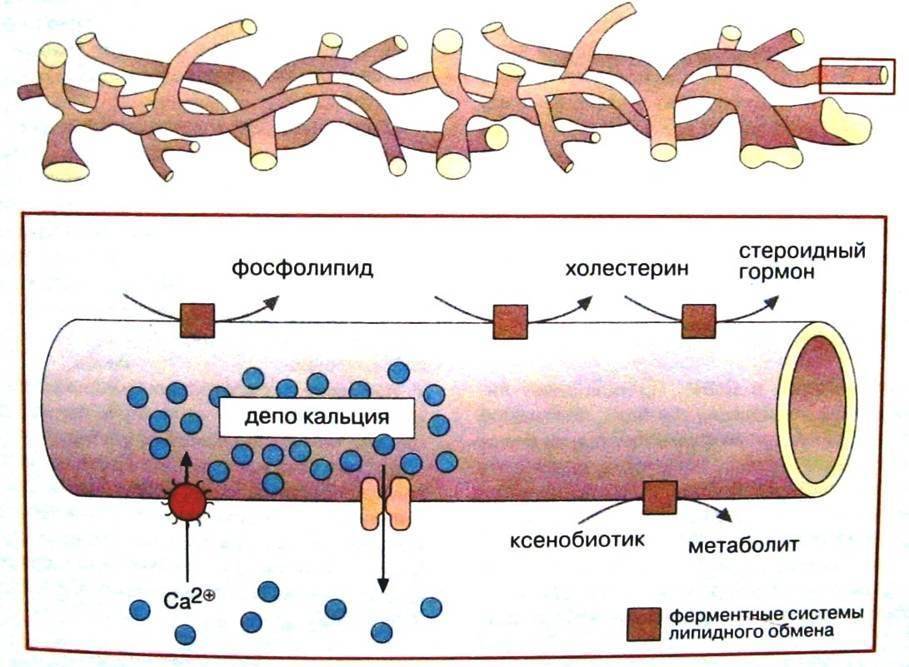
Функции гладкой эндоплазматической сети многообразны и зависят от типа клеток. Гладкая эндоплазматическая сеть участвует в метаболизме стероидных, например, половых гормонов. В ее мембранах локализованы управляемые кальциевые каналы и энергозависимые кальциевые насосы. Цистерны гладкой эндоплазматической сети специализированы для накопления в них Са2+ путем постоянного откачивания Са2+ из цитозоля. Подобные депо Са2+ существуют в скелетной и сердечной мышцах, нейронах, яйцеклетке, эндокринных клетках и др. Различные сигналы (например, гормоны, нейромедиаторы, факторы роста) влияют на активность клеток путем изменения концентрации внутриклеточного посредника – Са2+. В гладкой эндоплазматической сети клеток печени происходит обезвреживание вредных веществ, (например ацетальдегида, образующегося из алкоголя), метаболическая трансформация лекарств, образование большей части липидов клетки и их накопление, например при жировой дистрофии. В полости ЭС содержится много различных молекул-компонентов. Среди них имеют большое значение белки шапероны.

Шапероны (англ. букв. – пожилая дама, сопровождающая молодую девушку на балах) – семейство специализированных внутриклеточных белков, обеспечивающих быстрое и правильное сворачивание (фолдинг) вновь синтезированных молекул белка. Связывание с шаперонами препятствует агрегации с другими белками и тем самым создает условия для формирования вторичной и третичной структуры растущего пептида. Шапероны принадлежат к трем белковым семействам, так называемым белкам теплового шока (hsp 60, hsp 70, hsp 90). Синтез этих белков активируется при многих стрессах, в частности, при тепловом шоке (отсюда и название heart shook protein – белок теплового шока, а цифра обозначает его молекулярную массу в килодальтонах). Эти шапероны предотвращают денатурацию белков при высокой температуре и др. экстремальных факторах. Связываясь с аномальными белками, восстанавливают их нормальную конформацию и тем самым повышают выживаемость организма при резком ухудшении физико-химических параметров среды.
Источник: StudFiles.net
Источник: chem21.info
История исследований рибосомы
Рибосомы впервые были описаны как уплотненные частицы, или гранулы, клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов [1]. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки». Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеобелковая частица микросомальной фракции» [2]. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х появились атомные структуры отдельных субъединиц, а также полной рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, антибиотиками, тРНК и мРНК.
Нобелевская премия по химии 2009 года получена за определение структуры прокариотической рибосомы учёным из Великобритании Венкатраманом Рамакришнаном, американцем Томасом Стейцем и израильтянкой Адой Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы. [3]
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав трёхмерную структуру рибосомной РНК современных бактерий E.coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.[4]
Механизм трансляции
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). мРНК связывается с малой субъединицей рибосомы, когда происходит узнавание 3′-концом 16S рибосомной РНК комплементарной последовательности Шайн-Далгарно, расположенной на 5′-конце мРНК (у прокариот), а также позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. У эукариот малая субчастица рибосомы связывается также с помощью кэпа, на конце мРНК. Ассоциация малой и большой субъединиц происходит при связывании формилметионил-тРНК (fMET-тРНК) и участии факторов инициации (IF1, IF2 и IF3 у прокариот; их аналоги и дополнительные факторы участвуют в инициации трансляции у эукариотических рибосом). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMET-тРНК находится в P- (peptidyl-) сайте каталитического(пептидил-трансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, помещается с помощью фактора EF-Tu в А- (aminoacyl-) сайт каталитического центра рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНК, находящейся в Р-сайте) и аминокислотой, принесенной тРНК, находящейся в А-сайте. Механизм катализа образования пептидной связи в пептидил-трансферазном центре до сих пор полностью не ясен. На данный момент существует несколько гипотез, объясняющих детали этого процесса: 1. Оптимальное позиционирование субстратов (induced fit)[5], 2. Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза [6], 3. Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона[7][8], 4. Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона [9];. Высокая эффективность катализа достигается взаимодействием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНК двигается из Р-сайта в Е-сайт (exit-), а пептидил-тРНК из А- в Р-сайт. Этот процесс называется транслокацией и происходит при участии фактора EF-G. тРНК, комплементарная следующему кодону мРНК, связывается с А-центром рибосомы, что ведет к повторению описанных шагов. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК, называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
Источник: dic.academic.ru