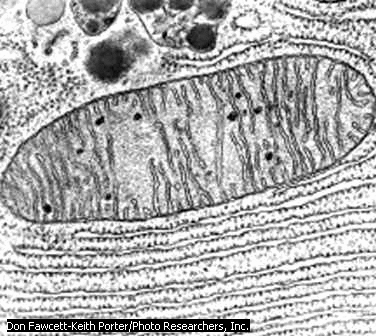
Есть ли митохондрии в растительной клетке
Митохондрии (от греч. mitos– нить, chondrion- зернышко) — органеллы эукариотических клеток, обладающие собственной ДНК и выполняющие функцию синтеза АTP.
Размеры и форма митохондрий сильно варьирует у разных видов. Обычно ширина ~0,5 мкм, длина 7-60 мкм.
Митохондрии подвижные, пластичные, постоянно изменяют форму, могут ветвиться, сливаться друг с другом, и расходится. Перемещение митохондрий связано с микротрубочками.
В культуре клеток эндотелия сердца головастика ксенопуса наблюдали до 40 случаев слияния и деления митохондрий за 1 час.
Митохондрии расположены около мест высокого потребления АТФ (между миофибриллами в сердечной мышце, вокруг жгутика сперматозоида).
Число митохондрий зависит от потребности клетки в энергии, чем больше потребность, тем больше митохондрий в клетке и тем более они развиты.
Сложная форма митохондрий затрудняет их микроскопическое исследование. На срезе одна извитая митохондрия может быть представлена
несколькими сечениями (3-5), и только пространственная трехмерная реконструкция, построенная на изучении серийных срезов, может решить вопрос, имеем ли мы дело с 3-6 отдельными митохондриями или же с одной изогнутой или разветвленной.
В некоторых клетках имеется одна сильно разветвленная митохондрия (одноклеточные зеленые водоросли Polytomella, Engiena, Chlorella).
инные ветвящиеся митохондрии были описаны в клетках культуры ткани млекопитающих, в клетках многих растений как в нормальных, так и в анаэробных условиях.
В последнее время стал широко применяться для изучения свойств митохондрий флуорохром родамин. Этот краситель обладает способностью люминисцировать в фиолетовом свете, если он связывается с мембранами активных митохондрий. При этом в люминисцентном микроскопе видна единая митохондриальнвя система – митохондриальный ретикулум.
Печеночную клетку приходится около 200 митохондрий. Это составляет более 20% от общего объема цитоплазмы и около 30-35% от общего
количества белка в клетке. Площадь поверхности всех митохондрий печеночной клетки в 4-5 раз больше поверхности ее плазматической мембраны. Больше всего митохондрий в ооцитах (около 300000) и у гигантской амебы Chaos chaos (до 500000).
В клетках зеленых растений число митохондрий меньше, чем в клетках животных, так как часть их функций могут выполнять хлоропласты. В спермиях часто присутствуют гигантские митохондрии, спирально закрученные вокруг осевой части жгутика.
Отсутствуют митохондрии у кишечных энтамеб, живущих в условиях анаэробиоза, и у некоторых других паразитических простейших.
Обычно митохондрии скапливаются вблизи тех участков цитоплазмы, где возникает потребность в АТФ, образующейся в митохондриях.
к, в скелетных мышцах митохондрии находятся вблизи миофибрилл. В сперматозоидах митохондрии образуют спиральный футляр вокруг оси жгутика; вероятно, это связано с необходимостью использования АТФ для движения хвоста сперматозоида. Аналогичным образом
у простейших и в других клетках, снабженных ресничками, митохондрии локализуются непосредственно под клеточной мембраной у основания ресничек, для работы которых необходим АТФ. В аксонах нервных клеток митохондрии располагаются около синапсов, где происходит процесс передачи нервного импульса.
Строение митохондрий.
Внешняя мембрана
Внутренняя мембрана
Матрикс м-на, матрикс, кристы. она имеет ровные контуры, не образует впячиваний или складок. На нее приходится около 7% от площади всех клеточных мембран. Ее толщина около 7 нм, она не бывает связана ни с какими другими мембранами цитоплазмы и замкнута сама на себя, так что представляет собой мембранный мешок. Наружнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм. Внутренняя мембрана (толщиной около 7 нм) ограничивает собственно внутреннее содержимое митохондрии,
ее матрикс или митоплазму.
рактерной чертой внутренней мембраны митохондрий является их способность образовывать многочисленные впячивания внутрь митохондрий. Такие впячивания чаще всего имеют вид плоских гребней, или крист. Расстояние между мембранами в кристе составляет около 10-20 нм. Часто кристы могут ветвиться или образовывать пальцевидные отростки, изгибаться и не иметь выраженной ориентации. У простейших, одноклеточных водорослей, в некоторых клетках высших растений и животных выросты внутренней мембраны имеют вид трубок (трубчатые кристы).
Матрикс митохондрий имеет тонкозернистое гомогенное строение, в нем иногда выявляются тонкие собранные в клубок нити (около 2-3 нм) и гранулы около 15-20нм. Теперь стало известно, что нити матрикса митохондрий представляют собой молекулы ДНК в составе митохондриального нуклеоида, а мелкие гранулы – митохондриальные рибосомы.
Функции митохондрий
1. В митохондриях происходит синтез ATP (см. Окислительное фосфорилирование)
pH межмембранного пространства ~4, pH матрикса ~8 | содержание белков в м: 67% — матрикс, 21% -наруж м-на, 6% — внутр м-на и 6% — в межм-ном пр-ве
Хандриома – единая система митохондрий
наружная м-на: порины-поры позволяют проходить до 5 kD | внутренняя м-на: кардиолипин-делает непроницаемой м-ну для ионов |
межм-ное пр-во: группы ферментов фосфорилируют нуклеотиды и сахара нуклеотидов
внутренняя м-на:
матрикс: метаболические ферменты – окисление липидов, окисление углеводов, цикла трикарбоновых к-т, цикла Кребса
Происхождение от бактерий: амеба Pelomyxa palustris единств из эукариот не содержит м., живет в симбиозе с аэробными бактериями | собственная ДНК | схожие с бактериями оx процессы
Митохондриальная ДНК
Деление миохондрий
реплицируется
в интерфазе | репликация не связана с S-фазой | во время кл цикла митох один раз делятся надвое, образуя перетяжку, перетяжка сначала на внутр м-не | ~16,5 kb | кольцевая, кодирует 2 рРНК 22 тРНК и 13 белков |
транспорт белков: сигнальный пептид | амфифильный завиток | митохондриальный распознающий рецептор |
Окислительное фосфорилирование
Цепь переноса электронов
АТР-синтаза
в кл печени, м живут ~20 дней деление митохондрий путем образования перетяжки
16569пн=13белков,22тРНК,2pРНК | гладкая внешняя м-на (порины – проницаемость белков до 10 кДа) складчатая внутренняя (кристы) м-на (75% -белков: транспортные белки-переносчики, ф-ты, компаненты дыхат. цепи и АТФ-синтаза, кардиолипин) матрикс (обогащен ф-тами цитратного цикла) межм-ное пр-во


Источник: www.cellbiol.ru
Лекция № 6.
Количество часов: 2
МИТОХОНДРИИ И ПЛАСТИДЫ
1. Митохондрии, строение, функциональное значение
2. Пластиды, строение, разновидности, функции
3. Проблема происхождения митохондрий и пластид. Относительная автономия
Митохондрии и пластиды – двухмембранные органоиды эукариотических клеток. Митохондрии встречаются во всех клетках животных и растений. Пластиды характерны для клеток растений, осуществляющих фотосинтетические процессы. Эти органоиды имеют сходный план строения и некоторые общие свойства. Однако по основным метаболическим процессам они существенно отличаются друг от друга.
1. Митохондрии, строение, функциональное значение
Общая характеристика митохондрий. Митохондрии (греч.
итос” — нить, “хондрион” — зерно, гранула) – округлые, овальные или палочковидные двухмембранные органоиды диаметром около 0,2-1 мкм и длиной до 7-10 мкм. Эти органоиды можно обнаружить с помощью световой микроскопии, поскольку они обладают достаточной величиной и высокой плотностью. Особенности внутреннего строения их можно изучить только с помощью электронного микроскопа. Митохондрии были открыты в 1894 г. Р. Альтманом, который дал им название «биобласты». Термин "митохондрия" был введен К. Бенда в 1897 г. Митохондрии имеются практически во всех эукариотических клетках. У анаэробных организмов (кишечные амебы и др.) митохондрии отсутствуют. Число митохондрий в клетке колеблется от 1 до 100 тыс. и зависит от типа, функциональной активности и возраста клетки. Так в растительных клетках митохондрий меньше, чем в животных; а в молодых клетках больше, чем в старых. Жизненный цикл митохондрий составляет несколько дней. В клетке митохондрии обычно скапливаются вблизи участков цитоплазмы, где возникает потребность в АТФ. Например, в сердечной мышце митохондрии находятся вблизи миофибрилл, а в спермиях образуют спиральный футляр вокруг оси жгутика.
Ультрамикроскопическое строение митохондрий. Митохондрии ограничены двумя мембранами, каждая из которых имеет толщину около 7 нм. Внешнюю мембрану от внутренней отделяет межмембранное пространство шириной около 10-20 нм.
ешняя мембрана гладкая, а внутренняя образует складки – кристы (лат. “криста” – гребень, вырост), увеличивающие ее поверхность. Число крист неодинаково в митохондриях разных клеток. Их может быть от нескольких десятков до нескольких сотен. Особенно много крист в митохондриях активно функционирующих клеток, например мышечных. В кристах располагаются цепи переноса электронов и сопряженного с ним фосфорилирования АДФ (окислительное фосфорилирование). Внутреннее пространство митохондрий заполнено гомогенным веществом, называемым матриксом. Митохондриальные кристы обычно полностью не перегораживают полость митохондрии. Поэтому матрикс на всем протяжении является непрерывным. В матриксе содержатся кольцевые молекулы ДНК, митохондриальные рибосомы, встречаются отложения солей кальция и магния. На митохондриальной ДНК происходит синтез молекул РНК различных типов, рибосомы участвуют в синтезе ряда митохондриальных белков. Малые размеры ДНК митохондрий не позволяют кодировать синтез всех митохондриальных белков. Поэтому синтез большинства белков митохондрий находится под ядерным контролем и осуществляется в цитоплазме клетки. Без этих белков рост и функционирование митохондрий невозможно. Митохондриальная ДНК кодирует структурные белки, ответственные за правильную интеграцию в митохондриальных мембранах отдельных функциональных компонентов.
Размножение митохондрий. Митохондрии размножаются путем деления перетяжкой или фрагментацией крупных митохондрий на более мелкие. Образовавшиеся таким путем митохондрии могут расти и снова делиться.
Функции митохондрий. Основная функция митохондрий заключается в синтезе АТФ. Этот процесс происходит в результате окисления органических субстратов и фосфорилирования АДФ. Первый этап этого процесса происходит в цитоплазме в анаэробных условиях. Поскольку основным субстратом является глюкоза, то процесс носит название гликолиза. На данном этапе субстрат подвергается ферментативному расщеплению до пировиноградной кислоты с одновременным синтезом небольшого количества АТФ. Второй этап происходит в митохондриях и требует присутствия кислорода. На этом этапе происходит дальнейшее окисление пировиноградной кислоты с выделением СО2 и переносом электронов на акцепторы. Эти реакции осуществляются с помощью ряда ферментов цикла трикарбоновых кислот, которые локализованы в матриксе митохондрии. Освободившиеся в процессе окисления в цикле Кребса электроны переносятся в дыхательную цепь (цепь переноса электронов). В дыхательной цепи они соединяются с молекулярным кислородом, образуя молекулы воды. В результате этого небольшими порциями выделяется энергия, которая запасается в виде АТФ. Полное окисление одной молекулы глюкозы с образованием диоксида углерода и воды обеспечивает энергией перезарядку 38 молекул АТФ (2 молекулы в цитоплазме и 36 в митохондриях).
Аналоги митохондрий у бактерий. У бактерий митохондрий нет. Вместо них у них имеются цепи переноса электронов, локализованные в мембране клетки.
2. Пластиды, строение, разновидности, функции. Проблема происхождения пластид
Пластиды (от. греч. plastides – создающие, образующие) – это двухмембранные органоиды, характерные для фотосинтезирующих эукариотных организмов. Различают три основных типа пластид: хлоропласты, хромопласты и лейкопласты. Совокупность пластид в клетке называют пластидомом. Пластиды связаны между собой единым происхождением в онтогенезе от пропластид меристематических клеток. Каждый их этих типов при определенных условиях может переходить один в другой. Как и митохондрии, пластиды содержат собственные молекулы ДНК. Поэтому они также способны размножаться независимо от деления клетки.
Хлоропласты (от греч. «chloros» – зеленый, «plastos» — вылепленный) – это пластиды, в которых осуществляется фотосинтез.
Общая характеристика хлоропластов.
i>Хлоропласты представляют собой органоиды зеленого цвета длиной 5-10 мкм и шириной 2-4 мкм. У зеленых водорослей встречаются гигантские хлоропласты (хроматофоры), достигающие длины 50 мкм. У высших растений хлоропласты имеют двояковыпуклую или эллипсоидную форму. Количество хлоропластов в клетке может варьировать от одного (некоторые зеленые водоросли) до тысячи (махорка). В клетке высших растений в среднем находится 15-50 хлоропластов. Обычно хлоропласты равномерно распределены по цитоплазме клетки, но иногда они группируются около ядра или клеточной оболочки. По-видимому, это зависит от внешних воздействий (интенсивность освещения).
Ультрамикроскопическое строение хлоропластов. От цитоплазмы хлоропласты отделены двумя мембранами, каждая из которых имеет толщину около 7 нм. Между мембранами находится межмембранное пространство диаметром около 20-30 нм. Наружная мембрана гладкая, внутренняя имеет складчатую структуру. Между складками располагаются тилакоиды, имеющие вид дисков. Тилакоиды образуют стопки наподобие столбика монет, называемые гранами. Между собой граны соединены другими тилакоидами (ламелы, фреты). Число тилакоидов в одной гране варьирует от нескольких штук до 50 и более. В свою очередь в хлоропласте высших растений находится около 50 гран (40-60), расположенных в шахматном порядке. Такое расположение обеспечивает максимальную освещенность каждой граны. В центре граны находится хлорофилл, окруженный слоем белка; затем располагается слой липоидов, снова белок и хлорофилл. Хлорофилл имеет сложное химическое строение и существует в нескольких модификациях (a, b, c, d). У высших растений и водорослей в качестве основного пигмента содержится хлорофилл а с формулой С55Н72О5N4Мg. В качестве дополнительных содержатся хлорофилл b (высшие растения, зеленые водоросли), хлорофилл с (бурые и диатомовые водоросли), хлорофилл d (красные водоросли). Образование хлорофилла происходит только при наличии света и железа, играющего роль катализатора. Матрикс хлоропласта представляет собой бесцветное гомогенное вещество, заполняющее пространство между тилакоидами. В матриксе находятся ферменты "темновой фазы" фотосинтеза, ДНК, РНК, рибосомы. Кроме этого, в матриксе происходит первичное отложение крахмала в виде крахмальных зерен.
Свойства хлоропластов:
· полуавтономность (имеют собственный белоксинтезирующий аппарат, однако большая часть генетической информации находится в ядре);
· способность к самостоятельному движению (уходят от прямых солнечных лучей);
· способность к самостоятельному размножению.
Размножение хлоропластов. Хлоропласты развиваются из пропластид, которые способны реплицироваться путем деления. У высших растений также встречается деление зрелых хлоропластов, но крайне редко. При старении листьев и стеблей, созревании плодов хлоропласты утрачивают зеленую окраску, превращаясь в хромопласты.
Функции хлоропластов. Основная функция хлоропластов – фотосинтез. Кроме фотосинтеза хлоропласты осуществляют синтез АТФ из АДФ (фосфорилирование), синтез липидов, крахмала, белков. В хлоропластах также синтезируются ферменты, обеспечивающие световую фазу фотосинтеза.
Хромопласты (от греч. chromatos – цвет, краска и «plastos» – вылепленный) – это окрашенные пластиды. Цвет их обусловлен наличием следующих пигментов: каротина (оранжево-желтый), ликопина (красный) и ксантофилла (желтый). Хромопластов особенно много в клетках лепестков цветков и оболочек плодов. Больше всего хромопластов в плодах и увядающих цветках и листьях. Хромопласты могут развиваться из хлоропластов, которые при этом теряют хлорофилл и накапливают каротиноиды. Это происходит при созревании многих фруктов: налившись спелым соком, они желтеют, розовеют или краснеют. Основная функция хромопластов заключается в обеспечении окраски цветов, плодов, семян.
В отличие от лейкопластов и особенно хлоропластов внутренняя мембрана хлоропластов не образует тилакоидов (или образует одиночные). Хромопласты – это конечный итог развития пластид (в хромопласты превращаются хлоропласты и пластиды).
Лейкопласты (от греч. leucos – белый, plastos – вылепленный, созданный). Это бесцветные пластиды округлой, яйцевидной, веретенообразной формы. Находятся в подземных частях растений, семенах, эпидермисе, сердцевине стебля. Особенно богаты лейкопластами клубни картофеля. Внутренняя оболочка образует немногочисленные тилакоиды. На свету из хлоропластов образуются хлоропласты. Лейкопласты, в которых синтезируется и накапливается вторичный крахмал называют амилопластами, масла – эйлалопластами, белки – протеопластами. Основная функция лейкопластов – это аккумуляция питательных веществ.
3. Проблема происхождения митохондрий и пластид. Относительная автономия
Существует две основные теории происхождения митохондрий и пластид. Это теории прямой филиации и последовательных эндосимбиозов. Согласно теории прямой филиации митохондрии и пластиды образовались путем компартизации самой клетки. Фотосинтезирующие эукариоты произошли от фотосинтезирующих прокариот. У образовавшихся автотрофных эукариотических клеток путем внутриклеточной дифференцировки образовались митохондрии. В результате утраты пластид от автотрофов произошли животные и грибы.
Наиболее обоснованной является теория последовательных эндосимбиозов. Согласно этой теории возникновение эукариотической клетки прошло через несколько этапов симбиоза с другими клетками. На первой стадии клетки типа анаэробных гетеротрофных бактерий включили в себя свободноживущие аэробные бактерии, превратившиеся в митохондрии. Параллельно этому в клетке-хозяине прокариотической генофор формируется в обособленное от цитоплазмы ядро. Таким путем возникла первая эукариотическая клетка, которая была гетеротрофной. Возникшие эукариотические клетки путем повторных симбиозов включили в себя синезеленые водоросли, что привело к появлению в них структур типа хлоропластов. Таким образом, митохондрии уже были у гетеротрофных эукариотических клеток, когда последние в результате симбиоза приобрели пластиды. В дальнейшем в результате естественного отбора митохондрии и хлоропласты утратили часть генетического материала и превратились в структуры с ограниченной автономией.
Доказательства эндосимбиотической теории:
1. Сходство структуры и энергетических процессов у бактерий и митохондрий, с одной стороны, и у синезеленых водорослей и хлоропластов, с другой стороны.
2. Митохондрии и пластиды имеют собственную специфическую систему синтеза белков (ДНК, РНК, рибосомы). Специфичность этой системы заключается в автономности и резком отличии от таковой в клетке.
3. ДНК митохондрий и пластид представляет собой небольшую циклическую или линейную молекулу, которая отличается от ДНК ядра и по своим характеристикам приближается к ДНК прокариотических клеток. Синтез ДНК митохондрий и пластид не зависит от синтеза ядерной ДНК.
4. В митохондриях и хлоропластах имеются и-РНК, т-РНК, р-РНК. Рибосомы и р-РНК этих органоидов резко отличаются от таковых в цитоплазме. В частности рибосомы митохондрий и хлоропластов, в отличие от цитоплазматических рибосом, чувствительны к антибиотику хлорамфениколу, подавляющему синтез белка у прокариотических клеток.
5. Увеличение числа митохондрий происходит путем роста и деления исходных митохондрий. Увеличение числа хлоропластов происходит через изменения пропластид, которые, в свою очередь, размножаются путем деления.
Эта теория хорошо объясняет сохранение у митохондрий и пластид остатков систем репликации и позволяет построить последовательную филогению от прокариот к эукариотам.
Относительная автономия хлоропластов и пластид. В некоторых отношениях митохондрии и хлоропласты ведут себя как автономные организмы. Например, эти структуры образуются только из исходных митохондрий и хлоропластов. Это было продемонстрировано в опытах на растительных клетках, у которых образование хлоропластов подавляли антибиотиком стрептомицином, и на клетках дрожжей, где образование митохондрий подавляли другими препаратами. После таких воздействий клетки уже никогда не восстанавливали отсутствующие органеллы. Причина в том, что митохондрии и хлоропласты содержат определенное количество собственного генетического материала (ДНК), который кодирует часть их структуры. Если эта ДНК утрачивается, что и происходит при подавлении образования органелл, то структура не может быть воссоздана. Оба типа органелл имеют свою собственную белок-синтезирующую систему (рибосомы и транспортные РНК), которая несколько отличается от основной белок-синтезирующей системы клетки; известно, например, что белок-синтезирующая система органелл может быть подавлена с помощью антибиотиков, тогда как на основную систему они не действуют. ДНК органелл ответственна за основную часть внехромосомной, или цитоплазматической, наследственности. Внехромосомная наследственность не подчиняется менделевским законам, так как при делении клетки ДНК органелл передается дочерним клеткам иным путем, нежели хромосомы. Изучение мутаций, которые происходят в ДНК органелл и ДНК хромосом, показало, что ДНК органелл отвечает лишь за малую часть структуры органелл; большинство их белков закодированы в генах, расположенных в хромосомах. Относительная автономия митохондрий и пластид рассматривается как одно из доказательств их симбиотического происхождения.
Источник: studizba.com
Происхождение митохондрий[править | править код]
В соответствии с теорией симбиогенеза, митохондрии появились в результате захвата примитивными клетками (прокариотами) бактерий. Клетки, которые не могли сами использовать кислород для генерации энергии, имели серьёзные ограничения в возможностях развития; бактерии же (прогеноты) могли это делать. В процессе развития таких отношений прогеноты передали множество своих генов сформировавшемуся, благодаря повысившейся энергоэффективности, ядру теперь уже эукариот[2]. Вот почему современные митохондрии больше не являются самостоятельными организмами. Хотя их геном кодирует компоненты собственной системы синтеза белка, многие ферменты и белки, необходимые для их функционирования, кодируются ядерными хромосомами, синтезируются в цитоплазме клетки и только потом транспортируются в органеллы.
Митохондрии в клетке[править | править код]
Впервые митохондрии обнаружены в виде гранул в мышечных клетках в 1850 году. Число митохондрий в клетке непостоянно. Их особенно много в клетках, у которых велика потребность в кислороде. По своему строению митохондрии представляют собой органеллы, обычно сферической формы, встречающиеся в эукариотической клетке в количестве от нескольких сотен до 1—2 тысяч и занимающие 10—20% её внутреннего объёма. Сильно варьируются также размеры (от 1 до 70 мкм) и форма митохондрий. В зависимости от того, в каких участках клетки в каждый конкретный момент времени происходит повышенное потребление энергии, митохондрии способны перемещаться по цитоплазме в зоны наибольшего энергопотребления, используя для движения структуры цитоскелета эукариотической клетки. В клетках растений и животных одновременно и примерно в равных количествах существуют три типа митохондриальных органелл: молодые протомитохондрии, зрелые митохондрии и старые постмитохондрии, деградирующие в липофусциновые гранулы[3].
Структура митохондрий[править | править код]
Наружная мембрана[править | править код]
Наружная мембрана митохондрии имеет толщину около 7 нм, не образует впячиваний и складок и замкнута сама на себя. На наружную мембрану приходится около 7% площади поверхности всех мембран клеточных органелл. Основная функция — отграничение митохондрии от цитоплазмы. Наружная мембрана митохондрии состоит из липидов с вкраплениями белков (соотношение 2 : 1). Особую роль играет порин — каналообразующий белок. Он образует в наружной мембране отверстия диаметром 2-3 нм, через которые могут проникать небольшие молекулы и ионы весом до 5 кДа. Крупные молекулы могут проникать сквозь наружную мембрану только посредством активного транспорта с помощью транспортных белков митохондриальных мембран. Для наружной мембраны характерно присутствие ферментов: монооксигеназы, ацил-СоА-синтетазы и фосфолипазы А2. Наружная мембрана митохондрии может взаимодействовать с мембраной эндоплазматического ретикулума; это играет важную роль в транспортировке липидов и ионов кальция.
Межмембранное пространство[править | править код]
Межмембранное пространство представляет собой пространство между наружной и внутренней мембранами митохондрии. Его размер — 10-20 нм. Так как наружная мембрана митохондрии проницаема для небольших молекул и ионов, их концентрация в периплазматическом пространстве мало отличается от таковой в цитоплазме. Крупным же белкам для транспорта из цитоплазмы в периплазматическое пространство необходимо иметь специфические сигнальные пептиды; поэтому белковые компоненты периплазматического пространства и цитоплазмы различны. Одним из белков, содержащихся не только во внутренней мембране, но и в периплазматическом пространстве, является цитохром c.
Внутренняя мембрана[править | править код]
Внутренняя мембрана состоит в основном из белковых комплексов (соотношение белок/липид — 3:1) и образует многочисленные гребневидные складки — кристы, существенно увеличивающие площадь её поверхности и, например, в клетках печени составляет около трети всех клеточных мембран. Характерной чертой состава внутренней мембраны митохондрий является присутствие в ней кардиолипина — особого фосфолипида, содержащего сразу четыре жирные кислоты и делающего мембрану абсолютно непроницаемой для протонов. Ещё одна особенность внутренней мембраны митохондрий — очень высокое содержание белков (до 70 % по весу), представленных транспортными белками, ферментами дыхательной цепи, а также крупными АТФ-синтетазными комплексами. Внутренняя мембрана митохондрии в отличие от внешней не имеет специальных отверстий для транспорта мелких молекул и ионов; на ней, на стороне, обращенной к матриксу, располагаются особые молекулы АТФ-синтазы, состоящие из головки, ножки и основания. При прохождении через них протонов происходит синтез АТФ. В основании частиц, заполняя собой всю толщу мембраны, располагаются компоненты дыхательной цепи. Наружная и внутренняя мембраны в некоторых местах соприкасаются, там находится специальный белок-рецептор, способствующий транспорту митохондриальных белков, закодированных в ядре, в матрикс митохондрии.
Матрикс[править | править код]
Матрикс — ограниченное внутренней мембраной пространство. В матриксе (розовом веществе) митохондрии находятся ферментные системы окисления пирувата, жирных кислот, а также ферменты цикла трикарбоновых кислот (цикла Кребса). Кроме того, здесь же находится митохондриальная ДНК, РНК и собственный белоксинтезирующий аппарат митохондрии.
Митохондриальная ДНК[править | править код]
Находящаяся в матриксе митохондриальная ДНК представляет собой замкнутую кольцевую двуспиральную молекулу, в клетках человека имеющую размер 16569 нуклеотидных пар, что приблизительно в 105 раз меньше ДНК, локализованной в ядре. В целом митохондриальная ДНК кодирует 2 рРНК, 22 тРНК и 13 субъединиц ферментов дыхательной цепи, что составляет не более половины обнаруживаемых в ней белков. В частности, под контролем митохондриального генома кодируются семь субъединиц АТФ-синтетазы, три субъединицы цитохромоксидазы и одна субъединица убихинол-цитохром-с-редуктазы. При этом все белки, кроме одного, две рибосомные и шесть транспортных РНК транскрибируются с более тяжёлой (наружной) цепи ДНК, а 14 других тРНК и один белок транскрибируются с более лёгкой (внутренней) цепи.
На этом фоне геном митохондрий растений значительно больше и может достигать 370000 нуклеотидных пар, что примерно в 20 раз больше описанного выше генома митохондрий человека. Количество генов здесь также примерно в 7 раз больше, что сопровождается появлением в митохондриях растений дополнительных путей электронного транспорта, не сопряжённых с синтезом АТФ.
Митохондриальная ДНК реплицируется в интерфазе, что частично синхронизировано с репликацией ДНК в ядре. Во время же клеточного цикла митохондрии делятся надвое путём перетяжки, образование которой начинается с кольцевой бороздки на внутренней митохондриальной мембране. Детальное изучение нуклеотидной последовательности митохондриального генома позволило установить то, что в митохондриях животных и грибов нередки отклонения от универсального генетического кода. Так, в митохондриях человека кодон ATA вместо изолейцина в стандартном коде кодирует аминокислоту метионин, кодоны AGA и AGG, обычно кодирующие аргинин, являются стоп-кодонами, а кодон TGA, в стандартном коде являющийся стоп-кодоном, кодирует аминокислоту метионин. Что касается митохондрий растений, то по-видимому, они используют универсальный генетический код. Другой чертой митохондрий является особенность узнавания кодонов тРНК, заключающаяся в том, что одна подобная молекула способна узнавать не один, но сразу три или четыре кодона. Указанная особенность снижает значимость третьего нуклеотида в кодоне и приводит к тому, что митохондрии требуется меньшее разнообразие типов тРНК. При этом достаточным количеством оказываются всего 22 различных тРНК.
Имея собственный генетический аппарат, митохондрия обладает и собственной белоксинтезирующей системой, особенностью которой в клетках животных и грибов являются очень маленькие рибосомы, характеризуемые коэффициентом седиментации 55S, что даже ниже аналогичного показателя у 70S-рибосом прокариотического типа. При этом две большие рибосомные РНК также имеют меньшие размеры, чем у прокариот, а малая рРНК вообще отсутствует. В митохондриях растений, напротив, рибосомы более сходны с прокариотическими по размерам и строению.
В специализированных (не делящихся) клетках митохондрии обычно не делятся. Обновление пула митохондрий в этом случае происходит путём созревания митохондрий из протомитохондрий, имеющих исходно диаметр 0,1-0,2 микрона. Откуда берутся протомитохондрии неизвестно, но предполагается, что затравкой для них служит ДНК постмитохондрий, высвобождающаяся в цитоплазму. Протомитохондрии обладают высокой скоростью дыхания, но невысоким дыхательным контролем (Векшин Н. Л. и др. 2004—2014).
Митохондриальные белки[править | править код]
Количество транслируемых с митохондриальной мРНК белков, формирующих субъединицы крупных ферментных комплексов, ограничено. Значительная часть белков кодируется в ядре и синтезируется на цитоплазматических 80S-рибосомах. В частности, так образуются некоторые белки — переносчики электронов, митохондриальные транслоказы, компоненты транспорта белков в митохондрии, а также факторы, необходимые для транскрипции, трансляции и репликации митохондриальной ДНК. При этом подобные белки на своём N-конце имеют особые сигнальные пептиды, размер которых варьирует от 12 до 80 аминокислотных остатков. Данные участки формируют амфифильные завитки, обеспечивают специфический контакт белков со связывающими доменами митохондриальных распознающих рецепторов, локализованных на наружной мембране. До наружной мембраны митохондрии данные белки транспортируются в частично развёрнутом состоянии в ассоциации с белками-шаперонами (в частности — с hsp70). После переноса через наружную и внутреннюю мембраны в местах их контактов поступающие в митохондрию белки вновь связываются с шаперонами, но уже собственного митохондриального происхождения, которые подхватывают пересекающий мембраны белок, способствуют его втягиванию в митохондрию, а также контролируют процесс правильного сворачивания полипептидной цепи. Большинство шаперонов обладает АТФазной активностью, в результате чего как транспорт белков в митохондрию, так и образование их функционально активных форм являются энергозависимыми процессами.
Функции митохондрий и энергообразование[править | править код]
Одной из основных функций митохондрий является синтез АТФ — универсальной формы химической энергии в любой живой клетке. Как и у прокариот, данная молекула может образовываться двумя путями: в результате субстратного фосфорилирования в жидкой фазе (например, при гликолизе) или в процессе мембранного фосфорилирования, связанного с использованием энергии трансмембранного электрохимического градиента протонов (ионов водорода). Митохондрии реализуют оба эти пути, первый из которых характерен для начальных процессов окисления субстрата и происходит в матриксе, а второй завершает процессы энергообразования и связан с кристами митохондрий. При этом своеобразие митохондрий как энергообразующих органелл эукариотической клетки определяет именно второй путь генерации АТФ, получивший название «хемиосмотического сопряжения». По сути это последовательное превращение химической энергии восстанавливающих эквивалентов НАДН в электрохимический протонный градиент ΔμН+ по обе стороны внутренней мембраны митохондрии, что приводит в действие мембранно-связанную АТФ-синтетазу и завершается образованием макроэргической связи в молекуле АТФ.
В целом весь процесс энергообразования в митохондриях может быть разбит на четыре основные стадии, первые две из которых протекают в матриксе, а две последние — на кристах митохондрий:
- Превращение поступивших из цитоплазмы в митохондрию пирувата и жирных кислот в ацетил-СоА;
- Окисление ацетил-СоА в цикле Кребса, ведущее к образованию НАДН и двух молекул СО2;
- Перенос электронов с НАДН на кислород по дыхательной цепи с образованием Н2О;
- Образование АТФ в результате деятельности мембранного АТФ-синтетазного комплекса.
Ещё в цитоплазме в серии из 10 отдельных ферментативных реакций гликолиза шестиуглеродная молекула глюкозы частично окисляется до двух трёхуглеродных молекул пирувата с образованием двух молекул АТФ. Затем пируват переносится из цитозоля через наружную и внутреннюю мембраны в матрикс, где первоначально декарбоксилируется и превращается в ацетил-СоА. Этот процесс катализируется крупным пируватдегидрогеназным комплексом, имеющим размер, сопоставимый с размером рибосомы, и состоящим из трёх ферментов, пяти коферментов и двух регуляторных белков. Точно так же жирные кислоты, полученные при расщеплении нерастворимых триглицеридов в цитоплазме, переносятся в митохондриальный матрикс в виде ацил-СоА-производных и подвергаются бета-окислению с образованием ацетил-СоА.
На следующем этапе, также протекающем в матриксе митохондрии, ацетил-СоА полностью окисляется в цикле Кребса. В его работе задействованы четыре отдельных фермента, за каждый цикл обеспечивающие распад ацетил-СоА на два атома углерода, в виде СО2. Этот процесс обеспечивает образование одной молекулы ГТФ, а также НАДН — высокоэнергетического промежуточного соединения, которое легко отдаёт электроны в цепь переноса электронов на кристах митохондрий.
Дальнейшие процессы энергообразования в митохондрии происходят на её кристах и связаны с переносом электронов от НАДН к кислороду. В соответствии с тем, что потребление кислорода в качестве окислителя обычно называют «внутриклеточным дыханием», электронно-транспортную цепь ферментов, осуществляющих последовательный перенос электронов от НАДН к кислороду, часто называют «дыхательной цепью». При этом трансформация энергии окисления осуществляется ферментами, расположенными на кристах митохондрий и осуществляющими векторный (направленный по отношению к сторонам мембраны) перенос протонов водорода из матрикса митохондрии в межмембранное пространство. В этом состоит принципиальное отличие работы оксидоредуктаз дыхательной цепи от функционирования ферментов, катализирующих реакции в гомогенном (изотропном) растворе, где вопрос о направлении реакции в пространстве не имеет смысла.
Весь процесс переноса электрона по дыхательной цепи может быть разбит на три стадии, каждая из которых катализируется отдельным трансмембранным липопротеидным комплексом (I, III и IV), встроенным в мембрану кристы митохондрии. В состав каждого из названных комплексов входят следующие компоненты:
- Большой олигомерный фермент, катализирующий перенос электронов;
- Небелковые органические (простетические) группы, принимающие и высвобождающие электроны;
- Белки, обеспечивающие движение электронов.
Каждый из этих комплексов осуществляет перенос электронов от донора к акцептору по градиенту редокс-потенциала через ряд последовательно функционирующих переносчиков. В качестве последних в дыхательной цепи митохондрий функционируют мигрирующие в плоскости мембраны жирорастворимые молекулы убихинона, а также небольшие (молекулярная масса 13 кДа) водорастворимые белки, содержащие ковалентно связанный гем и называемые «цитохромами с». При этом три из пяти компонентов, составляющих дыхательную цепь, работают так, что перенос электронов сопровождается переносом протонов через мембрану крист митохондрий в направлении из матрикса в межмембранное пространство.
Дыхательная цепь начинается с комплекса I (НАДН-убихинон-оксидоредуктаза), состоящего как минимум из 26 полипептидных цепей и имеющего молекулярную массу около 850 кДа. Функциональная активность этого комплекса определяется тем, что он содержит в своём составе более 20 атомов железа, упакованных в ячейки из атомов серы, а также флавин (флавинмононуклеотид — производное витамина рибофлавина). Комплекс I катализирует окисление НАДН, отщепляя от него два электрона, которые после «путешествия» по окислительно-восстановительным компонентам комплекса I попадают на молекулу-переносчик, в качестве которой выступает убихинон (Q). Последний способен ступенчато восстанавливаться, принимая на себя по два электрона и протона и, таким образом, превращаясь в восстановленную форму — убихинол (QH2).
Энергетический потенциал (запас энергии) в молекуле убихинола существенно ниже, чем в молекуле НАДН, а разница в подобной энергии временно запасается в виде электрохимического протонного градиента. Последний возникает в результате того, что перенос электронов по простетическим группам комплекса I, ведущий к снижению энергетического потенциала электронов, сопровождается трансмембранным переносом двух протонов из матрикса в межмембранное пространство митохондрии.
Восстановленный убихинол мигрирует в плоскости мембраны, где достигает второго фермента дыхательной цепи — комплекса III (цитохром bc1). Последний представляет собой димер с молекулярной массой более 300 кДа, сформированный из восьми полипептидных цепей и содержащий атомы железа как в виде железосерных центров, так и в виде комплексов с гемами b(I), b(II) и c1 — сложными гетероциклическими молекулами с четырьмя атомами азота, расположенными по углам металлосвязывающего квадрата. Комплекс III катализирует реакцию окисления двух убихинолов до убихинонов, восстанавливая две молекулы цитохрома c (гемсодержащий переносчик, находящегося в межмембранном пространстве). Отщепляющиеся при этом от убихинолов четыре протона освобождаются в межмембранное пространство, продолжая формирование электрохимического градиента.
Последняя стадия катализируется комплексом IV (цитохром c-оксидаза) с молекулярной массой около 200 кДа, состоящим из 10-13 полипептидных цепей и, помимо двух различных гемов, включающим также несколько атомов меди, прочно связанных с белками. При этом электроны, отбираемые у восстановленного цитохрома c, пройдя по атомам железа и меди в составе комплекса IV, попадают на связанный в активном центре этого фермента кислород, что приводит к образованию воды.
Таким образом, суммарная реакция, катализируемая ферментами дыхательной цепи, состоит в окислении НАДН кислородом с образованием воды. По сути этот процесс заключается в ступенчатом переносе электронов между атомами металлов, присутствующих в простетических группах белковых комплексов дыхательной цепи, где каждый последующий комплекс обладает более высоким сродством к электрону, чем предыдущий. При этом сами электроны передаются по цепи до тех пор, пока не соединятся с молекулярным кислородом, обладающим наибольшим сродством к электронам. Освобождаемая же при этом энергия запасается в виде электрохимического (протонного) градиента по обе стороны внутренней мембраны митохондрий. При этом считается, что в процессе транспорта по дыхательной цепи пары электронов перекачивается от трёх до шести протонов.
Завершающим этапом функционирования митохондрии является генерация АТФ, осуществляемая встроенным во внутреннюю мембрану специальным макромолекулярным комплексом с молекулярной массой 500 кДа. Этот комплекс, называемый АТФ-синтазой, как раз и катализирует синтез АТФ путём конверсии энергии трансмембранного электрохимического градиента протонов водорода в энергию макроэргической связи молекулы АТФ.
АТФ-синтаза[править | править код]
В структурно-функциональном плане АТФ-синтаза состоит из двух крупных фрагментов, обозначаемых символами F1 и F0. Первый из них (фактор сопряжения F1) обращён в сторону матрикса митохондрии и заметно выступает из мембраны в виде сферического образования высотой 8 нм и шириной 10 нм. Он состоит из девяти субъединиц, представленных пятью типами белков. Полипептидные цепи трёх субъединиц α и стольких же субъединиц β уложены в похожие по строению белковые глобулы, которые вместе образуют гексамер (αβ)3, имеющий вид слегка приплюснутого шара. Подобно плотно уложенным долькам апельсина, последовательно расположенные субъединицы α и β образуют структуру, характеризующуюся осью симметрии третьего порядка с углом поворота 120°. В центре этого гексамера находится субъединица γ, которая образована двумя протяжёнными полипептидными цепями и напоминает слегка деформированный изогнутый стержень длиной около 9 нм. При этом нижняя часть субъединицы γ выступает из шара на 3 нм в сторону мембранного комплекса F0. Также внутри гексамера находится минорная субъединица ε, связанная с γ. Последняя (девятая) субъединица обозначается символом δ и расположена на внешней стороне F1.
Мембранная часть АТФ-синтазы, называемая фактором сопряжения F0, представляет собой гидрофобный белковый комплекс, пронизывающий мембрану насквозь и имеющий внутри себя два полуканала для прохождения протонов водорода. Всего в состав комплекса F0 входит одна белковая субъединица типа а, две копии субъединицы b, а также от 9 до 12 копий мелкой субъединицы c. Субъединица а (молекулярная масса 20 кДа) полностью погружена в мембрану, где образует шесть пересекающих её α-спиральных участков. Субъединица b (молекулярная масса 30 кДа) содержит лишь один сравнительно короткий погружённый в мембрану α-спиральный участок, а остальная её часть заметно выступает из мембраны в сторону F1 и закрепляется за расположенную на её поверхности субъединицу δ. Каждая из 9-12 копий субъединицы c (молекулярная масса 6-11 кДа) представляет собой сравнительно небольшой белок из двух гидрофобных α-спиралей, соединённых друг с другом короткой гидрофильной петлёй, ориентированной в сторону F1, а все вместе образуют единый ансамбль, имеющий форму погружённого в мембрану цилиндра. Выступающая из комплекса F1 в сторону F0 субъединица γ как раз и погружена внутрь этого цилиндра и достаточно прочно зацеплена за него.
Таким образом, в молекуле АТФ-синтазы можно выделить две группы белковых субъединиц, которые могут быть уподоблены двум деталям мотора: ротору и статору. «Статор» неподвижен относительно мембраны и включает в себя шарообразный гексамер (αβ)3, находящуюся на его поверхности и субъединицу δ, а также субъединицы a и b мембранного комплекса F0. Подвижный относительно этой конструкции «ротор» состоит из субъединиц γ и ε, которые, заметно выступая из комплекса (αβ)3, соединяются с погружённым в мембрану кольцом из субъединиц c.
Способность синтезировать АТФ — свойство единого комплекса F0F1, сопряжённого с переносом протонов водорода через F0 к F1, в последнем из которых как раз и расположены каталитические центры, осуществляющие преобразование АДФ и фосфата в молекулу АТФ. Движущей же силой для работы АТФ-синтазы является протонный потенциал, создаваемый на внутренней мембране митохондрий в результате работы цепи электронного транспорта.
Сила, приводящая в движение «ротор» АТФ-синтазы, возникает при достижении разности потенциалов между наружной и внутренней сторонами мембраны > 220 мВ и обеспечивается потоком протонов, протекающих через специальный канал в F0, расположенный на границе между субъединицами a и c. При этом путь переноса протонов включает в себя следующие структурные элементы:
- Два расположенных несоосно «полуканала», первый из которых обеспечивает поступление протонов из межмембранного пространства к существенно важным функциональным группам F0, а другой обеспечивает их выход в матрикс митохондрии;
- Кольцо из субъединиц c, каждая из которых в своей центральной части содержит протонируемую карбоксильную группу, способную присоединять H+ из межмембранного пространства и отдавать их через соответствующие протонные каналы. В результате периодических смещений субъединиц с, обусловленных потоком протонов через протонный канал происходит поворот субъединицы γ, погружённой в кольцо из субъединиц с.
Таким образом, каталитическая активность АТФ-синтазы непосредственно связана с вращением её «ротора», при котором поворот субъединицы γ вызывает одновременное изменение конформации всех трёх каталитических субъединиц β, что в конечном счёте и обеспечивает работу фермента. При этом в случае образования АТФ «ротор» крутится по часовой стрелке со скоростью четыре оборота в секунду, а само подобное вращение происходит дискретными скачками по 120°, каждый из которых сопровождается образованием одной молекулы АТФ.
Непосредственная функция синтеза АТФ локализована на β-субъединицах сопрягающего комплекса F1. При этом самым первым актом в цепи событий, приводящих к образованию АТФ, является связывание АДФ и фосфата с активным центром свободной β-субъединицы, находящейся в состоянии 1. За счёт энергии внешнего источника (тока протонов) в комплексе F1 происходят конформационные изменения, в результате которых АДФ и фосфат становятся прочно связанными с каталитическим центром (состояние 2), где становится возможным образование ковалентной связи между ними, ведущей к образованию АТФ. На данной стадии АТФ-синтазы ферменту практически не требуется энергии, которая будет необходима на следующем этапе для освобождения прочно связанной молекулы АТФ из ферментативного центра. Поэтому следующий этап работы фермента заключается в том, чтобы в результате энергозависимого структурного изменения комплекса F1 каталитическая β-субъединица, содержащая прочно связанную молекулу АТФ, перешла в состояние 3, в котором связь АТФ с каталитическим центром ослаблена. В результате этого молекула АТФ покидает фермент, а β-субъединица возвращается в исходное состояние 1, благодаря чему обеспечивается цикличность работы фермента.
Работа АТФ-синтазы связана с механическими движениями её отдельных частей, что позволило отнести этот процесс к особому типу явлений, названных «вращательным катализом». Подобно тому, как электрический ток в обмотке электродвигателя приводит в движение ротор относительно статора, направленный перенос протонов через АТФ-синтазу вызывает вращение отдельных субъединиц фактора сопряжения F1 относительно других субъединиц ферментного комплекса, в результате чего это уникальное энергообразующее устройство совершает химическую работу — синтезирует молекулы АТФ. В дальнейшем АТФ поступает в цитоплазму клетки, где расходуется на самые разнообразные энергозависимые процессы. Подобный перенос осуществляется специальным встроенным в мембрану митохондрий ферментом АТФ/АДФ-транслоказой, который обменивает вновь синтезированную АТФ на цитоплазматическую АДФ, что гарантирует сохранность фонда адениловых нуклеотидов внутри митохондрий.
Митохондрии и наследственность[править | править код]
ДНК митохондрий наследуются почти исключительно по материнской линии. Каждая митохондрия имеет несколько участков нуклеотидов в ДНК, идентичных во всех митохондриях (то есть в клетке много копий митохондриальных ДНК), что очень важно для митохондрий, неспособных восстанавливать ДНК от повреждений (наблюдается высокая частота мутаций). Мутации в митохондриальной ДНК являются причиной целого ряда наследственных заболеваний человека.
История изучения[править | править код]
Митохондрия была открыта в середине XIX века. В конце XX века стало известно, что, выпуская сигнальные молекулы, митохондрии активируют смерть клетки[4].
См. также[править | править код]
- Симбиогенез
- Митохондриальная ДНК
- Митохондриальная Ева
- Митохондриальные заболевания
- Гидрогеносомы
Литература[править | править код]
- М. Б. Беркинблит, С. М. Глаголев, В. А. Фуралев. Общая биология. — М.: МИРОС, 1999.
- Д. Тейлор, Н. Грин, У. Стаут. Биология. — М.: МИР, 2006.
- Э. Уиллет. Генетика без тайн. — М.: ЭКСМО, 2008.
- Д. Г. Дерябин. Функциональная морфология клетки. — М.: КДУ, 2005.
- Белякович А.Г. Изучение митохондрий и бактерий с помощью соли тетразолия п-НТФ. — Пущино: ОНТИ НЦБИ АН СССР, 1990.
- Н. Л. Векшин. Флуоресцентная спектроскопия биополимеров. Пущино, Фотон, 2009.
Источник: ru.wikipedia.org