Рибосомы прокариот и эукариот
Характерискика рибосом
 Рибосомы
Рибосомы
эукариот: 80S, размер — 22×32 нм,
M ~4.5 млн.Да состоит из двух субъединиц.
Большая субъединица М=3.0млн.Да, 60S
[1rRNA 5S (~120н), 1рРНК 5.8S (~160н), 1rRNA 28S (4800н),
45-50 белковых молекул].
Малая субъединица
М=1.5 млн.Да, 40S [1rRNA18S (1900н), 30-35
белковые молекулы].
В цитоплазме эукариотической клетки содержится ~10 млн. рибосом
эукариотического типа.
Рибосомы прокариот:
70S, размер — 21×29 нм, М ~2.8 млн.Да,
состоит из двух субъединиц.
Большая субъединица М=1.8млн.Да 50S
[1rRNA 23S(~2904н), 1rRNA 5S(~120н), 34 белковые молекулы
(L1-L34)].
Малая субъединица М=1.0млн.Да 30S
[1rRNA 16S (~1542н), 21 белковые молекулы (S1-S21)].
В клетке E.coli содержится ~15тыс. рибосом, что составляет
– 1/4 сухой массы клетки. Рибосомы прокариотического типа
присутствуют в митохондриях и пластидах эукариот.
Малые и большие субъединицы могут диссоциировать на составляющие
РНК и белки и самособираются при определенных условиях.
Строение рибосом
Рибосома имеет два участка для связывания тРНК:
Р-центр (пептидил-тРНК-связывающий центр)
— связывание тРНК присоединенной к растущей полипептидной
цепи.
А-центр (аминоацил-тРНК-связывающий участок)
— связвает тРНК несущую следующую добавляемую аминокислоту,
располагается на большой субъединице рибосомы.
Аcn
центр
пептидилтрансфераза –
образует пептидные связи между актами, прочно связывается
с рибосомой.
рибосома
р эукариот 22×32 нм, M~4.5 млн.Да 80S. Большая субъед М=3.0млн.Да, 60S [1rRNA 5S (~120н), 1рРНК 5.8S (~160н), 1rRNA 28S (~5 тыс.н), ~45 белков]; малая субъед М=1.5 млн.Да, 40S.
1rRNA18S (~2 тыс.н),~33 белка] | в цитоплазме Eu ~10 млн.р эукариотич типа |
р прокариот: 21×29 нм, М ~2.8 млн.Да, 70S | большая субъед М=1.8млн.Да 50S[1RNA 23S(~3200н), 1rRNA 5S(~120н), 34белка]; малая субъед М=1.0млн.Да 30S[1rRNA 16S (~1600н), 21 белок] | E.coli ~15тыс р – 1.4 сухой m кл | р прокариотич типа присут в митох и пластидах Eu |
| P-центр пептидил-тРНК-связывающий центр, А-центр большой субъед.
– аминоацил-тРНК-связывающий участок, Аcn центр | пептидилтрансфераза – образ. пептидные связи м-у актами, прочно связан с р | р прокариот мельче и сод меньше компонентов
мРНК [кэп | 5’-НТО | AUG | транслируемая область | стоп 3’-НТО | поли(А)]
инициация сканирование РНК малой субъединицой рибосомы | связывание со стартовым (инициирующим) кодоном AUG-5’ конца – сборка рибосомы | инициаторный комплекс, факторы инициации | Первой к мРНК присоед малая субъед. р связанная с инициаторной-тРНК узнающей AUG и несущей метионин. Процесс катализируется фактором инициации 2 IF2 – фосфорилирование одной из трех его субъед. снижает активность ф-та – контроль белкогого синтеза (незрелые эритроциты) | элонгация 5’?3’ | транслокация – возвращение пустой тРНК в цитоплазму | транслокация рибосомы вдоль мРНК сопровожд. конформационными изменениями с затратой энергии GTP (4GTP вцелом на 1 пепт. связь) | кодон мРНК спаривается с антикодоном тРНК | карбоксильный конец растущего полипептида связан ковалентно с тРНК – пептидил-тРНК | образ. полисомы | терминирующий кодон (стоп-кодон) UAA, UAG, UGA – диссоциация рибосомы – терминация | фактор освобождения-белок связ с стоп-кодоном и меняет активность пептидилтрансферазы кот присоед к пептидил-тРНК Н2О и полипептид отделяется от тРНК и выходит из р | Цикл элонгации составляет 1/20 сек – белок в 300 акт синтезируется за 20 сек Ecoli
Источник: cellbiol.ru
2.3. Морфология рибосом
На малом увеличении электронного микроскопа (до 20 000х) рибосомы выглядят как электронно-плотные округлые частицы диаметром 2530 нм. На большом увеличении (выше 100 000х) видно, что они разделены бороздкой на две неравные части, представляющие собой малую и большую субъединицы с соотношением масс 1:2.
В физиологических условиях рибосомы обратимо диссоциируют на субъединицы. При этом прокариотические рибосомы диссоциируют по схеме:
70S <=> 30S + 50S,
тогда как эукариотические рибосомы диссоциируют по схеме:
80S <=> 40S + 60S
Дефицит коэффициента седиментации связан с тем, что плавучая плотность рибосом зависит не только от массы субъединиц, но и от их формы.
Малая субъединица прокариотической рибосомы 30S имеет продолговатую форму, ее длина составляет 23 нм, а ширина – 12 нм. Она разделена на доли, которые называются “головка”, “тело” и “боковой выступ”. Наиболее выражена поперечная борозда, которая разделяет головку и тело. Малая субъединица эукариотической рибосомы 40S похожа на малую прокариотическую субъединицу 30S, но имеет две дополнительные детали – выступ головки со стороны, противоположной боковому выступу тела, а также раздвоенность дистального конца тела.
Большая субъединица прокариотической рибосомы 50S диаметром 25 нм внешне идентична большой субъединице эукариотической рибосомы 60S. В большой субъединице имеются три выступа: средний выступ или “головка”, боковая доля или “ручка”, палочковидный отросток или “носик”. В целом форма большой субъединицы напоминает чайник для заварки.
Объединение субъединиц в полную рибосому происходит строго закономерным образом. При этом головки и боковые выступы малой и большой субъединиц ориентируются в одну сторону и накладываются друг на друга. Уплощенные поверхности субъединиц также взаимно дополняют друг друга в пространстве.
Источник: StudFiles.net
Что такое полисома
В клетках эукариот и прокариот обязательными структурами являются рибосомы. Это мелкие тельца, состоящие из двух субъединиц и выполняющие функцию синтеза белка в процессе трансляции. Рибосомы – это немембранные структуры.
Полисома – это образование, состоящее из нескольких рибосом. Они связываются между собой с помощью матричной или информационной РНК. Несколько рибосом, наподобие бусинок, насаживаются на эту молекулу, в результате чего получается временная структура – полисома.
Полисомы клетки концентрируются там, где необходим быстрый синтез большого количества белков. В этом заключается главная биологическая роль этих образований.
Строение рибосомы
Т. к. образуют полисому несколько связанных между собой рибосом, нужно рассмотреть строение последних.
Любая рибосома клетки состоит из двух субъединиц: большой и малой. Между ними образуется небольшая щель, по диаметру в точности подходящая для молекулы мРНК, которая там должна находиться.
Рибосомы представляют собой сложные нуклеопротеидные комплексы, т. к. в состав как малой, так и большой субъединицы входят молекулы рибосомальной РНК и белки. Белки выполняют функцию каркаса, а РНК, которые обладают рибозимной (ферментативной) активностью, используются в процессе трансляции.
Отличия между рибосомами прокариот и эукариот
Т. к. прокариоты и эукариоты – это две разные группы организмов, у них есть отличия в составе рибосом, а значит, и полисом тоже.
У прокариот в цитоплазме находится большое количество 70S рибосом (S – это константа седиментации, которая показывает скорость осаждения частиц в центрифуге). Они образованы большой 50S субъединицей и малой 30S субъединицей. В состав большой субъединицы у прокариот входят 5S и 23S РНК. В свою очередь, малая субъединица образована 16S РНК.
В бактериальных клетках образуется много полисом. Это связано с тем, что у них процесс синтеза белка идет очень быстро: трансляция начинается еще до того, как закончится процесс транскрипции. По этой же причине концентрация рибосом в клетке самая большая возле нуклеоида.
У эукариот наблюдаются отличия в значениях константы седиментации элементов рибосомы. Для нее это значение равно 80, для большой и малой субъединиц – 60 и 40 соответственно. В составе большой субъединицы выделяют 5S, 28S и 5,8S РНК, а в малой — 18S РНК.
И у прокариот, и у эукариот полисомы ускоряют процесс синтеза белка. Это очень важно, когда необходимо быстрое образование копий молекул белков. Высокая скорость синтеза особо характерна для бактерий, т. к. их матричная РНК существует непродолжительное время, и за этот промежуток необходимо синтезировать как можно больше молекул белка. Вот что такое полисома в биологии.
Процесс трансляции – основная функция полисомы
В процессе трансляции образуется первичная структура молекулы белка. Выделяют три этапа синтеза полипептидов: инициация, элонгация и терминация.
1. Инициация трансляции. Молекула мРНК должна прикрепиться к 16S РНК по принципу комплементарности. Для этого существует специальная последовательность, которая у прокариот называется рибосомсвязывающим сайтом, а у эукариот – кэпом. Следовательно, информационная РНК присоединяется в малой субъединице рибосомы.
2. Элонгация. Этот этап характеризуется наращиванием полипептидной цепи. Транспортные РНК приносят к рибосоме аминокислоты, которые присоединяются к образующейся цепи посредством пептидой связи. Так, синтез белка проходит до того момента, когда рибосома не наткнется на стоп-кодон.
3. Терминация. После того как она дошла до стоп-кодона, синтез белка прекращается. Новообразованная молекула полипептида выпадает из рибосомы через специальный ход, а далее проходит процесс образования вторичной, третичной или четвертичной структуры.
Рибосомальный профилинг – метод изучения рибосом
Чтобы изучить, что такое полисома, необходимо выделить эту структуру из клетки организма. Проще всего проводить исследования на клетках прокариот. Рибосомальный профилинг включает в себя следующие этапы:
1. Разрушение прокариотической клетки. Важно, что разрушение должно осуществляться механическим способом, т. к. химические вещества способны повредить сами рибосомы.
2. Расщепление РНК, которые не являются рибосомальными.
3. По тому же принципу проводится удаление ненужных полипептидов, которые не входят в состав структуры.
4. Обратная транскрипция выделенных рибосомальных РНК.
5. Секвернирование полученной ДНК.
Заключение
Полисома — это структура, которая образована из нескольких рибосом. Ее задача состоит в ускоренном синтезе белков. Эти структуры обнаружены в клетках прокариот и эукариот, поэтому они характерны для клеток любого организма. Вот что такое полисомы.
Источник: fb.ru
Содержание
- 1 Состав рибосомы
- 1.1 Рибосомные РНК
- 1.1.1 РНК малой субъединицы
- 1.1.2 РНК большой субъединицы
- 1.2 Рибосомные белки
- 1.3 Низкомолекулярные компоненты
- 1.1 Рибосомные РНК
- 2 Механизм трансляции
- 3 История исследований рибосомы
- 4 Примечания
- 5 Литература
- 6 Ссылки
Состав рибосомы
Рибосома состоит из специфических (рибосомных) РНК, специфических (рибосомных) белков и небольшого количества низкомолекулярных компонентов.
Рибосомные РНК
Основная статья: Рибосомные рибонуклеиновые кислоты
Структурно и функционально рибосома — это, прежде всего, её РНК. Рибосомная РНК (рРНК) в составе рибосомы очень компактна, имеет сложную третичную структуру и плотно инкрустирована молекулами различных рибосомных белков. Очищенные от белков высокомолекулярные рибосомные РНК в специально подобранных условиях (20 мМ Mg2+, ионная сила 0,3—0,5, иногда условия включают также присутствие ди- и полиаминов, этанола) самопроизвольно сворачиваются в компактные частицы, морфологически (формой, внутренней структурой и размерами) очень схожие с рибосомными субчастицами, основу которых они составляют. Таким образом, общий план структурной организации рибосомы задаётся свойствами рРНК. Третичная структура рРНК выступает каркасом для размещения рибосомных белков, белки же в определённом смысле играют лишь второстепенную роль в формировании и поддержании структуры рибосомы и её функционировании.
Как полагают, эволюция рибосомы началась ещё в добелковую эру. Предположительно «предками» рибосом являлись некие древние рибозимы. Полагают, что в ходе прогрессивной эволюции (с усложнением уровня организации живых систем) некие рибозимы, способные катализировать образование амидных связей, также прогрессировали («обрастали» дополнительными модулями, а позже — также и синтезируемыми ими полипептидами), вплоть до образования современного аппарата белкового синтеза, включая рибосому. Современная рибосома, по своей сути, продолжает оставаться рибозимом — основная структурно-функциональная нагрузка лежит на её РНК, а не на белках, как когда-то полагали. В состав пептидилтрансферазного центра — наиболее древней, эволюционно консервативной и функционально важной части рибосомы — входит исключительно РНК. Тот факт, что в то время как практически во всех процессах жизнедеятельности ведущую роль играют белки, в синтезе самих белков ведущая роль принадлежит РНК, является сильным аргументом в пользу гипотезы РНК-мира как древнего добелкового этапа эволюции живой материи.
РНК малой субъединицы
Рибосомная РНК малой субъединицы рибосомы обозначается как 16S рРНК (в случае бактериальных рибосом) или 16S-подобная рРНК (в других случаях). В большинстве случаев рРНК малой субъединицы представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. Однако 16S-подобная рРНК митохондриальных рибосом некоторых протистов фрагментирована (например, у Chlamydomonas reinhardtii она состоит из четырёх отдельных полирибонуклеотидов).
Число нуклеотидных звеньев, как и константы седиментации, для образцов 16S и 16S-подобных рРНК из различных источников могут существенно различаться. В рибосомах бактерий, архей и в рибосомах пластидов высших растений эти молекулы имеют размер около 1500 нуклеотидных остатков (Escherichia coli — 1542). Для 16S-подобных рРНК эукариотических цитоплазматических рибосом, а также для митохондриальных рибосом грибов и высших растений характерна длина до 2000 нуклеотидных остатков (18S рРНК). Митохондриальные рибосомы млекопитающих содержат относительно короткие 16S-подобные рРНК (10—12S), которые состоят из ~950 нуклеотидных остатков. Ещё более короткие 16S-подобные рРНК, размером всего ~600 нуклеотидных остатков, обнаружены в рибосомах кинетопласта трипаносоматид.
РНК большой субъединицы
Высокомолекулярная РНК, составляющая структурную основу большой субъединицы рибосомы, обозначается как 23S рРНК (в случае бактериальных рибосом) или 23S-подобная рРНК (в других случаях). Бактериальная 23S рРНК, также как и 16S рРНК, представляет собой одну ковалентно непрерывную полирибонуклеотидную цепь. В то же время 23S-подобная рРНК цитоплазматических рибосом эукариот состоит из двух прочно ассоциированных полирибонуклеотидных цепей — 28S и 5,8S рРНК (5,8S рРНК является структурным эквивалентом 5′-концевого ~160-нуклеотидного сегмента 23S рРНК, который оказался «отщеплён» в виде ковалентно обособленного фрагмента). 23S-подобная рРНК рибосом пластидов растений также состоит из двух прочно ассоциированных полирибонуклеотидных цепей и содержит 4,5S рРНК — структурный эквивалент 3′-концевого сегмента 23S рРНК. Известны случаи и ещё более глубоко зашедшей фрагментированности РНК, примером чего может служить 23S-подобная рРНК цитоплазматических рибосом некоторых протистов. Так, у Crithidia fasciculata она состоит из 7 отдельных фрагментов, а у Euglena gracilis — из 14.
Кроме вышеуказанной 23S(-подобной) рРНК, большая субъединица обычно содержит также относительно низкомолекулярную РНК — так называемую 5S рРНК. В отличие от вышеупомянутых 5,8S и 4,5S рРНК, 5S рРНК менее прочно ассоциирована с 23S(-подобной) рРНК, транскрибируется с отдельного гена и, таким образом, не может быть рассмотрена как отщеплённый фрагмент высокополимерной рРНК. 5S рРНК входит в состав большой субъединицы цитоплазматических рибосом всех прокариот и эукариот, но, по-видимому, не является непременной составляющей любой функциональной рибосомы, так как 5S рРНК отсутствуют в митохондриальных рибосомах млекопитающих (так называемых «минирибосомах»).
Число нуклеотидных звеньев, как и константы седиментации, для образцов 23S и 23S-подобных рРНК из различных источников могут существенно различаться. Например, 23S рРНК Escherichia coli состоит из 2904 нуклеотидных остатков, цитоплазматическая 26S рРНК Saccharomyces cerevisiae — из 3392, митохондриальная 26S рРНК Saccharomyces cerevisiae — из 3273, цитоплазматическая 28S рРНК Homo sapiens — из 5025. Большие субъединицы митохондриальных рибосом млекопитающих содержат относительно короткие 23S-подобные рРНК — всего 1560—1590 нуклеотидных остатков. Молекула 5,8S рРНК комплекса 28S•5,8S рРНК, характерного для цитоплазматических эукариотических рибосом, имеет длину около 160 нуклеотидных остатков. Длина 5S рРНК довольно консервативна и составляет 115—125 нуклеотидных остатков.
Рибосомные белки
Помимо рРНК, рибосома содержит также около 50 (прокариотические рибосомы) или 80 (цитоплазматические рибосомы эукариот) различных белков. Почти каждый из этих белков представлен лишь одной копией на каждую рибосому. Преобладают умеренно-осно́вные белки. Большинство рибосомных белков эволюционно консервативны, многие белки рибосом из различных источников могут быть соотнесены как гомологи, что учитывается в современной универсальной номенклатуре рибосомных белков. Рибосома на 30—50 % состоит из белка.
Низкомолекулярные компоненты
Кроме биополимеров (РНК и белков) в состав рибосом входят также некоторые низкомолекулярные компоненты. Это молекулы воды, ионы металлов (главным образом Mg2+ — до 2 % сухой массы рибосомы), ди- и полиамины (такие как путресцин, кадаверин, спермидин, спермин — могут составлять до 2,5 % сухой массы рибосомы).
Механизм трансляции
Основная статья: Трансляция (биология)
Трансляция — синтез белка рибосомой на основе информации, записанной в матричной РНК (мРНК). У прокариот мРНК связывается с малой субъединицей рибосомы в результате взаимодействия 3′-конца 16S рРНК с комплементарной ему последовательностью Шайн — Дальгарно 5′-конца мРНК (для связывания малой субъединицы эукариотической рибосомы помимо специфического мотива в нуклеотидной последовательности мРНК, необходимо также наличие кэп-структуры на её 5′-конце). Далее происходит позиционирование стартового кодона (как правило, AUG) мРНК на малой субъединице. Дальнейшая ассоциация малой и большой субъединиц происходит при связывании инициаторной тРНК (у прокариот — это формилметионил-тРНК, обозначаемая как fMet-тРНКfMet) и при участии факторов инициации (IF1, IF2 и IF3 у прокариот; в случае эукариотических рибосом в инициации трансляции участвуют аналоги прокариотических факторов, а также дополнительные факторы). Таким образом, распознавание антикодона (в тРНК) происходит на малой субъединице.
После ассоциации, fMet-тРНКfMet находится в P- (peptidyl-) сайте каталитического (пептидилтрансферазного) центра рибосомы. Следующая тРНК, несущая на 3′-конце аминокислоту и комплементарная второму кодону на мРНК, находясь в комплексе с заряженным (GTP) фактором элонгации EF-Tu, поступает в А- (aminoacyl-) сайт рибосомы. Затем, образуется пептидная связь между формилметионином (связанным с тРНКfMet, находящейся в Р-сайте) и аминокислотой, принесённой тРНК, находящейся в А-сайте. Механизм катализа реакции транспептидации (образования пептидной связи в пептидилтрансферазном центре) до сих пор полностью не выяснен. Существует несколько гипотез, объясняющих детали этого процесса:
- Оптимальное позиционирование субстратов (induced fit)
- Исключение из активного центра воды, способной прервать образование пептидной цепи посредством гидролиза
- Участие нуклеотидов рРНК (таких как А2450 и А2451) в переносе протона
- Участие 2′-гидроксильной группы 3′-концевого нуклеотида тРНК (А76) в переносе протона
Вероятно, высокая эффективность катализа достигается сочетанием этих факторов.
После образования пептидной связи, полипептид оказывается связанным с тРНК, находящейся в А-сайте. На следующем этапе деацилированная тРНКfMet сдвигается из Р-сайта в Е-сайт (exit-), пептидил-тРНК — из А-сайта в Р-сайт, а мРНК продвигается на один триплет нуклеотидов (кодон). Этот процесс называется транслокацией и происходит с затратой энергии (GTP) при участии фактора EF-G.
Далее, тРНК, комплементарная следующему кодону мРНК, связывается с освободившимся А-сайтом рибосомы, что ведёт к повторению описанных шагов, а образуемый полипептид удлинняется на один аминокислотный остаток с каждым циклом. Стоп-кодоны (UGA, UAG и UAA) сигнализируют об окончании трансляции. Процесс окончания трансляции и освобождения готового полипетида, рибосомы и мРНК называется терминацией. У прокариот он происходит при участии факторов терминации RF1, RF2, RF3 и RRF.
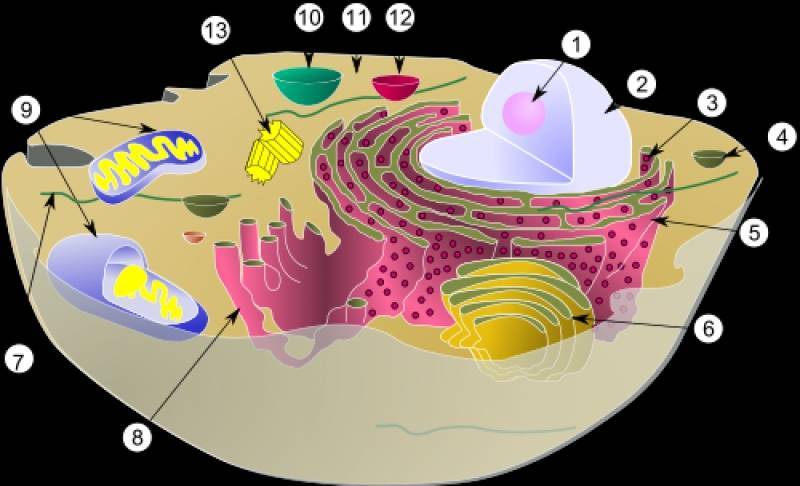
История исследований рибосомы
Схема, показывающая цитоплазму, вместе с её компонентами (или органеллами), в типичной животной клетке. Органеллы:
(1) Ядрышко
(2) Ядро
(3) рибосома (маленькие точки)
(4) Везикула
(5) шероховатый эндоплазматический ретикулум (ER)
(6) Аппарат Гольджи
(7) Цитоскелет
(8) Гладкий эндоплазматический ретикулум
(9) Митохондрия
(10) Вакуоль
(11) Цитоплазма
(12) Лизосома
(13) Центриоль и Центросома
Рибосомы впервые были описаны как уплотнённые частицы, или гранулы, американским клеточным биологом румынского происхождения Джорджем Паладе в середине 1950-х годов. В 1974 г. Паладе, Клод и Кристиан Де Дюв получили Нобелевскую премию по физиологии и медицине «за открытия, касающиеся структурной и функциональной организации клетки».
Термин «рибосома» был предложен Ричардом Робертсом в 1958 вместо «рибонуклеопротеидная частица микросомальной фракции» на первом симпозиуме, посвящённом этим частицам и их роли в биосинтезе белка. Биохимические и мутационные исследования рибосомы начиная с 1960-х позволили описать многие функциональные и структурные особенности рибосомы.
В начале 2000-х были построены модели с атомным разрешением (до 2,4 Å) структур отдельных субъединиц, а также полной прокариотической рибосомы, связанной с различными субстратами, которые позволили понять механизм декодинга (распознавания антикодона тРНК, комплементарного кодону мРНК) и детали взаимодействий между рибосомой, тРНК, мРНК, факторами трансляции, а также различными антибиотиками. Это крупнейшее достижение в молекулярной биологии было отмечено Нобелевской премией по химии 2009 года («За исследования структуры и функций рибосомы»). Награды были удостоены американец Томас Стейц, британец индийского происхождения Венкатраман Рамакришнан и израильтянка Ада Йонат. В 2010 году в лаборатории Марата Юсупова была определена трехмерная структура эукариотической рибосомы.
В 2009 году канадские биохимики Константин Боков и Сергей Штейнберг из Монреальского университета, исследовав третичную структуру рибосомной РНК бактерии Escherichia coli, пришли к выводу, что рибосомы могли сформироваться в результате постепенной эволюции из очень простой маленькой молекулы РНК — «проторибосомы», способной катализировать реакцию соединения двух аминокислот. Все остальные структурные блоки рибосомы последовательно добавлялись к проторибосоме, не нарушая её структуру и постепенно повышая эффективность её работы.
Примечания
- ↑ 1 2 Спирин, 2011, с. 109
- ↑ Спирин, 2011, с. 120—121
- ↑ 1 2 Спирин, 2011, с. 110
- ↑ 1 2 3 Спирин, 2011, с. 110—111
- ↑ Спирин, 2011, с. 133—134
- ↑ Спирин, 2011, с. 136—137
- ↑ Спирин, 2011, с. 84—85
- ↑ 1 2 Спирин, 2011, с. 84
- ↑ Sievers A, Beringer M, Rodnina MV, Wolfenden R. The ribosome as an entropy trap. Proc Natl Acad Sci U S A. 2004 May 25;101(21):7897-901.
- ↑ T.M. Schmeing, K.S. Huang, S.A. Strobel and T.A. Steitz, An induced-fit mechanism to promote peptide bond formation and exclude hydrolysis of peptidyl-tRNA. Nature 438 (2005), pp. 520—524.
- ↑ A.E. Hesslein, V.I. Katunin, M. Beringer, A.B. Kosek, M.V. Rodnina and S.A. Strobel, Exploration of the conserved A+C wobble pair within the ribosomal peptidyl transferase center using affinity purified mutant ribosomes, Nucleic Acids Res. 32 (2004), pp. 3760-3770.
- ↑ P. Nissen, J. Hansen, N. Ban, P.B. Moore and T.A. Steitz, The structural basis of ribosome activity in peptide bond synthesis, Science 289 (2000), pp. 920—930.
- ↑ T.M. Schmeing, K.S. Huang, D.E. Kitchen, S.A. Strobel and T.A. Steitz, Structural insights into the roles of water and the 2′ hydroxyl of the P site tRNA in the peptidyl transferase reaction, Mol. Cell 20 (2005), pp. 437—448
- ↑ G.E. Palade. (1955) «A small particulate component of the cytoplasm.» J Biophys Biochem Cytol. Jan;1(1): pages 59-68. PMID 14381428
- ↑ Roberts, R. B., editor. (1958) «Introduction» in Microsomal Particles and Protein Synthesis. New York: Pergamon Press, Inc.
- ↑ Ben-Shem A., Jenner L., Yusupova G., Yusupov M. «Crystal structure of the eukaryotic ribosome.» // Science. 2010. V. 330. P. 1203-1209.
- ↑ Konstantin Bokov, Sergey V. Steinberg. «A hierarchical model for evolution of 23S ribosomal RNA» // Nature. 2009. V. 457. P. 977—980.
Ошибка в сносках?: Invalid <ref> tag; name «s109» defined multiple times with different content
Ошибка в сносках?: Invalid <ref> tag; name «s110» defined multiple times with different content
Ошибка в сносках?: Invalid <ref> tag; name «s110-111» defined multiple times with different content
Ошибка в сносках?: Invalid <ref> tag; name «s110-111» defined multiple times with different content
Ошибка в сносках?: Invalid <ref> tag; name «s84» defined multiple times with different content
Литература
Спирин А. С. Молекулярная биология. Рибосомы и биосинтез белка / Рецензенты: акад. РАН, д-р хим. наук, проф. Богданов А. А.; чл.-кор. РАН, д-р хим. наук Цетлин В. И.; ред. Пирогова И. В.; тех. ред. Крайнова О. Н.; комп. верстка Никитина Г. Ю.; кор. Петрова Г. Н.. — изд. (2). — М.: «Академия», 2011. — 496 + 16 (цв. илл.) с. — (Высшее профессиональное образование). — 1000 экз. — ISBN 978-5-7695-6668-4.
Ссылки
- «Тайна происхождения рибосом разгадана?», Александр Марков, 27.02.2009
- Сайт одного из ведущих учёных по исследованию структуры рибосом, содержит большое количество иллюстраций, в том числе анимированных (англ.)
| Органеллы эукариотической клетки | |
|---|---|
| Эндомембранная система | Клеточная мембрана · Ядро · Эндоплазматический ретикулум · Аппарат Гольджи · Парентесома · Аутофагосома · Везикулы ( Экзосомы · Лизосома · Эндосома · Фагосома · Вакуоль · Акросома) · Цитоплазматические гранулы (Меланосома · Микротельца* · Глиоксисома · Пероксисома · Тельце Воронина · Тельца Вейбеля — Паладе) |
| Цитоскелет | Микрофиламенты · Промежуточные филаменты · Микротрубочки · Центр организации микротрубочек (Клеточный центр · Центриоль · Кинетосома · Полярное тельце веретена) · Миофибриллы |
| Эндосимбионты | Митохондрия · Пластиды (Хлоропласты · Хромопласты · Геронтопласты · Лейкопласты · Амилопласты · Элайопласты · Протеинопласты · Танносомы) |
| Другие внутренние органеллы | Рибонуклеопротеиды (Рибосома · Сплайсосома · Vault) · Протеасома |
| Внешние органеллы | Ундулиподий (Реснички · Жгутик · Аксонема · Радиальные спицы) · Клеточная стенка |
| Трансляция у бактерий | |||||
|---|---|---|---|---|---|
|
|||||
| 30S субъединица |
|
||||
| 50S субъединица |
|
||||
| Инициация |
|
||||
| Элонгация |
|
||||
| Терминация |
|
||||
| Рециклизация |
|
||||
| Антибиотики |
|
||||
рибосома, рибосома gif, рибосома строение, рибосома туралы, рибосома фото, рибосома функции, рибосома функції, рибосома це, рибосомалар, рибосомалык рнк
Рибосома Информацию О

Источник: www.turkaramamotoru.com
Клетки бактерий, сине-зеленых водорослей и актиномицетов содержат рибосомы с коэффициентом седиментации 70S. Этот коэффициент является мерой относительной плавучей плотности частиц при их центрифугировании в градиенте плотности хлористого цезия или сахарозы. Единица плавучей плотности S (сведберг) названа так в честь изобретателя ультрацентрифуги шведского ученого Т. Сведберга. Коэффициент седиментации зависит как от массы, так и от формы частицы. Молекулярная масса прокариотических рибосом составляет 2,5 мД, форма округлая со средним диаметром 25 нм. Общее количество рибосом в бактериальной клетке достигает 30 % ее сухого веса. Относительное количество белка в них в два раза меньше, чем РНК.
Рибосомы прокариотического типа с коэффициентом седиментации 70S содержатся также в хлоропластах высших растений. Однако рибосомы митохондрий, хотя и похожи на бактериальные, обладают более высокой видовой специфичностью. В частности, митохондриальные рибосомы дрожжей несколько крупнее типичных прокариотических рибосом (75S), тогда как митохондриальные рибосомы млекопитающих, наоборот, значительно меньше бактериальных (55S).
Клетки животных, растений, грибов и простейших содержат рибосомы с коэффициентом седиментации 80S. Их молекулярная масса составляет 4 мД, а средний диаметр — 30 нм. Относительное количество белка в них приблизительно равно количеству РНК. Эукариотический тип рибосом не имеет видовых различий.
Морфология рибосом
На маломувеличении электронного микроскопа (до 20 000х) рибосомы выглядят как электронно-плотные округлые частицы диаметром 25-30 нм. На большом увеличении (выше 100 000х) видно, что они разделены бороздкой на две неравные части, представляющие собой малую и большую субъединицы с соотношением масс 1:2.
В физиологических условиях рибосомы обратимо диссоциируют на субъединицы. При этом прокариотические рибосомы диссоциируют по схеме:
70S <=> 30S + 50S,
тогда как эукариотические рибосомы диссоциируют по схеме:
80S <=> 40S + 60S
Дефицит коэффициента седиментации связан с тем, что плавучая плотность рибосом зависит не только от массы субъединиц, но и от их формы.
Малая субъединица прокариотической рибосомы 30S имеет продолговатую форму, ее длина составляет 23 нм, а ширина – 12 нм. Она разделена на доли, которые называются “головка”, “тело” и “боковой выступ”. Наиболее выражена поперечная борозда, которая разделяет головку и тело. Малая субъединица эукариотической рибосомы 40S похожа на малую прокариотическую субъединицу 30S, но имеет две дополнительные детали – выступ головки со стороны, противоположной боковому выступу тела, а также раздвоенность дистального конца тела.
Большая субъединицапрокариотической рибосомы 50S диаметром 25 нм внешне идентична большой субъединице эукариотической рибосомы 60S. В большой субъединице имеются три выступа: средний выступ или “головка”, боковая доля или “ручка”, палочковидный отросток или “носик”. В целом форма большой субъединицы напоминает чайник для заварки.
Объединение субъединиц в полную рибосому происходит строго закономерным образом. При этом головки и боковые выступы малой и большой субъединиц ориентируются в одну сторону и накладываются друг на друга. Уплощенные поверхности субъединиц также взаимно дополняют друг друга в пространстве.
Химический состав рибосом
Рибосома состоит из РНК и белков, причем основные структурно-функциональные свойства этого органоида определяются рибосомальной РНК.
Прокариотические рибосомы содержат три, а эукариотические — четыре молекулы рибосомальной РНК.
Рибосомальные РНК
| Малая частица | Большая частица | |
| Прокариотическая рибосома | 16S | 23S+5S |
| Эукариотическая рибосома | 18S | 26S+5S+5,8S |
РНК малой субъединицы с коэффициентами седиментации 16S и 18S имеет от 1500 до 1800 нуклеотидных остатков. Она обладает значительной внутренней комплементарностью, за счет чего формируется около трех десятков коротких двуспиральных участков – “шпилек”, которые детерминируют форму малой субчастицы.
Длинная молекула РНК большой субъединицы с коэффициентом седиментации 18S или 26S содержит от 3000 до 4800 нуклеотидных остатков. За счет внутренней комплементарности в ней формируется более 100 двойных спиралей, которые определяют форму субъединицы.
Кроме длинной РНК, большая субъединица прокариотических и эукариотических рибосом содержит также короткую 5S РНК, состоящую из 120 нуклеотидных остатков, которая за счет внутренней комплементарности формирует Т-образную структуру с 5 спиральными участками.
Большая субъединица эукариотических рибосом содержит дополнительно 5,8S РНК. Она состоит из 160 нуклеотидных остатков и комплементарно связана с 26S РНК. Следует отметить, что 5,8S РНК большой субъединицы эукариотических рибосом гомологична 5’-концу бактериальной 23S РНК.
Таким образом, основная функция рибосомальных РНК состоит в формировании молекулярного скелета малой и большой субъединиц рибосомы.
Рибосомы содержат 50-70 различных белков, причем большинство из них представлено лишь одной молекулой. Молекулярная масса рибосомальных белков находится в пределах 10-30 кД, хотя отдельные полипептиды достигают массы 70 кД. Среди рибосомальных белков преобладают основные полипептиды, но встречаются также нейтральные и кислые белки. Малая субъединица прокариотической рибосомы содержит 20 белков, а большая – 30 белков. У эукариотических рибосом белков значительно больше: малая субъединица содержит 30 белков, а большая — 40.
Рибосомальные белки осуществляют разнообразные функции, связанные с ролью рибосомы как организатора биосинтеза белка:
· формируют участки малой и большой субъединиц;
· образуют центры связывания молекул;
· катализируют химические реакции;
· участвуют в регуляции биосинтеза белка;
Многие рибосомальные белки выполняют одновременно несколько функций.
Белоксинтезирующая система
Наследственная информация закодирована в первичной структуре ДНК, которая в эукариотических клетках сосредоточена в клеточном ядре. Участки ДНК, кодирующие первичную структуру полипептида – структурные гены, являются матрицами для синтеза информационной РНК (иРНК). Процесс образования функциональных копий генов в виде иРНК называется транскрипцией.
Отредактированные в ходе сплайсинга иРНК поступают затем в цитоплазму, где связываются с рибосомами. Используя информацию, закодированную в иРНК, рибосомы синтезируют полипептид в ходе процесса, называемого трансляцией. Синтез полипептида из аминокислот осуществляется в соответствии с генетическим кодом, который представляет собой правила соответствия аминокислот триплетам нуклеотидов в иРНК (кодонам).
Кроме иРНК и рибосом для осуществления трансляции необходим еще ряд других молекул. Рибосомы совместно с молекулами, принимающими участие в трансляции, образуют белоксинтезирующую систему, которая может функционировать вне клетки. Составы минимальной и полной бесклеточной систем трансляции на прокариотических рибосомах представлены в следующей таблице.
Источник: cyberpedia.su