Как связано строение митохондрий с клеточным дыханием
Наверное, у каждого, кто начинает знакомиться с удивительной организацией наших клеток, возникает чувство восхищения невероятной сложностью внутриклеточного мира. Каждую секунду в миллиардах наших клеток протекают сложные и строго скоординированные процессы. И одним из таких очень важных процессов является производство в митохондриях главной энергетической молекулы — аденозинтрифосфата, или АТФ. Сегодня уже хорошо известно, что работа митохондрий очень тесно связана со здоровьем и продолжительностью жизни [1]. Митохондрии производят энергию для поддержания жизни, но при этом они же служат основными источниками активных форм кислорода, избыток которых для клеток губителен.
Энергетический обмен
Любой живой организм находится в постоянной связи с окружающей средой, непрерывно обмениваясь с ней веществом. В этом процессе можно выделить три этапа:
- поступление веществ;
- метаболизм;
- выделение конечных продуктов.
Внутриклеточный метаболизм, в свою очередь, включает в себя два типа реакций: катаболизм и анаболизм.
Катаболизм — это процесс расщепления и окисления органических молекул, приводящий к образованию тепла и энергетических молекул, АТФ. Именно за счет постоянного производства—расщепления последних съеденные нами калории направляются «по адресу»: гидролиз двух высокоэнергетических (макроэргических) связей в молекулах АТФ обеспечивает энергией всевозможные синтетические и транспортные процессы в клетках.
На первом этапе катаболизма под воздействием пищеварительных ферментов сложные органические соединения (белки, полисахариды, жиры) распадаются на более простые — аминокислоты, моносахариды, жирные кислоты и глицерин, — которые клетка использует для реакций анаболизма (пластического обмена) и получения энергии. Аминокислоты идут на синтез белков. Жирные кислоты выполняют энергетическую функцию, входят в состав клеточных мембран и служат субстратом для синтеза эйкозаноидов
На втором этапе происходит гликолиз — расщепление молекул глюкозы (рис. 1) до пировиноградной кислоты (ПВК). Дальнейший ход реакций зависит от присутствия или отсутствия кислорода в клетке. Если кислорода нет (анаэробный процесс), то ПВК у микроорганизмов и растений будет превращаться в этанол, а в организме животных — в молочную кислоту [2]. Каждый, кто подвергал себя тяжелым физическим нагрузкам, мог почувствовать конечный результат анаэробного метаболизма в виде боли и скованности в мышцах из-за скопившейся в них молочной кислоты.
Если же кислород в клетке есть, ПВК будет расщепляться на углекислый газ и воду и тоже высвобождать заключенную в углеводной молекуле энергию. Этот процесс называется аэробным клеточным дыханием и проходит в специальных органеллах — митохондриях. Окисление в митохондриях дает гораздо больше энергии, чем гликолиз.
Митохондрии и производство АТФ
Митохондрии — настоящее биологическое чудо, сотворенное эволюцией. Несмотря на очень маленький размер (в одной клетке может быть более 1000 митохондрий), эти органеллы поражают чрезвычайно сложной организацией (рис. 2). Они представляют собой вытянутые «пузырьки», окруженные двумя мембранами. Считается, что митохондрии сформировались в результате поглощения археями-фагоцитами пурпурных фотосинтезирующих бактерий, которые, приспосабливаясь к избытку кислорода, освоили аэробное дыхание [3], [4]. Мембраны митохондрий состоят из липидов и гидрофобных, нерастворимых в воде белков. (Здесь мы так подробно описываем строение митохондрий не случайно, а для того чтобы потом было понятно, как их нормальная работа и дисфункция влияют на здоровье.)
Строение мембран очень важно для процесса дыхания. Внешняя мембрана митохондрий — гладкая, а внутренняя — многократно складчатая. Эти складки (или кристы) позволяют увеличить рабочую площадь мембраны, что необходимо для размещения там всего комплекса белков, осуществляющих дыхание.
ачале окисляются углеродные атомы углеводов, жирных кислот и аминокислот до СО2 (гликолиз, цикл Кребса и β-окисление жирных кислот), а полученные таким образом электроны используются для образования НАДФ. Далее НАДФ окисляется молекулярным кислородом с образованием воды. НАДФ-оксидазная реакция сопровождается выделением очень большого количества свободной энергии (около 1,1 эВ при переносе одного электрона с НАДФ на кислород), которая может запасаться дыхательной цепью в виде трансмембранной разности электрохимических потенциалов ионов H+ (протонов).
Работа же дыхательных белков-ферментов похожа на работу насосов: передавая электроны друг другу, они перекачивают протоны в межмембранное пространство (см. видео 1). В результате внутренняя мембрана митохондрии заряжается подобно конденсатору. Создаются потенциалы: электрический (положительные заряды — снаружи митохондриальной мембраны, отрицательные — внутри органеллы) и химический (возникает разница концентраций протонов: внутри митохондрии их меньше, снаружи — больше). Известно, что электрический потенциал на мембране митохондрий, которая служит хорошим диэлектриком, достигает 200 мВ при толщине мембраны всего 10 нм [5]. Для сравнения: потенциал действия на мембранах нервных клеток при передаче сигнала достигает всего 30 мВ.
Накопившись в межмембранном пространстве, протоны, подобно электрическому току, устремляются назад, в митохондрию — туда, где их концентрация ниже. Однако они могут проходить только по специальным каналам АТФ-синтазы, встроенной во внутреннюю мембрану: протонный канал (ротор) этого фермента закреплен в мембране, а каталитический комплекс торчит внутрь митохондрии, в матрикс (рис. 3). Поток протонов раскручивает ротор, как река водяную мельницу. В результате ротор вращается с невероятной скоростью — 300 оборотов в секунду (см. видео 2)! И именно это вращение приводит к образованию высокоэнергетической молекулы — АТФ [6]. Подсчитано, что в сутки в организме взрослого человека синтезируется и расходуется около 40 кг АТФ, при этом жизнь каждой молекулы очень коротка.
Всё вышесказанное имеет самое непосредственное отношение к старению. Дело в том, что в процессе дыхания ферменты работают не совсем «чисто», и в результате образуются побочные продукты — активные формы кислорода (АФК). Пока человек молод и здоров, образующиеся в митохондриях АФК не представляют для него ощутимой угрозы, так как легко нейтрализуются организмом. Но когда человек стареет, ведет нездоровый образ жизни или имеет генетическую предрасположенность к определенным болезням, его защитные системы дают сбой, рушась одна за другой.
Жирные кислоты и дисфункция митохондрий
То, что старение и возрастные патологии сопровождаются дисфункцией митохондрий, которые начинают производить меньше АТФ и хуже обновляться, уже ни у кого не вызывает сомнения. Выяснилось также, что дисфункция митохондрий и старение тесным образом связаны с повышением уровня свободных жирных кислот в крови [7], чему сильно способствуют малоподвижность и нерациональное питание. Жирные кислоты, попадая в клетку, способны напрямую снижать синтез АТФ, разобщая окисление и фосфорилирование. Этот связанный с терморегуляцией организма феномен был открыт еще шесть десятилетий назад академиком Скулачевым и его коллегами [8]. Снижение синтеза АТФ, в свою очередь, запускает сразу несколько негативных цепных реакций, связанных с возрастными болезнями и старением в целом.
И вот что происходит. Повышение уровня свободных жирных кислот в организме приводит к резистентности к инсулину: инсулинзависимые клетки перестанут реагировать на этот гормон. В результате нарушается усвоение глюкозы и жирных кислот, ухудшается окисление последних. Дело в том, что характерный для состояния инсулинорезистентности высокий уровень инсулина активирует целый каскад реакций, который блокирует работу фермента карнитинпальмитоилтрансферазы I (СРT1), участвующего в переносе жирных кислот внутрь митохондрий [9]. Из-за этого ухудшается синтез АТФ, а жирные кислоты накапливаются в цитоплазме клеток, вызывая эффект липотоксичности. Кроме резистентности к инсулину, избыток жирных кислот в организме вызывает резистентность к еще одному «пищевому» гормону — лептину. А из-за этого страдает функция одного из главных участников биогенеза (обновления) митохондрий — коактиватора рецептора гамма, активируемого пролифераторами пероксисом (PGC-1α). В итоге митохондрии производят меньше АТФ, стареют, погибают и провоцируют гибель клеток путем апоптоза [10].
Ну и наконец, избыток жирных кислот вызывает стресс эндоплазматического ретикулума (ЭПР) — внутриклеточного органоида, участвующего в синтезе белков и множестве других процессов. При стрессе ЭПР в цитоплазму высвобождаются ионы кальция, способные вызывать дисфункцию и гибель митохондрий [11]. Ионы кальция могут накапливаться в клетке и по другой причине — из-за ухудшения работы ионных насосов, откачивающих кальций из клетки. А причиной этому служит нарушение работы митохондрий, сопровождающееся снижением синтеза АТФ, без которого отказываются работать ионные насосы. В итоге формируется порочный круг: снижение выработки АТФ приводит к дисфункции митохондрий, что еще больше снижает выработку АТФ, и т.д.
Жирные кислоты, церамиды и повреждения нейронов
Как выяснилось, избыток жирных кислот и дисфункция митохондрий напрямую связаны с возникновением возрастных нейродегенеративных патологий. Надо сказать, что клетки нервной системы — самые уязвимые для возрастного окислительного стресса и снижения синтеза АТФ. Такая исключительная чувствительность нейронов к дефициту энергии и повышению генерации АФК объясняется несколькими причинами.
Во-первых, нервная ткань в силу своей физиологии нуждается в наибольшем потреблении кислорода. Вследствие этого в митохондриях нейронов происходит интенсивный окислительный метаболизм, который и становится основной причиной повышенной генерации АФК.
Во-вторых, из-за того, что мембраны нейронов содержат много ненасыщенных жирных кислот, они легко подвергаются перекисному окислению липидов. Так как активность антиоксидантных систем в ткани головного мозга ниже, чем в других органах, а с возрастом сокращается и количество некоторых ферментов-антиоксидантов, становится понятным, почему клетки нервной системы наиболее чувствительны к окислительным повреждениям [12].
В настоящее время известно несколько факторов, повреждающих нейроны. Среди них — белки, образующие внутри- и внеклеточные агрегаты (β-амилоидный белок и другие), а также церамиды и липофусцин. На их количество влияет прежде всего избыток жирных кислот в организме. Отягчающим обстоятельством в этом случае выступает чрезмерное содержание насыщенных кислот (пальмитиновой и стеариновой) в пищевом рационе. Всё это вместе служит мощным стимулом развития разнообразных нейродегенеративных заболеваний, таких как болезнь Альцгеймера [13], [14].
Но каким же образом пальмитиновая кислота может способствовать нейродегенерации? Установлено, что из-за избытка этой кислоты накапливаются церамиды, которые участвуют в регуляции терминальной дифференцировки, пролиферации и апоптоза нейронов.
средством нескольких химических реакций они воздействуют на регуляторы клеточного цикла, повышая концентрацию ингибиторов киназ p21/SDI1 и p27/KIP1. Таким образом церамиды останавливают клеточный цикл, что, в свою очередь, активирует главного «стража генома» — белок р53 — и «насылает» на клетку апоптоз [15]. Кроме этого, при деградации церамида образуется вещество сфингозин, обладающее цитотоксическим действием и способное вызывать как апоптоз, так и некроз клеток. Но и это еще не всё. Обнаружено, что накопление насыщенных жирных кислот (пальмитиновой и стеариновой) стимулирует специальные клетки головного мозга (астроглию) на эндогенный (внутренний) синтез церамидов. Эти произведенные церамиды запускают цепную реакцию следующего вида: церамиды → повышение секреции провоспалительных цитокинов и оксида азота → увеличение производства АФК и окислительный стресс → активация стресс-регулируемых киназ (CDK5 и GSK-3) в нейронах → образование β-амилоидного белка и гиперфосфорилирование τ-белка [16].
Нейродегенеративные патологии и дисфункция митохондрий
Сегодня важнейшими и самыми распространенными нейродегенеративными патологиями считают болезни Альцгеймера, Паркинсона, Хантингтона, а также боковой амиотрофический склероз. Их возникновение связывают со структурными изменениями различных белков, приводящими к образованию внутриклеточных агрегатов. К таким белкам относятся:
- предшественник β-амилоида, пресенилины 1 и 2 (болезнь Альцгеймера);
- τ-белок, α-синуклеин, паркин (болезнь Паркинсона);
- хантингтин (болезнь Хантингтона);
- супероксиддисмутаза-1 (боковой амиотрофический склероз);
- убиквитин и др.
Болезнь Альцгеймера (БА) — тяжелое нейродегенеративное заболевание, для которого характерны синаптическая дисфункция и гибель нейронов, что сопровождается снижением когнитивных способностей: ухудшением памяти и мышления, постепенной потерей социальных и моторных навыков [17]. В зоне риска развития болезни находятся в основном пожилые люди. Лишь 1–2% людей в возрасте до 65 лет страдают БА. Согласно одной из гипотез развития БА — амилоидной, — болезнь возникает из-за накопления в головном мозге агрегатов β-амилоида. Этот пептид состоит из 39–43 аминокислотных остатков и является фрагментом крупного трансмембранного белка под названием предшественник бета-амилоида (amyloid precursor protein, APP). Находясь в избытке, молекулы β-амилоида начинают «склеиваться» и образовывать нерастворимые бляшки (рис. 4). Именно в таком состоянии белок нарушает работу нервных клеток и вызывает симптомы БА. У страдающих БА в пораженных участках мозга находят большое количество амилоидных бляшек и нейрофибриллярных клубков [18].
Однако амилоидная гипотеза — не единственная, объясняющая возникновение БА. В 1993 году Аллен Роузес, профессор Университета Дьюка, предложил еще одну гипотезу возникновения БА — генетическую, связанную с геном APOE, кодирующим аполипопротеин Е (ApoE). Выяснилось, что наследование одного из вариантов гена APOE — APOE4 — в несколько раз повышает шансы заболеть БА. Всё больше исследователей склоняются к мысли, что β-амилоид излишне «демонизирован» и не является первопричиной развития БА. Неудавшаяся терапия, направленная на очистку клеток от β-амилоида, подтверждает, что с этой болезнью не всё до конца ясно [19].
Болезнь Паркинсона (БП) — еще одно тяжелое и довольно распространенное возрастное нейродегенеративное заболевание. У больных БП в нейронах черной субстанции накапливается α-синуклеин, который образует особые гранулы — тельца Леви. Надо сказать, что существует так называемая деменция с тельцами Леви, для которой характерно скопление многочисленных телец Леви в кортикальных и субкортикальных нейронах и развитие прогрессирующего когнитивного расстройства уже в первый год заболевания. Но пока не совсем ясно, считать ли эту деменцию формой БП или же правильнее ее рассматривать как отдельное заболевание. В случае БП скопления телец Леви приводят к дисфункции нейронов и их гибели, при этом характерно поражение областей мозга из состава так называемого нигростриарного дофаминового пути. Этот путь регулирует двигательную активность, снижая напряжение в мышцах. Вот почему, когда гибнут дофаминовые нейроны, у больных возникают соответствующие симптомы: нарастающее повышение мышечного тонуса и дрожание рук. Кроме нарушения моторных функций для БП характерны и другие симптомы, связанные с нарушением сна, депрессией, тревогой, ухудшением зрения и замедлением мышления [20].
Болезнь Хантингтона (БХ) — тоже не слишком редкое нейродегенеративное заболевание [21]. Как и в случае болезни Альцгеймера, для патогенеза БХ характерно образование токсичных белковых агрегатов с участием мутантных форм белков, которые синтезируются в нервной ткани. Но если к основному «виновнику» БА, β-амилоиду, у ученых есть вопросы, в случае с БХ сомнений гораздо меньше. Установлено, что именно генетические особенности — полиморфизмы определенных участков ДНК — приводят к появлению патологических форм белка хантингтина. Такой хантингтин способен к ассоциации с другими белками нервной ткани, в результате чего образуются нерастворимые токсичные агрегаты, повреждающие кору и полосатое тело головного мозга. Для БХ типичны всплески непроизвольной двигательной активности, эмоциональные расстройства и потеря памяти. В то же время нормальная физиологическая функция белка хантингтина в организме остается под вопросом. Предполагают, что он играет какую-то роль в эмбриогенезе [22].
Все три упомянутые патологии самым тесным образом связаны с дисфункцией митохондрий. Прежде всего, надо отметить, что ее развитие под действием дефектных белков, специфичных для нейропатологий, было установлено несколькими способами: in vitro (на клеточных линиях и внеклеточных системах) и in vivo (на трансгенных животных). Обнаружили и обратную связь: оказалось, что дисфункция митохондрий может стимулировать появление дефектных белков. Так, нарушение активности дыхательного комплекса I ведет к накоплению в нервных клетках гиперфосфорилированного τ-белка и α-синуклеина [23].
Со скоплением дефектных белков связали и уже упоминавшийся стресс эндоплазматического ретикулума. Один из таких белков, α-синуклеин, может снижать активность протеасом, что заканчивается стрессом ЭПР, увеличением производства АФК и инициацией апоптозных процессов. Это происходит потому, что из митохондрий высвобождается апоптозный фактор, цитохром С, который активирует «клеточных убийц» — каспазу-9 и каспазу-3 [24]. Как полагают, на начальных этапах нейродегенерации при БА накопление β-амилоида и гиперфосфорилирование τ-белка могут быть физиологическими механизмами защиты клетки от окислительного стресса, вызванного прогрессирующей митохондриальной дисфункцией. Однако при избыточном накоплении этих белков в клетке происходит сбой в работе митохондрий. Так, у пациентов с БА обнаружили, что β-амилоид накапливается в митохондриях и нарушает реакции гликолиза и цикла Кребса, активизирует продукцию АФК. Более того, β-амилоид способен напрямую подавлять синтез АТФ. Это возможно из-за структурного сходства белка с естественным ингибитором F(1)-субъединицы АТФ-синтазы митохондрий. Также β-амилоид может взаимодействовать с митохондриальной мембраной, формируя стабильные комплексы с двумя транслоказами, TOM40 и TIM23. Такие комплексы подавляют импорт в митохондрии белков, кодируемых ядерным геномом, — субъединиц IV и Vb цитохромоксидазы. На что органелла откликается увеличением производства агрессивного пероксида водорода.
Но и это еще не всё: белок — предшественник β-амилоида может формировать поры в мембранах митохондрий и других органелл, что нарушает ионный баланс в клетке и запускает ее апоптоз [25]. Также этот белок повышает активность фосфолипазы D, в результате изменяя фосфолипидный состав митохондриальных мембран, увеличивая концентрацию фосфатидилхолина, фосфатидилэтаноламина и фосфатидной кислоты и нарушая работу мембран. Известно, что β-амилоид может связывать гем, а это ведет к дефициту гема в клетке, из-за чего нарушается работа гем-содержащего IV комплекса электронтранспортной цепи митохондрий [26].
Но не только β-амилоид способен негативно влиять на митохондрии. В экспериментах с трансгенными грызунами, экспрессирующими ген хантингтина человека, обнаружили агрегацию этого белка в митохондриях с последующим развитием их дисфункции. Другой «зловредный» белок, α-синуклеин, накапливаясь во внутренней митохондриальной мембране, способен снижать активность дыхательного комплекса I. Как следствие, митохондрии увеличивают продукцию АФК [27]. Также обнаружено, что α-синуклеин, взаимодействуя с митохондриями, может стимулировать высвобождение из них цитохрома С, а значит, инициировать апоптоз.
В целом, можно сказать, что запуск апоптоза — характерный эффект белков, вызывающих нейродегенерацию. Они могут прямо или косвенно воздействовать на регуляторные белки, связанные с апоптозом: p53, Akt, Bad, Bax, Bcl-x(L) и кальцинейрин [28].
Также описано, что сверхсинтез белка — предшественника β-амилоида приводит к повреждению системы слияния—деления митохондрий. Негативно влияют на эту же систему и на утилизацию дефектных митохондрий аутофагосомами мутации гена паркина (PARK2), обнаруженные у больных БП. Дефектные формы τ-белка и хантингтина тоже мешают нормальной работе митохондрий, ухудшая тем самым энергообеспечение отростков нервных клеток и синаптическую передачу, вызывая дегенерацию синапсов [29].
Таким образом, белки, участвующие в развитии нейродегенеративных патологий, могут способствовать митохондриальной дисфункции посредством целого ряда механизмов. В свою очередь, уже возникшая дисфункция может усугублять патологические процессы, стимулируя появление дефектных белков и замыкая тем самым порочный круг развития болезни.
Эффект Варбурга
И напоследок стόит коснуться еще одного момента, связанного с патологиями и изменением клеточного метаболизма. В 1926 году немецкий биохимик Отто Варбург сравнил скорости образования молочной кислоты (лактата) в нормальных и опухолевых клетках. Оказалось, что опухолевые клетки потребляют очень много глюкозы, образуя при этом лактат. И делают это они гораздо быстрее, чем нормальные клетки: злокачественная ткань в эксперименте производила молочную кислоту в восемь раз активнее, чем это происходит в мышце, выполняющей физическую работу. Варбург установил, что раковые клетки используют гликолиз для получения энергии вне зависимости от доступности кислорода (рис. 5) [30]. В честь первооткрывателя этот феномен назвали эффектом Варбурга [2].
Обнаружив этот эффект, Варбург логично предположил, что его можно объяснить дисфункцией митохондрий в опухолевых клетках и нарушением окислительного фосфорилирования. Сегодня эта точка зрения ставится под сомнение, так как и в перерожденной ткани обнаруживают большое количество нормально работающих митохондрий. Около половины всей энергии опухолевые клетки получают из молекул АТФ, произведенных в митохондриях [31]. Эффект Варбурга проявляется в клетках уже в самом начале их трансформации в опухолевые. И это дает возможность проводить раннюю диагностику неопластических процессов: как только клетка начала расходовать глюкозу в повышенных масштабах, пора бить тревогу. Обнаружить эти процессы можно с помощью позитронно-эмиссионной томографии с использованием фторированного аналога глюкозы, 2-(18F)-2-дезокси-D-глюкозы.
Но зачем раковые клетки переходят на анаэробный гликолиз? Сейчас считается, что так они получают преимущество, заранее подготавливаясь к «тяжелым временам» — развитию гипоксии. А кроме этого, такой способ энергообеспечения дает клеткам возможность использовать промежуточные продукты гликолиза для анаболических реакций, усиления своей антиоксидантной защиты и отражения иммунной атаки организма [32].
Таким образом, изменения в метаболизме глюкозы и появление дефектных белков и внутриклеточных агрегатов могут говорить о начале развития патологии. Своевременное выявление подобных внутриклеточных процессов может сыграть решающую роль в предупреждении и терапии самых распространенных нейродегенеративных и онкологических заболеваний. А для того чтобы это было возможным, необходимо изучать фундаментальные аспекты патологий, связанные с работой митохондрий и энергетическим обменом. Сегодня уже разработаны системы, позволяющие заглянуть «вглубь» этих заболеваний и даже провести диагностику на самой ранней стадии их развития. Подробнее об этих системах, принципах их действия и исследованиях с их использованием расскажут следующие статьи спецпроекта.
Источник: biomolecula.ru
 Каждая митохондрия состоит из наружной и внутренней мембран, между которыми находится межмембранное пространство (Рис.7). Внутренняя мембрана образует складки — кристы, обращенные внутрь митохондрии. Пространство, ограниченное внутренней мембраной, заполнено митохондриальным матриксом, — мелкозернистым материалом различной электронной плотности.
Каждая митохондрия состоит из наружной и внутренней мембран, между которыми находится межмембранное пространство (Рис.7). Внутренняя мембрана образует складки — кристы, обращенные внутрь митохондрии. Пространство, ограниченное внутренней мембраной, заполнено митохондриальным матриксом, — мелкозернистым материалом различной электронной плотности.
Рис.7.
Наружная мембрана митохондрий содержит много молекул специализированных транспортных белков (например, порин), что обеспечивает её высокую проницаемость, а также белки-рецепторы, распознающие белки, которые переносятся через обе мембраны митохондрий в особых точках их контакта – зонах слипания.
Внутренняя мембранамитохондрий образует складки – кристы, благодаря чему значительно увеличивается внутренняя поверхность митохондрий. В состав внутренней мембраны входят транспортные белки; ферменты дыхательной цепи и сукцинатдегидрогеназа; комплекс АТФ-синтетазы. На кристах имеются элементарные частицы (оксисомы, или F1-частицы), состоящие из округлой головки (9 нм) и цилиндрической ножки. Именно на них происходит сопряжение процессов окисления и фосфорилирования (АДФ → АТФ).
Чаще всего кристы располагаются перпендикулярно длинной оси митохондрий и имеют пластинчатую (ламеллярную) форму. В клетках,синтезирующих стероидные гормоны, кристы имеют вид трубочек или пузырьков — тубулярно-везикулярные кристы. В этих клетках ферменты стероидного синтеза частично локализуются на внутренней мембране митохондрий
Число и площадь крист отражает функциональную активность клеток: наибольшая площадь крист характерна, например, для митохондрий клеток сердечной мышцы, где потребность в энергии постоянно очень велика.
Митохондриальный матрикс – мелкозернистое вещество, заполняющее полость митохондрии. Матрикс содержит несколько сотен ферментов: ферменты цикла Кребса, окисления жирных кислот, белкового синтеза. Здесь иногда встречаются митохондриальные гранулы, а также локализуются митохондриальные ДНК, иРНК, тРНК, рРНКи митохондриальные рибосомы.Митохондриальные гранулы – частицы высокой электронной плотности диаметром 20-50 нм, содержащие ионы Са и Мg.
Митохондриальная ДНК имеет кольцевую форму и включает 37 генов. Генетическая информация митохондриальной ДНК обеспечивает синтез около 5-6% белков митохондрий (ферменты электрон-транспортной системы). Синтез других митохондриальных белков контролируется ДНК ядра. Наследование митохондриальной ДНК происходит только по материнской линии.
Повреждения митохондриальной ДНК в результате мутаций могут привести к развитию ряда патологий — митохондриальных цитопатий (синдромы Барта, Патерсона, МERRF (красных разорванных волокон) и др.).
ЛИЗОСОМЫ – мембранные органеллы, которые обеспечивают внутриклеточное переваривание (расщепление) макромолекул внеклеточного и внутриклеточного происхождения, и обновление компонентов клетки.
Морфологически лизосомы представляют собой округлые пузырьки, ограниченные мембраной и содержащие большое количество различных гидролаз (более 60 ферментов). Наиболее характерными ферментами лизосом являются: кислая фосфатаза (маркёр лизосом), протеазы, нуклеазы, сульфатазы, липазы, гликозидазы. Все литические ферменты лизосом представляют собой кислые гидролазы, т.е. оптимум их активности проявляется при рН≈5.
Мембрана лизосом (около 6 нм толщиной) обладает протонным насосом, вызывающим закисление среды внутри органелл, обеспечивает диффузию низкомолекулярных продуктов переваривания макромолекул в гиалоплазму и препятствует утечке литических ферментов в гиалоплазму.
Повреждение мембраны приводит к разрушению клетки вследствие самопереваривания.
Лизосомы присутствуют во всех клетках. Особенно много лизосом в тех клетках, где активно протекают процессы фагоцитоза с последующим перевариванием захваченного материала (например, в нейтрофильных гранулоцитах, макрофагах, остеокластах).
Лизосомы подразделяются на первичные (неактивные)ивторичные (активные).
Первичные лизосомы (гидролазные пузырьки) – округлые пузырьки небольшого размера (обычно около 50 нм диаметром), с мелкозернистым, гомогенным, плотным матриксом. Надежная идентификация первичных лизосом возможна только при гистохимическом выявлении характерных ферментов (кислая фосфатаза). Первичные лизосомы – неактивные структуры, еще не вступившие в процессы расщепления субстратов.
Вторичные лизосомы – органеллы, активно участвующие в процессах внутриклеточного переваривания. Диаметр вторичных лизосом обычно составляет 0.5-2 мкм, их форма и структура могут существенно варьировать в зависимости от перевариваемого субстрата, но обычно содержимое вторичных лизосом гетерогенно.
Вторичная лизосома – результат слияния первичной лизосомы с фагосомой или аутофагосомой (Рис.8).
Фаголизосома формируется путем слияния первичной лизосомы с фагосомой — мембранным пузырьком, содержащим материал, захваченный клеткой извне. Процесс разрушения этого материала называется гетерофагией. Гетерофагия играет важную роль в функции всех клеток. Особое значение гетерофагия имеет для клеток, осуществляющих защитную функцию, таких как макрофаги и нейтрофильные лейкоциты, которые захватывают и переваривают болезнетворные микроорганизмы.
Аутофаголизосома образуется при слиянии первичной лизосомы с аутофагосомой — мембранным пузырьком, содержащим собственные компоненты клетки, которые подлежат разрушению. Процесс переваривания внутриклеточного материала называется аутофагией. Аутофагия обеспечивает постоянное обновление клеточных структур благодаря перевариванию митохондрий, полисом, фрагментов мембран.

Рис.8.
Остаточные тельца – лизосомы, содержащие непереваренный материал, которые могут находиться в цитоплазме длительное время. В некоторых долгоживущих клетках (нейроны, кардиомиоциты, гепатоциты) в остаточных тельцах накапливается коричневый эндогенный пигмент липофусцин – «пигмент старения».
Дефицит лизосомальных ферментов может приводить к развитию ряда заболеваний (болезни накопления), вызванных накоплением в клетках непереваренных веществ, которые нарушают функцию клеток. Примерами могут служить: болезнь Хюрлера, при которой из-за отсутствия α-L-идуронидазы фибробласты и остеобласты накапливают дерматан сульфат, а у больных отмечаются множественные дефекты хондро- и остеогенеза и умственное отставание; болезнь Тэя-Сакса (из-за недостаточности гексозаминидазы А происходит накопление гликолипидов в нервных клетках и поражается нервная система); болезнь Гоше (вследствие наследственного дефекта глюкоцереброзидазы гликолипиды накапливаются в макрофагах и поражаются печень и селезенка) и другие.
Пероксисомы– сферические мембранные органеллы диаметром 0.05 – 1.5 мкм, с умеренно плотным гомогенным или мелкозернистым матриксом. Мелкие пероксисомы встречаются во всех клетках, а крупные пероксисомы – в гепатоцитах, макрофагах, в клетках канальцев почки. Матрикс пероксисом содержит до 50 различных ферментов, важнейшие из которых: каталаза (маркёр пероксисом), пероксидаза, оксидазы аминокислот, уратоксидаза.
У некоторых видов животных в пероксисомах выявляется более плотная кристаллическая сердцевина – нуклеоид, состоящая из уратоксидазы. В пероксисомах клеток человека нуклеотида нет, поскольку отсутствует способность метаболизировать ураты.
Функции пероксисом:
• окисление аминокислот и других субстратов;
• защита клетки от действия перекиси водорода, сильного окислителя, образующегося в результате окисления органических соединений, и оказывающего повреждающий эффект на клетку. При этом каталаза пероксисом разлагает перекись водорода на воду и кислород.
• участие в расщеплении жирных кислот;
• участие в обезвреживании ряда веществ (спирт и др.).
Нарушения активности пероксисом вызывает ряд наследственных заболеваний – пероксисомных болезней с тяжелыми нарушениями нервной системы (синдром Целльвегера и др.)

Рис.9.
Цитоскелет – сложная трехмерная сеть немембранных органелл (рис.9):
· микротрубочек;
· микрофиламентов;
· промежуточных филаментов.
Основная функция цитоскелета – опорно-двигательная:
• поддержание и изменение формы клеток;
• перемещение компонентов внутри клетки;
• транспорт веществ внутрь клетки и из клетки;
• обеспечение подвижности клетки
Микротрубочки – наиболее крупные компоненты цитоскелета. Микротрубочки – полые цилиндрические образования различной длины, с диаметром 24-25 нм, с толщиной стенки 5 нм.
 Стенка микротрубочки состоит из спирально
Стенка микротрубочки состоит из спирально
расположенных нитей – профиламентов, образованных димерами из глобулярных белковых молекул – α- и β-тубулина.
Стенка микротрубочки образована 13 субъединицами-профиламентами.
Микротрубочки могут располагаться в цитоплазме в виде отдельных элементов, в виде пучков, где они связаны тонкими поперечными мостиками, или могут частично сливаться друг с другом, образуя дуплеты (в аксонеме ресничек и жгутиков) и триплеты (в базальном тельце и центриолях.
Микротрубочки представляют собой лабильную систему, в которой сохраняется равновесие между их постоянной сборкой и диссоциацией.
Центрами организации микротрубочек (ЦОМТ) являются сателлиты – глобулярные белковые структуры, содержащиеся в базальных тельцах ресничек и клеточном центре, а также центромеры хромосом.
Функции микротрубочек:
· поддержание стабильной формы клеток, и порядка распределения её компонентов;
· обеспечение внутриклеточного транспорта, в том числе органелл, пузырьков, секреторных гранул (благодаря некоторым белкам, ассоциированным с микротрубочками);
· образование основы центриолей и ахроматинового веретена деления и обеспечение движения хромосом в процессе митоза;
· образование основы ресничек и жгутиков, а также обеспечение их движения.
Угнетение самосборки микротрубочек при действии на клетку блокаторов (колхицин и др.) вызывает гибель быстроделящихся клеток вследствие отсутствия митотического веретена деления, нарушения транспортных процессов в клетке (аксонный транспорт в нейронах, секреция), изменения форм клетки, дезорганизацию клеточных органелл (в частности, цистерн ЭПС).
Клеточный центр образован двумя полыми цилиндрическими структурами — центриолями, которые расположены под прямым углом друг к другу.
Каждая центриоль представляет собой короткий цилиндр длиной ~ 0,5 мкм и диаметром ~ 0,2 мкм, состоящий из 9 триплетов частично слившихся трубочек (А, В и С), связанных поперечными белковыми мостиками (рис.10).

Формула строения центриоли описывается как (9 × 3) + 0, так как в центральной части микротрубочки отсутствуют. Каждый триплет центриоли связан с глобулярными белковыми тельцами – сателлитами, от которых отходят микротрубочки, образующие центросферу.
Рис.10.
В неделящейся клетке выявляется одна пара центриолей – диплосома, которая располагается обычно вблизи ядра. Перед делением клетки в S-периоде интерфазы происходит дупликация центриолей: под прямым углом к каждой зрелой (материнской) центриоли пары образуется новая (дочерняя) центриоль.
В ранней профазе митоза пары центриолей расходятся к полюсам клетки и служат центрами образования микротрубочек ахроматинового веретена деления.

Реснички и жгутикиявляются выростами цитоплазмы, обладающие подвижностью. Основу ресничек и жгутиков составляет каркас из микротрубочек, называемый аксонемой (рис.11).
Длина ресничек равна 2-10 мкм, а их количество на поверхности одной клетки может составлять до нескольких сотен.
В организме человека жгутик есть только в одном типе клеток – сперматозоидах. При этом один сперматозоид имеет один жгутик длиной 50-70 мкм.
Рис.11.
Аксонемаобразована 9периферическими парами микротрубочек (микротрубочки А и В) и одной центрально расположенной парой; такое строение описывается формулой (9 × 2) + 2. Центральная пара микротрубочек окружена центральной оболочкой, от которой к периферическим дуплетам расходятся радиальные спицы. Периферические дублеты связаны друг с другом мостиками белка нексина, а от микротрубочки А к микротрубочке В соседнего дублета отходят “ручки” из белка динеина, который обладает АТФ-азной активностью, что необходимо для скольжения соседних дублетов в аксонеме, вызывающих движение (биение) ресничек и жгутиков
Мутации, вызывающих изменения белков ресничек и жгутиков, ведут к различным нарушениям функций клеток. Так, при отсутствии динеиновых ручек (синдром неподвижных ресничек, или синдром Картагенера), больные страдают хроническими заболеваниями дыхательной системы и бесплодием (вследствие неподвижности спермиев и нарушений продвижения яйцеклеток по яйцеводу).
В основании каждой реснички или жгутика лежит базальное тельце, сходное по строению с центриолью. На уровне апикального конца базального тельца микротрубочка С триплета заканчивается, тогда как микротрубочки А и В продолжаются в соответствующие микротрубочки аксонемы реснички. При развитии ресничек или жгутика базальное тельце играет роль матрицы, на которой происходит сборка компонентов аксонемы
Микрофиламенты – тонкие белковые нити диаметром 5-7 нм, расположенные в цитоплазме поодиночке, в виде сетей или упорядоченными пучками (в скелетной и сердечной мышцах). Основной белок микрофиламентов – актин – встречается в клетках как в мономерной форме (глобулярный G-актин), так и в виде полимерного фибриллярного F-актина.
Функции микрофиламентов:
• в мышечных волокнах и клетках актиновые микрофиламенты образуют упорядоченные пучки и при взаимодействии с миозиновыми филаментами обеспечивают их сокращение.
• в немышечных клетках микрофиламенты образуют кортикальную (терминальную) сеть, в которой микрофиламенты сшиты с помощью особых белков (филамин и др.). Кортикальная сеть, с одной стороны, обеспечивает поддержание формы клетки, а с другой — способствует изменениям формы плазмолеммы, обеспечивая, таким образом, функции эндо- и экзоцитоза, миграции клеток, образования псевдоподий.
• микрофиламенты тесно связаны с органеллами, транспортными пузырьками, секреторными гранулами и играют важную роль в их перемещении внутри цитоплазмы.
• микрофиламенты формируют сократимую перетяжку (срединное тельце) при цитотомии, завершающей клеточное деление.
• микрофиламенты участвуют в организации структуры межклеточных соединений (zonula adherens – поясок сцепления).
• микрофиламенты являются основой специальных выростов цитоплазмы – микроворсинок и стереоцилий.
Микроворсинки– пальцевидные выросты цитоплазмы клетки диаметром 0.1 мкм и длиной 1 мкм, основу которых образуют актиновые микрофиламенты (рис.12).
 Микроворсинки обеспечивают многократное увеличение площади поверхности клетки. На апикальной поверхности некоторых клеток, активно участвующих в процессах расщепления и всасывания веществ, имеется до несколько тысяч микроворсинок, образующих в совокупности щёточную каемку(эпителий тонкой кишки и почечных канальцев).
Микроворсинки обеспечивают многократное увеличение площади поверхности клетки. На апикальной поверхности некоторых клеток, активно участвующих в процессах расщепления и всасывания веществ, имеется до несколько тысяч микроворсинок, образующих в совокупности щёточную каемку(эпителий тонкой кишки и почечных канальцев).
Рис.12.
Основа каждой микроворсинки – пучок, содержащий около 40 микрофиламентов, расположенных вдоль её длинной оси. Микрофиламенты имеют поперечные сшивки из белков (фимбрин, виллин), и прикреплены к плазмолемме особыми белковыми мостиками (минимиозин). У основания микроворсинки микрофиламенты пучка вплетаются в терминальную сеть
Стереоцилии – длинные, иногда ветвящиеся микроворсинки, имеющие каркас из микрофиламентов. Они встречаются редко (например, в главных клетках эпителия протока придатка семенника).
Промежуточные филаменты – прочные и устойчивые белковые нити толщиной около 10 нм (что является промежуточнымзначением между толщиной микротрубочек и микрофиламентов). Промежуточные филаменты располагаются в виде трехмерных сетей в различных участках цитоплазмы, окружают ядро, участвуют в образовании межклеточных контактов (десмосом) и поддерживают форму отростков.
Главная функция промежуточных филаментов – поддерживающая и опорная.
Промежуточные филаменты в клетках различных типов различаются по своей химической природе и молекулярному весу. Выделяют 6 основных классов промежуточных филаментов
Цитокератины –промежуточные филаменты, характерные для клеток эпителия. Этот класс включает около 20 близких полипептидов (тонофиламентов). Кератиновые филаменты входят в состав десмосом и полудесмосом, участвуют в образовании рогового вещества в эпителии кожи и являются главным компонентом волос и ногтей.
Десмины – промежуточные филаменты мышечных тканей (за исключением миоцитов сосудов). Десмины играют важную роль в организации миофибрилл в мышечной ткани и обеспечении сократительной функции
Виментины – филаменты, характерные для различных клеток мезенхимного происхождения (фибробласты, макрофаги, остеобласты, эндотелий и гладкие миоциты сосудов).
Нейрофиламенты – промежуточные филаменты нейронов, которые играют важную роль в поддержании формы отростков нервных клеток.
Глиальные клетки содержат глиальный фибриллярный кислый белок и встречаются только в клетках нейроглии (астроциты, олигодендроциты).
Идентификация классов промежуточных филаментов (методами иммуноцитохимии с антителами к данному типу промежуточных филаментов) имеет большое значение в диагностике опухолей, и, следовательно, в прогнозе и выборе противоопухолевого лечения. Так, выявление различных форм кератинов свидетельствует о недифференцированных опухолях эпителиального происхождения, карциномах, аденокарциномах. Десмин является маркёром опухолей мышечного происхождения, а глиальный фибриллярный кислый белок – маркёр опухолей глиального происхождения.
ВКЛЮЧЕНИЯ
В отличие от органелл, включения цитоплазмы – непостоянные компоненты цитоплазмы, возникающие и исчезающие в зависимости от метаболического состояния клеток.
Включения подразделяются на трофические, секреторные, экскреторные и пигментные.
Трофические включения разделяются в зависимости от природы накапливаемого вещества на липидные, углеводные и белковые. Липидные включения – это капли нейтрального жира различного диаметра, которые накапливаются в цитоплазме и служат резервом энергетических субстратов, используемых клеткой. Из углеводных включений наиболее распространены гранулы гликогена (полимер глюкозы), эти включения также используются в качестве источника энергии. Примером белковых включений могут служить запасы белка вителлина в яйцеклетках животных. Они являются источником питания на ранних стадиях развития зародыша.
Секреторные включения имеют вид пузырьков, окруженные мембраной и содержащие биологически активные вещества, которые синтезируются в самой клетке, а затем выделяются (секретируются) во внешнюю среду. К таким включениям относятся секреторные гранулы, содержащие пищеварительные проферменты (зимогеновые гранулы), гормоны, медиаторы и др.
Экскреторные включения по своему строению сходны с секреторными, но в отличие от них, содержат вредные продукты метаболизма, подлежащие удалению из цитоплазмы клеток.
Пигментные включения представляют собой скопления эндогенных (синтезированных клеткой), или экзогенных (захваченных клеткой извне) окрашенных веществ — пигментов. Наиболее распространенными эндогенными пигментами являются гемоглобин, гемосидерин, билирубин, меланин, липофусцин; к экзогенным пигментам относят каротин, различные красители, пылевые частицы и др. Меланин – тёмно-коричневый пигмент, встречающийся в норме в коже, волосах, пигментной оболочке сетчатки в виде меланосом — гранул, окруженных мембраной. Липофусцин – гранулы жёлто-коричневого пигмента из продуктов лизосомного переваривания – накапливается в долгоживущих клетках (нейроны, кардиомиоциты), и поэтому его рассматривают как «пигмент старения».
ГИАЛОПЛАЗМА
Гиалоплазму называют также цитозолем, или клеточным матриксом. Гиалоплазма – сложная коллоидная система, которая может менять своё агрегатное состояние: переходить из более жидкого (золь) в более плотное (гель). Гиалоплазма состоит из гомогенного мелкозернистого вещества с низкой электронной плотностью, в которое погружены органеллы и включения. В составе гиалоплазмы – вода, белки (ферменты), нуклеиновые кислоты, полисахариды, липиды, а также неорганические вещества.
Функции гиалоплазмы:
· создание жидкой микросреды;
· метаболическая: метаболизм белков, жиров, углеводов.
III. ЯДРО. КЛЕТОЧНЫЙ ЦИКЛ. ДЕЛЕНИЕ КЛЕТКИ. КЛЕТОЧНЫЕ ПОПУЛЯЦИИ. ГИБЕЛЬ КЛЕТОК.
Ядро– важнейший компонент клетки, содержащий её генетический аппарат.
Функции ядра:
· хранение генетической информации (в молекулах ДНК, находящихся в хромосомах);
· реализация генетической информации, контролирующей различные процессы в клетке: транскрипция информационных, рибосомальных, транспортных РНК → синтетическая активность; апоптоз и т.д.);
· воспроизведение и передача генетической информации при делении клетки
В ядре неделящейся (интерфазной) клетки выявляются следующие  компоненты ядра:
компоненты ядра:
· ядерная оболочка (кариолемма);
· хроматин;
· ядрышко;
· кариоплазма.
Ядерная оболочка (кариолемма, нуклеолемма) на светооптическом уровне практически не определяется. Под электронном микроскопом обнаруживается, что она состоит из двух мембран – наружной и внутренней мембран, разделенных полостью шириной 15-40 нм – перинуклеарной цистерной.
Наружная мембранасоставляет единое целое с мембранами грЭПС: на её поверхности имеются рибосомы, а перинуклеарная цистерна сообщается с цистерной грЭПС
Внутренняя мембрана –гладкая, её интегральные белки связаны со слоем, состоящим из сети промежуточных филаментов (ламинов), — ламиной, или ядерной пластинкой. Ламина играет большую роль в поддержании формы ядра, укладке хроматина и структурной организации поровых комплексов.

В определенных точках наружная и внутренняя мембрана смыкаются, образуя ядерные поры. Ядерная пора образована двумя параллельными кольцами диаметром 80 нм, содержащих по 8 белковых гранул, от которых к центру поры тянутся фибриллы, формирующие диафрагму толщиной около 5 нм. В середине диафрагмы лежит центральная гранула. Белковые гранулы ядерной поры структурно связаны с белками ламины. Совокупность компонентов, входящих в состав ядерной поры, называется комплексом ядерной поры.
Ядерная оболочка клетки содержит 2000-4000 поровых комплексов. Число поровых комплексов возрастает с увеличением функциональной активности: в клетках с высокой синтетической активностью ядерные поры занимают до 35% поверхности кариолеммы.
Комплекс ядерной поры обеспечивает избирательный транспорт веществ между цитоплазмой и ядром. По каналу, образованному поровым комплексом, движутся мелкие водорастворимые молекулы и ионы; активно переносятся в ядро белки, синтезируемые в цитоплазме (белки с маркировкой в виде с особой последовательности аминокислот – NLS, распознаваемой рецепторами NLS в комплексе поры); из ядра в цитоплазму переносятся субъединицы рибосом.
Хроматин в интерфазной (неделящейся) клетке соответствует хромосомам и состоит из комплекса ДНК и белка. Выраженность спирализации каждой из хромосом неодинакова по длине. Соответственно, различают два вида хроматина: эухроматин и гетерохроматин.
Эухроматин соответствует участкам хромосом, которые деспирализованы и открыты для транскрипции. Эти участки не окрашиваются и не видны в световой микроскоп.
Гетерохроматин соответствует конденсированным сегментам хромосом, что делает их недоступными для транскрипции. Гетерохроматин интенсивно окрашивается основными красителями, и в световом микроскопе имеет вид мелких гранул и глыбок.
По соотношению эу- и гетерохроматина в ядре можно оценить активность процессов транскрипции, и, следовательно, синтетической функции клетки. При её повышении это соотношение изменяется в пользу эухроматина, при снижении – нарастает содержание гетерохроматина. Соотношение эухроматин-гетерохроматин может, например, служить основой для дифференциальной диагностики доброкачественных и злокачественных опухолевых клеток.
При полном подавлении функции ядра в поврежденных и гибнущих клетках, оно уменьшается в размерах и содержит только гетерохроматин. Такое явление называется кариопикнозом.
Половой хроматин (тельце Барра) – скопление гетерохроматина, соответствующее одной из пары Х-хромосом, которая в интерфазе плотно скручена и неактивна.
Выявление полового хроматина используется как диагностический тест для определения генетического женского пола, что существенно при изучении генетических аномалий и, особенно, в спортивной медицине. Обычно анализируют эпителиальные клетки слизистой оболочки полости рта, где, как и в большинстве других клеток, половой хроматин выявляется как крупная глыбка гетерохроматина, лежащая рядом с ядерной оболочки. В нейтрофильных лейкоцитах крови половой хроматин имеет вид маленькой добавочной дольки ядра («барабанной палочки»).
Упаковка хроматина в ядре
В деконденсированном состоянии длина одной молекулы (двойной спирали) ДНК, образующей одну хромосому, составляет около 5 см, а общая длина молекул ДНК в ядре – более 2 м. Такие длинные нити ДНК компактно и упорядоченно упакованы в ядре диаметром всего 5-10 мкм.
Компактная упаковка молекул ДНК осуществляется благодаря связи ДНК со специальными основными белками – гистонами.
 Начальный уровень упаковки хроматина – нуклеосома с
Начальный уровень упаковки хроматина – нуклеосома с
диаметром 11 нм.
· Нуклеосома состоит из блока, образованного комплексом из 8 молекул гистонов, на который намотана двойная нить ДНК (цепочка из 166 пар нуклеотидов).
· Нуклеосомы разделены короткими участками свободной ДНК (48 пар
оснований). Нуклеосомная нить имеет вид нитки с бусинами, где каждая бусина – нуклеосома.
· Второй уровень упаковки также обусловлен гистонами и приводит к скручиванию нуклеосомной нити (виток из 6 нуклеосом) с формированием хроматиновой фибриллы диаметром 30 нм.
· Хроматиновые фибриллы образуют петли диаметром 300 нм. При делении клетки в результате еще более компактной укладки и сверхспирализации ДНК появляются хромосомы (диаметр 700 нм), видимые под световым микроскопом.
Компактная упаковка ДНК в ядре обеспечивает упорядоченное расположение очень длинных молекул ДНК в небольшом объеме ядра, а также функциональный контроль активности генов.
Ядрышко выявляется в интерфазном ядре на светооптическом уровне как мелкая (~ 1 мкм в диаметре), плотная сферическая структура, интенсивно окрашивающееся основными красителями. Ядрышко образовано специализированными участками хромосом – ядрышковыми организаторами, на которых происходит синтез рибосомальной РНК, а также её сборка в предшественники рибосомальных субъединиц.
Компоненты ядрышка:
· Аморфный компонент, слабо окрашиваемый, представляет собой участки расположения ядрышковых организаторов: крупные петли ДНК, активно участвующих в транскрипции рибосомальной РНК;
· Фибриллярный компонент состоит из множества нитей диаметром 5-8 нм, преимущественно во внутренней части ядрышка, и представляет собой длинные молекулы рРНК (первичные транскрипты);
· Гранулярный компонентобразован скоплением плотных мелких гранулярных частиц, представляющие собой зреющие субъединицы рибосом. Рибосомальные субъединицы образуется из рРНК, синтезированной в ядрышке, и белков, синтезированных в цитоплазме.
· Фибриллярный и гранулярный компоненты ядрышка образуют ядрышковую нить – нуклеолонему, которая образует петлистую сеть, выделяющуюся большой плотностью на фоне менее плотного ядерного матрикса
Размеры и объем ядрышек увеличиваются при повышении функциональной активности клетки. Особенно крупные ядрышки характерны для эмбриональных и активно синтезирующих белки клеток, а также клеток быстрорастущих злокачественных опухолей.
Ядрышко исчезает в профазе митоза, в результате инактивации рибосомных генов при конденсации соответствующих хромосом, и вновь формируется в поздней телофазе.
Ядерный матрикс – компонент ядра, в котором располагаются хроматин и ядрышко. Ядерный матрикс образован кариоплазмой и кариоскелетом. Кариоплазма – жидкий компонент ядра, содержащий РНК, ионы, ферменты, метаболиты, растворенные в воде. Кариоскелет состоит из ламины и других фибриллярных белков.
Клеточный цикл – совокупность процессов, происходящих в клетке между двумя последовательными делениями или между её образованием и гибелью. Клеточный цикл включает в себя собственно митотическое деление и интерфазу – промежуток между делениями

Интерфаза занимает около 90% всего времени клеточного цикла и подразделяется на три периода:
· пресинтетический или постмитотический – G1 (от англ. gap – промежуток);
· синтетический – S;
· постсинтетическийилипремитотический — G2.
Пресинтетический период – G1 – характеризуется активным ростом клетки, синтезом белка и РНК, благодаря чему клетка восстанавливает необходимый набор органелл и достигает нормальных размеров. G1 период длится от нескольких часов до нескольких дней. В течение этого периода синтезируются особые «запускающие» белки – активаторы S периода. Они обеспечивают достижение клеткой точки R (точки ограничения), после которого она вступает в S-период.
Если клетка не достигает точки R, она выходит из цикла и вступает в период репродуктивного покоя (G0).Клетки некоторых тканей под влиянием определенных факторов способны возвращаться из периода G0 в клеточный цикл, клетки других тканей (кардиомиоциты, нейроны) утрачивают эту способность по мере дифференцировки. Абсолютное большинство дифференцированных клеток организма, выполняющих свои специфические функции, не делятся.
Синтетический период –S- характеризуется репликацией (удвоением содержания) ДНК, синтезом гистонов и других белков. В результате происходит удвоение числа хромосом. Одновременно удваивается число центриолей. S-период длится у большинства клеток 8-12 часов.
Постсинтетический период – G2 — длится 2-4 часа и продолжается вплоть до митоза. В течение этого периода запасается энергия, и синтезируются белки, в частности тубулины, необходимые для процесса деления.
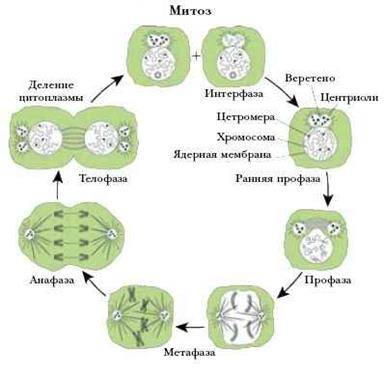
Митоз (кариокинез) является универсальным механизмом деления соматических клеток. Во время митоза родительская клетка делится, и каждая из дочерних клеток получает набор хромосом идентичный родительскому, и, таким образом, происходит равномерное распределение генетического материала. Продолжительность митоза – 1-3 часа.
Митоз условно разделяют на 4 основные фазы:

· профазу;
· метафазу;
· анафазу;
· телофазу.
Профазаначинается сконденсации хромосом, которые становятся видимыми в световой микроскоп как нитевидные структуры. Каждая хромосома состоит из двух параллельно лежащих сестринских хроматид, связанных в области центромеры. Ядерная оболочка распадается на мембранные пузырьки и исчезает к концу профазы, так же как и ядрышко. Кариоплазма смешивается с цитоплазмой. Пары центриолей расходятся к противоположным полюсам клетки и дают начало микротрубочкам митотического веретена.
В метафазе хромосомы выстраиваются в области экватора митотического веретена (в равной удаленности от центриолей противоположных полюсов), и образуют картину экваториальной (метафазной) пластинки (вид сбоку) или материнской звезды (вид со сторону полюсов). Сестринские хроматиды к концу этой фазы разделяются щелью, однако удерживаются в области центромеры.
Анафаза начинается с синхронного расщепления всех хромосом на сестринские хроматиды (в области центромеры) и движения дочерних хромосом к противоположным полюсам клеток, происходящего вдоль микротрубочек. Анафаза завершается скоплением на полюсах клетки двух идентичных наборов хромосом, которые образуют картину звезд (стадия дочерних звезд). В конце анафазы начинает образовываться клеточная перетяжка, благодаря сокращению актиновых микрофиламентов, которые концентрируются по окружности клетки.
Телофазахарактеризуется реконструкцией ядер дочерних клеток и завершением их разделения. Ядерная оболочка восстанавливается, хромосомы постепенно деспирализуются, замещаясь картиной хроматина интерфазного ядра, а в конце телофазы вновь появляется ядрышко. Углубление клеточной перетяжки завершается полной цитотомией с формированием двух дочерних клеток. При этом происходит приблизительно равное распределение органелл между дочерними клетками.
Эндомитоз – процесс увеличения числа хромосом внутри ядерной оболочки без последующего деления клетки, что приводит к повышенному содержанию ДНК в ядре – полиплоидии.
Полиплоидные ядра имеют больший объем. Полиплоидные клетки могут также возникнуть вследствие митотического деления без последующей цитотомией. При таком делении образуются двуядерные клетки с увеличенным вдвое набором хромосом. Основной смысл развития полиплоидии заключается в усилении функциональной активности клеток.
Наличие полиплоидных – тетра- (4n, если 1n – гаплоидный набор хромосом) и октаплоидных (8n) клеток – нормальное явление для гепатоцитов (клеток печени), переходного эпителия мочевого пузыря, секреторных клеток поджелудочной и слюнных желез. Уровень полиплоидизации мегакариоцитов красного костного мозга достигает – 16-32n.
По уровню обновления ткани организма подразделяются на три группы – три типа клеточных популяций:
· Обновляющиеся клеточные популяции<
Источник: poznayka.org