Стадии фагоцитоза схема
Процесс фагоцитоза подразделяется на 4 стадии:
1. Приближение к объекту фагоцитоза;
2. Прилипание фагоцита к поверхности объекта (распознавание рецепторами фагоцита опсонических детерминант объекта);
3. Погружение объекта в цитоплазму фагоцита;
4. Переваривание (или шире –киллинг-эффект, деградация объекта).
Приближениеможет быть и случайным, особенно, у фиксированных фагоцитов. Однако главным его механизмомслужит хемотаксис.
Хемотаксисом называется направленное движение живых клеток по градиенту концентрации какого-либо распознаваемого ими вещества. Вещества, привлекающие клетки, называются хемоаттрактантами. По сути дела, хемоаттрактивная чувствительность, присущая всем лейкоцитам, включая не фагоцитирующие клетки – это прообраз обоняния на одноклеточном уровне.
Хемоаттрактанты, если они имеются на поверхности выделяющего их объекта, являются в то же самое время, и опсонинами, поскольку прямая ассоциация фагоцитарного рецептора хемоаттрактанта с его лигандом обеспечивает опсонизацию, то есть способствует прилипанию и дополнению клеточного «обоняния» своего рода осязанием. Например, и хемоаттрактантами, и опсонинами служат специфические иммуноглобулины и факторы комплемента. Часть хемоаттрактантов не является опсонинами, поскольку не присутствует на поверхности мишени фагоцитоза, а лишь выделяется клетками-участниками воспаления. Таковы интерлейкины и пептидные хемотаксические факторы.
Наряду с хемотаксисом различают хемокинез – явление не направленного увеличения локомоторной активности клеток под влиянием медиаторов воспаления. Например, гистамин, действуя на Н1-рецепторы нейтрофилов и эозинофилов, активирует их подвижность, но не обязательно в направлении нарастающего градиента своей концентрации.
Фагоцитирующие клетки имеют поверхностные рецепторы хемоаттрактантов. Хемоаттрактанты могут быть экзогенными и эндогенными, специфическими для определенного вида лейкоцитов или же универсальными.
Основные группы хемоаттрактантов следующие:
> Микроорганизмы и их продукты, в частности, пентоды, содержащие М-формил-метионин – аминокислоту, инициирующую синтез любого из прокариотических белков, но не используемую трансляционной системой эукариот.
агодаря наличию у лейкоцитов рецептора к трипептиду с этой аминокислотой, они обладают аттракцией к «прокариотам вообще», то есть к той категории возбудителей, которая вызывает широчайший круг инфекционных воспалений. Некоторые липидные компоненты микробных оболочек из состава их липополисахаридов напоминают по строению арахидоновые производные и также оказывают универсальный хемоаттрактивный эффект на лейкоциты. Например, полисахариды из состава таких микроорганизмов привлекают нейтрофилы и макрофаги и напрямую связывают лейкоцитарный рецептор комплементаCR3. Это делает их продукт зимозан и препараты из данных микробов, в частности, пронермил. стимуляторами фагоцитоза и активаторами фагоцитов.
> Компоненты системы комплемента распознаются лейкоцитарными рецепторами и оказывают хемоаттрактивный и опсонизирующий эффект. На лейкоцитах – лимфоцитах, нейтрофилах, эозинофилах и макрофагах имеются несколько типов комплемент-чувствительных рецепторов. Например, рецепторCR1-типа служит для фагоцитоза иммунных комплексов.CR2является воротами для проникновения в лимфоциты, антиген-представляющие клетки и эпителий носоглотки и шейки матки вируса Эпштейна-Барр. Таким образом, он участвует в патогенезе инфекционного мононуклеоза.
> Продукты повреждения и метаболизма клеток являются хемоаттрактантами для лейкоцитов. Клетки не обмениваются готовыми макроэргическими фосфатами и не передают друг другу свои программы.
этому, значительные количества ДНК и АТФ попадают в межклеточное пространство только при разрушении клеток. Следовательно, привлеченные ими лейкоциты оказываются в эпицентре альтерации. Пуриновые рецепторы на поверхности фагоцитов позволяют им двигаться в сторону нарастания концентрации этих метаболитов. Данный эффект известен под названием некротаксиса. Хемоаттрактивными для макрофагов (и фибробластов) являются и продукты деградации внеклеточных белков: фибрина (фибрин-пептид В), коллагена, а также фибронектин и тромбин. Повреждение клеточных мембран ведет к продукции арахидоновых метаболитов, многие из которых, особенно, лейкотриен В4, а также гидроксиэйкозатетраеновые кислоты и тромбоксан А2, служат хемоаттрактантами для нейтрофилов, макрофагов и эозинофилов.
> Некоторые другие медиаторы воспаления могут быть хемоаттрактантами, в том числе, избирательными для тех или иных клеток. К ним относятся пептиды, привлекающие моноциты: нейтрофильные катионные белки, С-реактивный белок, цитокины ИЛ-1 и кахексин, тромбоцитарный фактор роста, трансформирующий фактор роста. Мастоциты выделяют хемотаксические факторы для эозинофилов (содержит лейкотриен В4), нейтрофилов и лимфоцитов. Макрофаги способны генерировать хемотаксические пептиды для нейтрофилов и базофилов, в частности, именно так действует ИЛ-8. Макрофагальные продукты (фибронектин) могут привлекать фибробласты. Фактор активации тромбоцитов (ацетилглицериновый эфир фосфохолина), выделяемый макрофагами, гранулоцитами и эндотелием, оказывает мощное хемоаттрактивное действие на все лейкоциты.
> Иммунные комплексы и иммуноглобулины, особенно классов М иG, распознаютсяFc-рецепторами лейкоцитов и оказывают хемоаттрактивный и опсонический эффект как через факторы комплемента, так и непосредственно.
Перемещение лейкоцита обеспечивается структурами цитоскелета: микрофиламентами и микротрубочками. Сопряжение функций цитоскелета и рецепции хемоаттрактанта достигается с участием ионов кальция, проникающих в эктоплазму фагоцита через каналы, которые открывают, занимая рецепторы, молекулы лиганда, а также выходящих из кальцисом. Пострецепторное сопряжение внутри фагоцита осуществляется по типичному механизму, вовлекающему систему G-белков.
Прилипание лейкоцитов к объектам фагоцитоза связано с распознаванием поверхностных детерминант мишеней рецепторами фагоцитов.
Некоторые объекты, например, многие бактерии или грибки-сахаромицеты, распознаются рецепторами экзогенных хемоаттрактантов напрямую. Определенную роль при этом могут играть рецепторы формил-метионина и таких сахаров, как манноза и фруктоза. Рецептор комплемента CR1связывает липополисахариды бактериальных клеточных стенок напрямую. Но большинство объектов фагоцитоза нуждается в опсонизации, то есть распознается только после прикрепления сывороточных факторов, к которым рецепторы фагоцитов обладают значительным аффинитетом. Сывороточные факторы, играющие при этом роль «адаптеров», называют опсонинами. Выше уже говорилось, что не все хемоаттрактанты являются опсонинами.
Наиболее активны как опсонины иммуноглобулины (G1иG2, в меньшей степени М и Е). Они распознаютсяFс- или инымиFc-рецепторами. Фактор комплемента С3bи его нестабильная формаiС3b(как при прямой активации объектами фагоцитоза, так и при активации иммуноглобулинами и иммунными комплексами) также оказывают опсониновый эффект через рецепторыCR1-CR3.
Опсонизация в несколько раз увеличивает активность прилипания, причем эффект иммуноглобулинов и комплемента аддитивен. Опсонизация – мощный усилитель фагоцитарной активности. Однако иногда и опсониновый эффект дает осечки или даже оборачивается против организма.
Термин «опсонизация» может трактоваться расширительно. Фагоцитоз фибрина, деградирующих белков соединительной ткани, нуклеопротеидов усиливается после присоединения к ним фибронектина, что, по существу, делает этот макрофагальный продукт опсонином при рассасывании тромбов, рубцов и клеточного детрита.
С-реактивный белок фактически также является ко-опсонином, так как связывает С-белок пневмококков и других микробов и опосредует прикрепление к ним факторов комплемента и фагоцитов. Сходным действием в отношении некоторых бактерий обладает лизоцим.
Активацию фагоцитов подавляют некоторые продукты бактерий («агрессины»). Так, микобактерии выделяют липоарабиноманнан, блокирующий ответ макрофагов на γ-интерферон.
При активации в фагоците происходит метаболический взрыв. При этом клетка увеличивается, в ней резко усиливается интенсивность реакций пентозного пути и гликолиза, распадается гликоген. Происходит накопление НАДФН и ГТФ, которые затем будут обеспечивать энергетически синтез АКР и работу элементов цитоскелета. Удельная теплопродукция лейкоцитов возрастает в 4-5 раз. Хотя общее потребление кислорода фагоцитом увеличивается, аэробное окисление не вносит в этот процесс решающего вклада, судя по тому, что цианиды не ингибируют метаболический взрыв и последующие события при фагоцитозе.
При активации на поверхности фагоцита появляются дополнительные молекулы клеточной адгезии и белки первого и второго классов главного комплекса гистосовместимости. Происходит экзоцитоз, в ходе которого гранулоциты подвергаются дегрануляции и освобождают медиаторы воспаления, кумулированные в гранулах. Макрофаги выделяют ИЛ-1, ИЛ-6 и кахексин, а также активаторы фибринолиза. Все фагоциты при активации синтезируют арахидоновые медиаторы воспаления. Активированные фагоциты увеличивают свою цитотоксическую, фагоцитарную и бактерицидную активность. В них начинается выработка активных кислородных радикалов.
Погружение внешне выглядит как охват объекта фагоцитоза псевдоподиями или накат фагоцита на объект. Это наводит на мысль об общности механизмов хемотаксиса и погружения. Некоторые авторы, особенно изучавшие фагоцитоз крупных частиц и клеток, уподобляют механизм погружения застегиванию молнии. При этом предполагается, что происходит последовательная ассоциация опсонических детерминант объекта с опсониновыми рецепторами фагоцита, таким образом, объект вдвигается в цитоплазму клетки. Поглощение объекта, покрытого иммуноглобулинами, происходит без дополнительных условий. При опсонизации С3b-фрагментом комплемента требуется одновременная активация фибронектинового и ламининового рецептора фагоцита внеклеточными лигандами, как если бы клетка «опиралась» на межклеточное вещество. Активация цитокиновых рецепторов фагоцита также может способствовать погружению объекта, опсонизированного С3b-фрагментом комплемента.
В результате погружения, объект оказывается в цитоплазме фагоцита, полностью окруженный фагосомой, созданной путем инвагинации и замыкания участка клеточной мембраны. Процесс создания фагосомы, видимо, имеет много общего с образованием рецептосом при рецепторном эндоцитозе, когда окаймленные ямки плазматической мембраны, содержащие белок цитоскелета клатрин, замыкаются в опушенные везикулы. При участии микрофиламентов цитоскелета и особых белков-фъюзогенов, фагосома сливается с лизосомами и специфическими гранулами фагоцита (внутренняя дегрануляция), формируя фаголизосому, где и происходит завершающая стадия фагоцитоза. Все эти процессы, как и хемотаксис, зависят от кальция, протеинкиназы С и липидных внутриклеточных посредников.
Деградация объекта фагоцитоза(по классической терминологии –переваривание) служит заключительной стадией фагоцитоза. Главную роль здесь играют частично охарактеризованные выше кислород-зависимые цитотоксические механизмы фагоцитов (галогенизация и перекисное окисление компонентов захваченных объектов с участием гипохлорита, перекиси водорода, синглетного кислорода, гидроксильных радикалов, супероксидного аниона, оксийодидов и оксида азота). Вспомогательную роль выполняют бескислородные механизмы: катионные антибиотические белки, лактоферрин, лизоцим и, возможно, мочевина.
При наследственном дефекте кодируемого Х-хромосомой мембранного компонента НАДФ-зависимой оксидазы (гетеродимера цитохрома b-558), равно как и при аутосомно-рецессивном дефекте цитозольного гетеродимерного компонента этой ферментативной системы, образование супероксида нарушается, и у детей развивается хронический гранулематоз (ХГ) – заболевание, характеризующееся иммунодефицитом, незавершенным фагоцитозом и персистированием бактериальных возбудителей в лейкоцитах. Особенно опасны для таких больных вышеупомянутые каталаза-положительные микробы, провоцирующие у них лимфадениты, гранулёмы, себоррейный дерматит, афтозный стоматит и гингивиты.
Гранулематозная болезнь, как и большинство дефектов фагоцитоза, вызвана сочетанным поражением макрофагов и гранулоцитов. Реже подобные дефекты бывают клеточно-избирательными. Например, дефект макрофагального фагоцитоза иммунных комплексов и опсонизированных ими объектов присутствует при коллагенозах, рассеянном склерозе, герпетиформном дерматите и у родственников больных этими иммунокомплексными заболеваниями. Помимо ХГ, наиболее важными в клинике являются расстройства фагоцитоза, описанные в таблице 9:
Легко заметить, что нарушения функции фагоцитов очень распространены и ответственны за многие случаи снижения иммунологической резистентности у длительно и часто болеющих пациентов, хотя каждая отдельная наследственная аномалия фагоцитов не является частым заболеванием (Таблица 9). Наследственные дефекты фагоцитоза, как правило, аутосомно-рецессивны за исключением вышеописанного варианта ХГ и дефекта глюкоза-6-фосфатдегидрогеназы, сцепленных с Х-хромосомой.
Наиболее часто (1:2000) обнаруживается миелопероксидазный дефицит нейтрофилов. Сам по себе, он не приводит к значительному иммунодефициту, но в сочетании с другими приобретенными расстройствами остальных звеньев функции фагоцитов, например, диабетом, может стать клинически значимым, в основном, из-за развития микозов.
Дефицит лейкоцитарных адгезирующих молекул вызывается дефектами, локализованными в длинном плече хромосомы 21. В нейтрофилах, лимфоцитах и макрофагах нарушается адгезия, агрегация, хемотаксис и активация лейкоцитов лимфокинами, а также снижается опсонизация фактором комплемента С3b. Грибковые и бактериальные поражения кожи, а также слизистых оболочек половых, пищеварительных и дыхательных органов сочетаются с парадоксальным лейкоцитозом, вызванным отсутствием краевого стояния. У новорожденных с этим синдромом плохо заживает пупочная ранка.
Таблица 9
Нарушение фагоцитоза
|
Нарушенная функция
|
Наследственные дефекты
|
Приобретенные дефекты
|
Лекарственная патология
|
|
Адгезия. Агрегация |
Недостаточность лейкоцитарной адгезии 1 типа (дефект β-цепи интегринов). Недостаточность лейкоцитарной адгезии 2 типа (дефект рецептора селектинов). |
Новорожденность, сахарный диабет, последствия гемодиализа. |
Глюкокортикоиды, алкоголь, аспирин, ибупрофен, пироксикам, колхицин. |
|
Пластичность |
Новорожденность, сахарный диабет, гиперрегенераторные сдвиги влево, лейкозы. |
||
|
Локомоция |
Синдром Чедиака-Хигаши (дефект микрофиламентов, дефект антигенсвязывающего белка), синдром Иова, дефицит специфических нейтрофильных гранул. |
Новорожденность, сахарный диабет, онкологические заболевания. СПИД, тяжелый комбинированный иммунодефицит, коллагенозы, голодание, грипп, герпес, синдромы Дауна и Вискотта-Олдрича, парадонтоз, дефицит α-маннозидазы, энтеропатический акродерматит, сепсис, ожоги. |
Фенилбутазон, напроксен, колхицин. Глюкокортикоиды, индометацин, интерлсйкин-2. |
|
Деградация объекта |
Синдром Чедиака-Хигаши хронический гранулёматоз (дефекты НАДФ-оксидазы) дефицит специфических нейтрофильных гранул. |
Новорожденность, сахарный диабет, сепсис, ожоги, СПИД, спленэктомия, гемоцитопении, лейкоз, голодание. |
Колхицин, циклофосфан, глюкокортикоиды. |
|
Метаболический взрыв |
Хронический гранулёматоз, дефицит пируваткиназы дефицит глюкоза-6-фосфатдегидрогеназы. |
Пеллагра. |
Колхицин, циклофосфан, глюкокортикоиды. |
|
Миелопероксидазная активность |
Дефицит миелопероксидазы (дефект миелопероксидазы). |
Острый миелоидный лейкоз. |
Колхицин, циклофосфан, глюкокортикоиды, дапсон, сульфоны. |
Синдром Иова (по имени библейского страдальца) характеризуется гиперпродукциейIgЕ и нехваткойIgAпротив различных микробов, протекает с проявлениями атонического дерматита, которые сочетаются с холодными абсцессами, кандидомикозом, рецидивирующими гнойными пневмониями. Отмечаются эозинофильный лейкоците и сниженные хемотаксис и супрессорная активность лимфоцитов. Столь парадоксальный«аллергический иммунодефицит», возможно, связан с дефектом рецепции какого-то из цитокинов. Маркером синдрома служат сколиоз и аномалии лицевого скелета.
При дефекте белков гранул страдают не только специфические гранулы нейтрофилов, но и отсутствует эозинофильное окрашивание гранулоцитов, а также функция α-гранул тромбоцитов. Поэтому расстраивается не только фагоцитоз, но и образование белого тромба, что выражается в рецидивирующих инфекциях кожи и ЛОР-органов, гипоергическом течении воспаления, замедлении заживления ран и геморрагическом синдроме.
Комплексное расстройство фагоцитоза наступает при сахарном диабете, голодании, гиперкортицизме, иммунодефицитах и сепсисе. При диабете это приводит порой к тому, что не леченный больной первоначально обращается не к эндокринологу, а к дерматологу или хирургу по поводу поражений кожи и слизистых, вызванного гноеродной флорой или грибками.
Так как тимические гормоны α-протимозин, тимопоэтин, спленопоэтин, тимусный гуморальный фактор и тимулин стимулируют фагоцитоз, состояния с нарушением функций тимуса, например, синдромы Ди-Джорджи иНезелова, сопровождаются ослаблением фагоцитоза. Дефицит цинка в диете способен нарушить производство цинк-содержащего тимулина, что отрицательно сказывается на иммунитете и фагоцитозе, в частности. У новорожденных также имеется снижение нескольких функций фагоцитов, вследствие чего для них характерен не завершенный фагоцитоз и персистирование возбудителей в фагоцитах.
Источник: StudFiles.net
Фагоцитоз — процесс поглощения, разрушения и выделения из организма патогенов.
В человеческом организме ответственными за него являются моноциты и нейтрофилы.
Процесс фагоцитоза бывает завершенным и незавершенным.
Завершенный фагоцитоз состоит из следующих стадий:
• активация фагоцитирующей клетки;
• хемотаксис или движение к фагоцитируемому объекту;
• прикрепление к данному объекту (адгезия);
• поглощение этого объекта;
• переваривание поглощенного объекта.
Незавершенный фагоцитоз прерывается на стадии поглощения, при этом патоген остается живым.

В процессе фагоцитоза образуются следующие структуры:
- фагосома – образуется после прикрепления фагоцита к объекту путем замыкания его мембраны вокруг патогена;
- фаголизосома – образуется в результате слияния фагосомы с лизосомой фагоцитирующей клетки. После ее образования начинается процесс переваривания.
Вещества из лизосомальных гранул (гидролитические ферменты, щелочная
фосфатаза, миелопероксидаза, лизоцим) могут разрушать чужеродные вещества двумя механизмами:
- кислороднезависимый механизм —осуществляется гидролитическими ферментами;
- кислородзависимый механизм — осуществляется при участии миелопероксидазы, перекиси водорода, супероксидного аниона, активного кислорода и гидроксильных радикалов.
Источник: immunitet.info
Уничтожение антигена макрофагом (фагоцитоз)
Механизмы иммунного ответа
Иммунный ответ по гуморальному типу без помощи Т-клеток
Иммунный ответ по гуморальному типу с помощью Т-хелперов
Иммунный ответ по клеточному типу (информация передается Т-хелперу)
Иммунный ответ по клеточному типу (фагоцитоз)

Фагоцитоз – это разновидность клеточного иммунитета, характеризующаяся распознаванием, поглощением и перевариванием фагоцитами различных чужеродных корпускулярных объектов.
Классификация фагоцитоза
В зависимости от нахождения клетки:
1. Внутрисосудистый
2. Тканевый
В зависимости от завершенности:
1. Завершенный
2. Незавершенный.
В зависимости от размеров фагоцитируемого объекта:
1. Истинный фагоцитоз – поглощение объектов размером 0,5 – 50 мкм,
2. Ультрафагоцитоз (размер объекта < 0,01 мкм),
3. Пиноцитоз (размер объекта < 0,001 мкм).
Классификация фагоцитов
1. По морфологическим и функциональным особенностям:
1. Микрофаги – нейтрофилы, эозинофилы, базофилы;
2. Макрофаги – моноциты крови и костного мозга, тканевые макрофаги (гистиоциты, купферовские клетки, альвеолярные, перитонеальные, плевральные, микроглиальные макрофаги, макрофаги селезенки, лимфатических узлов, костного мозга, остеокласты и др.).
2. По способности к активному передвижению:
1. Фиксированные – купферовские клетки печени, гистициты соединительной ткани, макрофаги костного мозга, лимфоузлов, синовиальных оболочек, ЦНС и др.;
2. Подвижные – макрофаги серозных полостей, воспалительных экссудатов, альвеолярные макрофаги, моноциты и др.

I – приближение фагоцита к объекту фагоцитоза;
II – аттракция;
III – поглощение объекта фагоцитом;
IV – умерщвление жизнеспособных объектов (стадия киллинга);
V – переваривание нежизнеспособных объектов.
1 стадия.Стадия приближения фагоцита к объекту фагоцитоза осуществляется за счет случайного столкновения фагоцита с чужеродным объектом в кровяном русле или направленного активного движения фагоцита к объекту фагоцитоза, которое называется положительным хемотаксисом.
Для осуществления процесса хемотаксиса необходимы следующие факторы: наличие на поверхности фагоцита рецепторов к хемоаттрактантам, энергии АТФ, способности фагоцита к активному передвижению, а также достаточного количества хемоаттрактантов.
В роли хемоаттрактантов могут выступать продукты специфических реакций в организме (компоненты комплемента – С3а, С5а, С567, лимфокины, цитофильные антитела, иммунные комплексы и др.), эндогенные неспецифические хемоаттрактанты, выделяющиеся из поврежденных или активированных клеток, в том числе из фагоцитов, (протеазы, протеиназы, эндотоксины, калликреин, плазминогенный активатор, IgG, коллаген, цАМФ и др.).
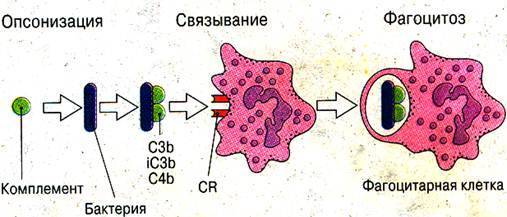
2 стадия.Стадия аттракции включает опсонизацию, распознавание и прикрепление фагоцита к объекту фагоцитоза.
Опсонизация– процесс адсорбции на поверхности чужеродного объекта опсонинов – веществ, являющихся молекулярными посредниками при взаимодействии фагоцитов с фагоцитируемым объектом. Опсонины облегчают распознавание и повышают интенсивность фагоцитоза.
Разновидности опсонинов:
1. Термолабильные опсонины (компоненты комплемента – С3в, С4в, α– и β-глобулины, коопсонин, С-реактивный белок, фибронектин и др.);
2. Термостабильные опсонины (IgG1, IgG3, IgM, агрегированные IgA1, IgA2 и др.);
3. Тафтсин – тетрапептид активного центра антител.
Распознавание фагоцитом объекта фагоцитоза осуществляется за счет наличия на поверхности фагоцита специфических (для IgG1 – 2, IgA, С3в, С4в, С5а и др.) и неспецифических рецепторов (для чужеродных химических структур).
Прикрепление фагоцита к объекту фагоцитоза обеспечивается взаимодействием рецепторов фагоцита с поверхностью чужеродного объекта и находящимися на ней опсонинами.
3 стадия.Стадия поглощения – активный энергозависимый процесс, заключающийся в последовательном охвате частицы псевдоподиями со всех сторон и погружении ее в цитоплазму фагоцита вместе с окружающим участком плазматической мембраны. Результатом стадии поглощения является формирование фагосомы, содержащей чужеродную частицу.
4 стадия.Стадия киллинга обеспечивается наличием у фагоцита факторов бактерицидности, которые выделяются в фагосому или в окружающую фагоцит среду, что может обеспечить дистантный бактерицидный эффект.
Классификация бактерицидных факторов фагоцитов.
I. Кислородзависимые:
1. Миелопероксидаза;
2. миелопероксидазнезависимые факторы – продукты «дыхательного взрыва», возникающего при активации фагоцитов (Н2О2, супероксидный анион-радикал, гидроксильный радикал, синглетный кислород, галогены и др.).
II. Кислороднезависимые:
1. Лизоцим;
2. Лактоферрин;
3. Щелочная фосфатаза;
4. Катионные белки;
5. Кислая среда фагосомы (рН до 4,5).
5 стадия.Стадия переваривания возможна только в том случае, если фагоцитируемый объект утратил жизнеспособность. Переваривание обусловлено выделением в фагосому содержимого лизосом фагоцита. Лизосомы содержат около 60 различных ферментов – гидролаз (протеазы, липазы, фосфолипазы, эластазы, коллагеназы, ДНК-азы, РНК-азы, амилазы, глюкозидазы и др.). В результате слияния лизосом и фагосом формируется фаголизосома, в которой происходит окончательная деградация компонентов чужеродного объекта. При этом гибнут и сами фагоциты. Продукты их разрушения стимулируют процессы пролиферации.
Источник: studopedia.su