Сегрегация хромосом
СЕГРЕГАЦИЯ в биологии (позднелат. segregatio отделение) — выделение (выщепление) каких-либо новых структурных единиц живой материи (биоценозов, видов, подвидов, популяций, клеток, ядер, хромосом, генов и др.) в процессе ее развития. Процессы С. лежат в основе эволюции органического мира и протекают в течение длительного времени. В процессе онтогенеза (см.) происходит цитоплазматическая С., приводящая к появлению различий в хим. составе и свойствах разных участков цитоплазмы оплодотворенного яйца, различных групп клеток эмбриона, клеток растущего и стареющего организма, что является основой клеточной дифференцировки и морфогенеза у зародыша (см.), а также развития организма (см.) в постэмбриональном периоде.
В генетике (см.) и молекулярной биологии (см.) С. принято называть процесс распределения (расхождения) элементов генетического материала (хроматид, гомологичных хромосом, генов, молекул ДНК) в дочерние клетки. В результате митотического деления соматических клеток многоклеточных организмов (см.
тоз) происходит контролируемая генетически С. хроматид каждой из хромосом, т. е. так наз. соматическая С., к-рая приводит к точному распределению в дочерние клетки двух копий генетического материала материнской хромосомы (см.). При гибридизации соматических клеток происходит постепенная утрата части хромосом, что получило название сегрегации геномов. Образование половых клеток (гамет) связано с С. гомологичных (парных) хромосом диплоидной материнской клетки в процессе мейоза (см.). Случайное объединение генетического материала гаплоидных гамет при оплодотворении (см.) приводит к независимой С. генов родительских организмов и С. соответствующих признаков у потомства (см. Менделя законы).
У прокариотов (напр., у бактерий) механизмы С. генетического материала существенно отличаются от типичных механизмов митоза и мейоза высших организмов. Процесс репликации бактериальной хромосомы (см. Репликация) связан, вероятно, с ее прикреплением к определенному участку клеточной мембраны. Предполагают, что С. реплицированных цепей ДНК хромосомы происходит за счет роста участка клеточной мембраны, к к-рому она прикреплена, что приводит к «раздвиганию» двух копий генетического материала и попаданию их в дочерние клетки. В процессе обмена генетическим материалом у бактерий обычно формируются частично диплоидные зиготы (см. Конъюгация у бактерий). Последующая рекомбинация эндогенного и экзогенного участков генетического материала (см. Рекомбинация) в таких зиготах сопровождается С.
их участков, приводящей к образованию гаплоидных рекомбинантов (сегрегантов). С. генетического материала бактерий играет также важную роль в механизме проявления рецессивных мутаций (см. Мутация). В связи с тем, что каждая бактериальная клетка в фазе экспоненциального роста (см. Бактерии) обычно содержит несколько одинаковых нуклеоидов (гомологичных хромосом), рецессивная мутация в гене одной из таких хромосом не может получить немедленное фенотипическое проявление (рис.). Однако в результате двух последующих клеточных делений возможна С. хромосомных копий, несущих доминантные и рецессивные аллели данного гена в различные дочерние клетки, что приводит к С. рецессивного признака и возможности его фенотипического проявления.
Выяснение механизмов С. различных таксономических групп живых организмов (популяций, подвидов, видов и др.) важно для понимания общих проблем эволюции органического мира (см. Эволюционное учение) и для решения ряда практических задач биологии и медицины (вопросы охраны окружающей среды, проблемы эволюции возбудителей инфекционных и паразитарных заболеваний и др.). Сведения о конкретных генетических механизмах цитоплазматической С. в процессе онтогенеза человека и причинах их нарушения исключительно важны для правильного понимания сущности различных аномалий развития, злокачественного роста, преждевременного старения и других явлений, связанных с нарушением нормальных процессов дифференцировки, пролиферации, миграции, интеграции и гибели клеток, а также при планировании леч.
роприятий для исправления таких нарушений. Различные факторы, приводящие к нарушению нормальной С. гомологичных хромосом при гаметогенезе, являются причиной возникновения хромосомных болезней (см.) человека. С. генов лежит в основе С. патол. признаков, наследующихся в ряду поколений определенной семьи. Именно на изучении С. генов основан анализ родословных (см. Генеалогический метод) при наследственных болезнях (см.), их диагностике и медико-генетическом консультировании (см. Медико-генетическая консультация). Явление С. геномов в потомстве межродовых гибридов соматических клеток широко используется при картировании генов человека. Данные о механизмах С. генетического материала в случаях генетического обмена и мутагенеза у бактерий представляют интерес при анализе путей распространения генов и плазмид (см.), контролирующих лекарственную устойчивость микроорганизмов (см.), их вирулентные и другие свойства в популяциях патогенных и условно патогенных бактерий, при анализе формирования атипичных форм этих организмов и др.
Библиография: Бочков Н. П. Генетика человека, М., 1978; Дэвидсон Э. Действие генов в раннем развитии, пер. с англ., М., 1972; Зуссман М. Биология развития, пер. с англ., М., 1977; Майр Э. Популяции, виды и эволюция, пер. с англ., М., 1974; Физиологическая генетика, под ред. М. Е. Лобашева и С. Г. Инге-Вечтомова, Д., 1976; X э й с У. Генетика бактерий и бактериофагов, пер. с англ., М., 1965.
В. П.Щипков.
Источник: xn--90aw5c.xn--c1avg
Актуальность. Эмбриональные стволовые (ЭС) клетки обладают плюрипотентными и даже тотипотентными свойствами, которые сохраняются при длительном культивировании in vitro (Hogan et al., 1994; Smith, 2001; Carpenter et al., 2003; Ginis et al., 2003; Hubner et al., 2003; Toyooka et al., 2003; Geijsen et al., 2004). При комбинировании ЭС клеток с эмбрионами ранних стадий развития, ЭС клетки способны участвовать в формировании химер, причем вклад ЭС клеток прослеживается во всех соматических тканях и в зародышевом пути (Robertson et al., 1986; Allan, 1987; Robertson, 1987; Joyner, 1993; Hogan et al., 1994).
В 1996 году впервые была предпринята попытка использовать ЭС клетки для репрограммирования генома дифференцированных клеток. С этой целью плюрипотентные ЭС клетки мыши были слиты со спленоцитами взрослого животного. Полученные в этом эксперименте клеточные гибриды обладали плюрипотентными свойствами, сопоставимыми с ЭС клетками (Матвеева и др., 1996; Matveeva et al., 1998). Позднее эти данные получили подтверждение при анализе гибридов, полученных от слияния ЭС клеток с тимоцитами (Tada et al., 2001; 2003) или незрелыми клетками-предшественниками гемопоэза или нейрогенеза (Terada et al., 2002; Ying et al., 2002). В недавно опубликованных данных по анализу гибридных клеток, полученных слиянием ЭС клеток человека с человеческими фибробластами, также отмечается высокий уровень плюрипотентности, сходный с родительскими ЭС клетками (Cowan et al., 2005).
сокий потенциал гибридных клеток типа ЭС-соматическая клетка подразумевает доминирование плюрипотентности — ключевого свойства ЭС клеток. В свою очередь, это предполагает репрограммирование генома соматического партнера. Свидетельства репрограммирования аллелей соматического партнера для целого ряда генов были найдены в гибридах, полученных от слияния ЭС клеток Mus musculus domesticus и тимоцитов M. musculus molossinus (Tada et al., 2001; 2003; Hatano et al., 2005). Прямые доказательства масштабного репрограммирования генома соматического партнера (фибробласта) и связанного с этим изменения профиля экспрессирующихся генов (свыше 99%) по типу ЭС клеток были получены с помощью микрочиповой технологии при анализе гибридов ЭС клеток человека с фибробластами (Cowari et al.,
2005). Сопоставление процессов репрограммирования в ядрах дифференцированных клеток после их переноса в энуклеированный ооцит или яйцо с таковыми в гибридных клетках типа ЭС-соматическая клетка показывает значительное сходство и, следовательно, гибридные клетки являются новым перспективным инструментом изучения фундаментальных проблем репрограммирования и восстановления проспективных потенций генома дифференцированных клеток.
Однако при этом следует особо отметить, что для изучения молекулярных механизмов как поддержания плюрипотентности в гибридном геноме, так и репрограммирования генома соматического партнера необходимо знать хромосомный состав гибридных клеток.
жду тем, до недавнего времени исследованиям этой важной характеристики гибридных клеток типа ЭС-дифференцированная клетка не уделялось должного внимания. В ряде работ по слиянию ЭС и дифференцированных клеток авторы не исследовали кариотип гибридных клеток на том основании, что клетки имели тетраплоидный набор хромосом, что, как полагают авторы, свидетельствует об отсутствии сегрегации хромосом. Так, Тада и соавторы (Tada et al., 2001) описали в клеточных гибридах, полученных от слияния ЭС клеток и тимоцитов, околотетраплоидный набор хромосом, по их мнению, сохранившийся от момента слияния двух диплоидных клеток. Тетраплоидный набор хромосом был обнаружен в гибридных клетках, полученных от спонтанного слияния ЭС клеток со стволовыми клетками костного мозга или недифференцированными клетками головного мозга эмбрионов (Terada et al., 2002; Ying et al., 2002). Однако, согласно более поздним данным Тада и соавторов (Tada et al., 2003), только 62% гибридных клеток, полученных слиянием ЭС клеток мыши с тимоцитами, сохраняли тетраплоидный набор хромосом. Более того, интенсивная сегрегация хромосом была отмечена в гибридных клетках, полученных от слияния ЭС клеток и спленоцитов, в результате чего кариотипы некоторых клонов гибридных клеток содержали околодиплоидный набор хромосом (Matveeva et al., 1998; Матвеева и др., 2001). Сходные данные были получены при исследовании количества хромосом в гибридных клетках, образовавшихся от спонтанного слияния in vivo незрелых клеток-предшественников гемопоэза с клетками печени (Wang et al., 2003).
Следует заметить, что применение цитогенетических методов для идентификации родительских хромосом внутривидовых и межвидовых гибридных клеток (полученных слиянием клеток от близких видов) затруднено или невозможно из-за морфологического сходства гомологичных хромосом. Между тем, дискриминация родительских хромосом возможна с использованием альтернативных методов, например, с помощью микросателлитов в качестве маркеров хромосом. Микросателлиты высокополиморфны у лабораторных линий мышей и равномерно распределены в геноме мыши (Dietrich etal., 1992; 1996). В 1998 году появилась одна из первых работ, в которой микросателлиты использовали для маркирования родительских хромосом у внутривидовых гибридных клеток (Hiñes etal., 1998). Авторы использовали набор микросателлитов, дискриминирующих все гомологичные хромосомы, представленные в геноме гибридных клеток от разных линий мышей. Анализ микросателлитов позволил выявить направленность сегрегации в зависимости от фенотипа гибридов.
При образовании гибридных клеток происходит объединение не только ядерных геномов, но и цитоплазмы родительских клеток. Как отмечалось выше, имеются противоречивые и неполные данные о судьбе родительских хромосом в геноме гибридной клетки. В то же время, сведения об организации гибридной цитоплазмы практически полностью отсутствуют. Учитывая способность митохондриальной ДНК (мтДНК) к репликации, представляется актуальным изучение взаимоотношений родительских митохондриальных геномов в гибридной цитоплазме, что может пролить свет на ее организацию.
едует также отметить, что, согласно некоторым данным, существует взаимосвязь между сегрегацией хромосом и митохондрий. Так, в гибридных клетках от слияния между клетками человека и мыши происходит сегрегация митохондрий того партнера, чьи хромосомы теряются (Francesco etal., 1980). Гибридные клетки от слияния клеток мыши и китайского хомячка, а также мыши и крысы, сохраняли как хромосомы, так и митохондрии обоих партнеров (Hayashi etal., 1982; Zuckerman etal., 1984). В настоящее время отсутствуют данные о судьбе родительских митохондрий как во внутривидовых, так и межвидовых гибридных клетках, полученных от слияния диплоидных ЭС клеток с диплоидными дифференцированными клетками.
В свете выше изложенного, не вызывает сомнений актуальность изучения судьбы родительских хромосом в геноме гибридных клеток типа ЭС-дифференцированная клетка, полученных от слияния диплоидных клеток разных линий мышей или близких видов, с использованием микросателлитов, позволяющих дискриминировать родительские гомологи. Представляется не менее актуальным изучение поведения родительских митохондрий в цитоплазме гибридных клеток для установления причинно-следственных связей между формированием генома гибридной клетки и ее цитоплазмы. Знание о реальном соотношении родительских хромосом в ядерном геноме и о взаимоотношениях родительских митохондриальных геномов в цитоплазме необходимо при исследовании как плюрипотентности генома гибридных клеток, так и для понимания механизмов репрограммирования генома дифференцированных клеток.
Цели и задачи исследования
При выполнении работы преследовали две цели: 1) описать с помощью микросателлитов поведение родительских хромосом в гибридных клетках, полученных слиянием ЭС клеток М. musculus линии 129/01а со спленоцитами или эмбриональными фибробластами мышей линии DD/c, и в наборе клонов межвидовых гибридных клеток, полученных слиянием ЭС клеток М. musculus со спленоцитами М. caroli; 2) исследовать судьбу родительских митохондрий в цитоплазме внутри- и межвидовых гибридных клеток, используя анализ полиморфных районов родительских мтДНК.
Для достижения этих целей были поставлены следующие экспериментальные задачи:
1. Провести поиск полиморфных микросателлитов, способных дискриминировать каждую пару родительских хромосом у мышей линий 129/01а и DD/c (доноры ЭС клеток, спленоцитов и эмбриональных фибробластов) и у мышей линии 129/Ola М. musculus и азиатской мыши М. caroli (доноры ЭС клеток и спленоцитов, соответственно). Оптимизировать условия полимеразной цепной реакции (ПЦР) для анализа аллельных вариантов микросателлитов и оценить чувствительность метода путем анализа искусственной смеси геномной ДНК мышей М. musculus линии 129/01а и М. caroli.
2. Провести анализ микросателлитов, маркирующих каждую пару родительских хромосом, в 3-х клонах серии HESS, полученных от слияния ЭС клеток мышей 129/Ola и спленоцитов взрослой мыши DD/c, и в 5-ти клонах серии HESF, полученных от слияния ЭС клеток и эмбриональных фибробластов мышей DD/c, с целью описания их хромосомного состава.
3. Провести анализ микросателлитов, маркирующих каждую пару родительских хромосом, в 20-ти клонах серии НМС, полученных от слияния ЭС клеток М. musculus и спленоцитов азиатской мыши М. caroli, с целью описания их хромосомного состава.
4. Провести секвенирование D-петли, генов третьей субъединицы цитохромоксидазы, третьей и шестой субъединиц НАД-Н дегидрогеназы мтДНК у мышей линий 129/01а и DD/c с целью выявления нуклеотидных замещений, позволяющих дискриминировать их мтДНК.
5. Исследовать родительское происхождение мтДНК в 3-х клонах серии HESS, 5-ти клонах серии HESF и в 20-ти клонах серии НМС. Провести анализ мтДНК индивидуальных клеток в некоторых гибридных клонах для оценки межклональной вариабельности.
Научная новизна и практическая значимость
1. В работе впервые подробно детализированы условия применения полиморфных микросателлитов в качестве маркеров родительских хромосом в меж- и внутривидовых гибридных клетках, полученных слиянием диплоидных ЭС клеток со спленоцитами и эмбриональными фибробластами. Предлагаемый подход имеет хорошую воспроизводимость, менее трудоемок, чем цитогенетический анализ, и позволяет провести быструю оценку хромосомного состава гибридных клеток.
2. С помощью анализа микросателлитов впервые выявлено сохранение всех хромосом плюрипотентного и практически всех соматического партнера, за исключением хромосомы 14, во внутривидовых гибридных клетках — мыши, полученных слиянием ЭС клеток с фибробластами, в противоположность выраженной потере соматических хромосом в гибридных клетках типа ЭС-спленоцит. Важно подчеркнуть, что выявление такой сегрегации хромосом у внутривидовых гибридных клеток с помощью традиционных цитогенетических методов возможно лишь для единичных хромосом.
3. С помощью анализа мтДНК впервые показана предпочтительная сегрегация митохондрий соматического партнера в гибридных клетках, полученных слиянием
ЭС клеток со спленоцитами другой линии мышей и спленоцитами близкого вида, М. сагоИ.
Описанную сегрегацию родительских хромосом и митохондрий соматического партнера следует учитывать при оценке плюрипотентности гибридных клеток и в экспериментах, связанных с изучением механизмов репрограммирования.
Полученные в ходе данной работы результаты используются при чтении лекций спецкурса «Генетика развития» в Новосибирском государственном университете (НГУ).
Апробация работы и публикации.
Результаты работы были представлены на международной научной студенческой конференции «Студент и научно-технический прогресс» (Новосибирск, 2002), на интеграционной междисциплинарной конференции молодых ученых СО РАН и высшей школы (Иркутск, 2003), на международной научной конференции молодых ученых и студентов (Алматы, 2003), на 1-м съезде Общества клеточной биологии (Санкт-Петербург, 2003), на международном симпозиуме «Стволовые клетки, регенерация, клеточная терапия» (Санкт-Петербург, 2004), на 3-ем съезде ВОГиС (Москва, 2004), на школе-конференции «Актуальные проблемы биологии развития и биотехнологии» (Москва, 2005), на VI международной конференции по молекулярной генетике соматических клеток (Москва, 2005).
Материалы диссертации изложены в 2-х статьях, опубликованных в отечественном и международном журналах.
Структура и объем работы. Диссертация состоит из введения, 4-х глав, выводов и списка литературы. Работа изложена на 103-х страницах, иллюстрирована 11-ю рисунками и содержит 13 таблиц.
Источник: www.dissercat.com
Расположение
Центромер не всегда расположен в центральной области хромосомы (см. фото выше). Хромосома состоит из короткого плеча (p) и длинного плеча (q), которые соединяются в центромерной области. Центромеры могут находиться, как вблизи середины, так и в нескольких положениях вдоль хромосомы. Метацентрические центромеры расположены вблизи центра хромосом. Субметацентрические центромеры смещены в одну сторону от центра, так что одно плече длиннее другого. Акроцентрические центромеры расположены вблизи конца хромосомы, а телоцентрические центромеры находятся на конце или в области теломер хромосомы.
Положение центромера легко обнаруживается в кариотипе человека гомологичных хромосом. Хромосома 1 является примером метацентрической центромеры, хромосома 5 является примером субметацентрической центромеры, а хромосома 13 является примером центромера акроцентрика.
Расхождение хромосом в митозе
До начала митоза клетка входит в стадию, известную как интерфаза, где она реплицирует свою ДНК при подготовке к делению клеток. Образуются сестринские хроматиды, которые соединены в их центромерах.
В профазе митоза специализированные области на центромерах, называемые кинетохорами, прикрепляют хромосомы к веретенообразным волокнам. Кинетохоры состоят из ряда белковых комплексов, которые генерируют кинетохорные волокна, прикрепляющиеся к веретену делния. Эти волокна помогают манипулировать и разделять хромосомы во время деления клеток.
На стадии метафазы хромосомы удерживаются на метафазной пластине равными силами полярных волокон, нажимая на центромеры.
Во время анафазы парные центромеры в каждой отдельной хромосоме начинают расходится друг от друга, так как дочерние хромосомы сначала центрируются относительно противоположных полюсов клетки.
Во время телофазы новообразованные клеточные ядра включают отдельные дочерние хромосомы. После цитокинеза образуются две разные диплоидные клетки.
Расхождение хромосом в мейозе
В мейозе клетка проходит через две стадии процесса деления (мейоз I и мейоз II). Во время метафазы I центромеры гомологичных хромосом ориентированы на противоположные полюсы клеток. Это означает, что гомологичные хромосомы будут прикрепляться в своих центромерных областях к волокнам веретена деления, простирающимся только от одного из двух полюсов клетки.
Когда волокна веретена сокращаются во время анафазы I, гомологичные хромосомы вытягиваются к противоположным полюсам клеток, но сестринские хроматиды остаются вместе. В мейозе II волокна веретена, простирающиеся от обоих полюсов клеток, прикрепляются к сестринским хроматидам в их центромерах. Сестринские хроматиды разделяются в анафазе II, когда волокна веретена тянут их к противоположным полюсам. Мейоз приводит к разделению и распределению хромосом среди четырех новых дочерних клеток. Каждая клетка гаплоидна, содержащая только половину числа хромосом от исходной клетки.
Источник: natworld.info
План
6.1 Репликация ДНК
6.2 Клеточное деление у бактерии
6.3 Деление клеток и ядер у эукариот
Предпосылкой для сохранения имеющейся наследственной информации в ряду последовательных поколений клеток и организмов является идентичное удвоение, или репликация, генетического материала. Репликация ДНК происходит перед каждым нормальным делением ДНК-содержащих структур (ядер, пластид и митохондрий) у эукариот, перед каждым делением бактериальных клеток и при размножении ДНК-вирусов.
Затем удвоенная ДНК в процессе сегрегации распределяется поровну между двумя дочерними клеточными ядрами или «бактериальными клетками». Правильное распределение удвоенной наследственной информации для сохранения вида так же важно, как и идентичная репликация. У эукариот сегрегация происходит в результате двух форм деления клеточного ядра – митоза и мейоза, а у бактерий – при делении клетки.
6.1 Репликация ДНК
Репликация ДНК происходит так называемым полуконсервативным способом: на каждой цепи старой молекулы образуется новая, комплементарная цепь (рис. 6.1). В качестве элементарных блоков для построения новой ДНК в клетке синтезируются трифосфаты четырех дезоксирибонуклеозидов – dG, dC, dT и dA. В качестве матрицы («шаблона») для синтеза ДНК служит имеющаяся видоспецифичная двухцепочечная молекула ДНК. К обеим цепям пристраиваются комплементарные нуклеозидтрифосфаты (dNTP) по принципу спаривания оснований; с помощью полимераз они связываются в новую нуклеотидную цепь, причем от каждого из них отщепляется пирофосфат (рис. 6.2).
 |
Рис. 6.1. Теоретически вероятные механизмы репликации
(—–– – нити материнской ДНК, — — — – вновь синтезированные нити ДНК)
 |
|||
| А | Б | В | Г |
Рис. 6.2. Репликация ДНК. А. Исходная молекула ДНК. Б. Репликация в результате спаривания комплементарных оснований и образования полинуклеотидной цепи при участии полимеразы. В. Связывание фрагментов Оказаки лигазой. Г. Две дочерние молекулы ДНК – результат полуконсервативной репликации
При репликации из одной молекулы двухцепочечной ДНК образуются две молекулы, идентичные друг другу и исходной молекуле. Это служит предпосылкой сохранения видоспецифической наследственной информации в ряду поколений клеток и организмов, предпосылкой значительного постоянства видов.
Репликация бактериальных геномов и других кольцевых молекул ДНК начинается в определенной, генетически фиксированной «точке старта». В хромосомах эукариот имеется по нескольку таких начальных точек.
Репликация ДНК происходит по частям. Реплицированные последовательности из 1000-2000 нуклеотидов называют фрагментами Оказаки. На обеих старых цепях новаяполинуклеотидная цепь синтезируется в направлении 5’→3′ (рис. 6.2, В). Начинаясь от точки старта, репликация осуществляется последовательно на отдельных участках; при этом у эукариот и многих бактерий она идет вдоль двойной спирали ДНК не только в одном направлении, но и в противоположном. ДНК-полимеразы могут присоединять нуклеотиды только к свободному 3′-ОН-концу нуклеотида, уже связанного со старой цепью ДНК. Только РНК-полимеразы в состоянии связать первый нуклеотид с ДНК и начать новую полинуклеотидную цепь. Поэтому для того, чтобы мог синтезироваться фрагмент Оказаки, сначала должен быть пристроен короткий отрезок РНК (как при транскрипции). Эта последовательность РНК из 1-10, реже около 50 нуклеотидов называется затравкой (или праймером) и синтезируется РНК-полимеразой, или примазой. От 3′-конца затравки с помощью ДНК-полимеразы IIIначинается синтез ДНК-фрагмента Оказаки, продолжающийся до конца данного фрагмента. Следующий фрагмент Оказаки опять начинается с РНК-затравки. ДНК-полимераза I удаляет затравки, а пропуски заполняются путем синтеза цепи ДНК (как при репарации с удалением участка), присоединяемой к предыдущему фрагменту Оказаки. Затем фермент лигаза связывает между собой синтезированные отрезки ДНК.
Для репликации двойная спираль ДНК раскручивается ферментами. Репликация на старой цепи, идущей от точки старта в направлении 3’→5′ (правая цепь на рис. 6.2), может идти непрерывно вдоль двойной спирали, раскрывающейся подобно застежке-молнии. Репликация на другой цепи происходит отдельными фрагментами, так как на этой цепи новая цепь должна синтезироваться в противоположном направлении (тоже соответствующем направлению 3′ → 5′ старой цепи).
Спаривание оснований при участии ДНК-полимеразы происходит почти безошибочно. Перед связыванием нового нуклеотида дополнительно проверяется, правильным ли было предыдущее спаривание. Если оно было ошибочным, неподходящий нуклеотид удаляется благодаря 3’→5′-эндонуклеазной активности полимеразы.
При репликации бактериальных ДНК и других кольцевых ДНК-структур в конечном итоге получаются две идентичные кольцевые молекулы ДНК. У эукариот различные репликационные участки хромосомы в конце концов объединяются (рис. 6.3), так что после завершения фазы S в каждой хромосоме находятся две молекулы двухцепочечной ДНК, которые становятся двумя идентичными хроматидами.

Рис. 6.3. Репликация ДНК.Отрезок эукариотической хромосомы с несколькими стартовыми пунктами
Структура, способная к репликации (например, хромосома, плазмида, вирусный геном), называется репликоном. Только структуры со свойствами репликона могут сохраняться в ряду поколений, т.е. наследоваться. ДНК способна к репликации благодаря наличию специфического участка, который может служить стартовым пунктом для репликации. Наименьшие встречающиеся в природе репликоны – это мелкие плазмиды. Для инициации процесса репликации необходимы только 436 нуклеотидов. Их последовательность установлена. Кроме этой начальной последовательности нужен еще участок, кодирующий структуру белка, который распознает эту последовательность.
У эукариот репликация ДНК происходит в интерфазе. У бактерий репликация ДНК начинается в условиях, благоприятных для роста (причем несколько циклов репликации один за другим).
6.2 Клеточное деление у бактерии
После того как из генома в результате идентичной репликации образуются две двухцепочечные молекулы ДНК (плазмиды, если они есть, тоже удваиваются), эти дочерние молекулы ДНК располагаются так, чтобы при клеточном делении они могли разойтись в две дочерние клетки. Последние будут, таким образом, содержать полный геном. Плазмиды тоже распределяются так, что каждая клетка получает по меньшей мере одну из них.
6.3 Деление клеток и ядер у эукариот
6.3.1 Деление соматических клеток
Интерфазой называют период между двумя делениями ядра. Ее подразделяют на фазы G1 S и G2. S – это фаза синтеза ДНК, фазы G (от англ. gap – промежуток) – это фазы до (G1) и после (G2) синтеза ДНК- Только в G1 интерфазная клетка содержит характерное для данного вида количество ДНК; в G2 это количество уже удвоено (рис. 6.4).
| А |  |
|||
| Б | ||||
| В |
|
|||
| Профаза Метафаза Анафаза Телофаза |
Рис. 6.4. Репликация и распределение ДНК У эукариот. А. Схема митоза.
Б.Репликация и разделение ДНК в хромосоме. В. Процесс митоза
В митозе (непрямом делении ядра, кариокинезе) происходит упорядоченное распределение ДНК между дочерними ядрами (рис. 6.4). В процессе митоза из одного ядра с определенным числом хромосом образуются два дочерних ядра с тем же числом хромосом каждое. После того как в фазе S ДНК реплицируется, каждая хромосома содержит две идентичные молекулы ДНК, которые вместе с белками становятся хроматидами – двумя половинками одной продольно расщепленной хромосомы. Митоз приводит к тому, что ядро каждой из дочерних клеток содержит по одной такой хроматиде (половинке каждой удвоенной хромосомы).
Чтобы это распределение было возможным, хромосомы в профазе сильно укорачиваются. К концу профазы ядерная оболочка растворяется. Образуется аппарат веретена деления с двумя полюсами. В метафазе хромосомы располагаются в экваториальной плоскости веретена. В каждой хромосоме видны две хроматиды, которые скреплены между собой центромерой. К каждой хроматиде прикреплены нити веретена деления (к хроматидам одной хромосомы – от противоположных полюсов). В анафазе хроматиды разъединяются и расходятся, начиная с области центромеры, к полюсам. В ходе анафазы и телофазы эти новые хромосомы опять удлиняются. В телофазе вокруг находящихся на каждом полюсе хромосом образуется ядерная оболочка.
Если имеется центриоль, то она делится в начале митоза. Цитокинез (деление клетки) в животных клетках происходит путем образования перетяжки таким образом, что в каждой половинке оказывается по одному ядру. У большинства высших растений в экваториальной плоскости, начиная с середины клетки, образуется примордиальная стенка, которая затем расширяется по направлению к периферии. У некоторых растений образование клеточной стенки идет в противоположном направлении. Элементы цитоплазмы распределяются случайным образом.
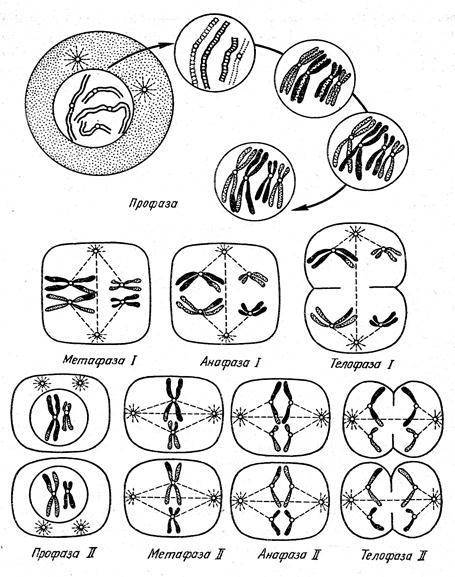
6.3.2 Мейоз (редукционное деление)
При мейозе диплоидное число хромосом уменьшается до гаплоидного (рис. 6.5). Расхождение гомологичных хромосом происходит так, что каждая дочерняя клетка получает по одной хромосоме из каждой пары.
Чтобы могло произойти такое распределение, гомологичные хромосомы в профазе I соединяются попарно и в метафазе I располагаются в экваториальной плоскости. В анафазе I гомологичные хромосомы разделяются и расходятся к противоположным полюсам. В результате диплоидный набор хромосом уменьшается до гаплоидного. Если исходная клетка содержит, например, 6 хромосом (2n), то после редукционного деления клетки получаются две клетки с 3 хромосомами (n) каждая
Сразу же после первого деления мейоза (редукционного) совершается еще второе деление – обычный митоз.
Перед мейозом I в фазе S, как и при митозе, происходит репликация ДНК. В профазе I в спаренных гомологичных хромосомах уже образовалось по две хроматиды, соединенных в области центромеры. На этой четыреххроматидной стадии путем кроссинговера (перекреста) может происходить обмен участками хроматид (рис. 6.5, Б). При этом в каждой из двух гомологичных хромосом в гомологичной области разрывается одна хроматида и образовавшиеся фрагменты воссоединяются крест-накрест – возникает хиазма. Эти места перекреста смещаются к концам хромосом (терминализация), и хромосомы не разделяются в этих участках до конца метафазы I. Кроссинговер делает возможным обмен участками хроматид и тем самым – внутрихромосомную рекомбинацию.


Рис. 6.5. Мейоз. А. Схема. Б. В. Кроссинговер.
Таким образом, в мейозе можно выделить следующие стадии (рис. 6.6):
1. Мейоз I:
– профаза I (начало укорочения хромосом, спаривание, или конъюгация гомологичных хромосом, укорочение спаренных хромосом и кроссинговер, частичное разделение пар, начало терминализации хиазм);
– метафаза I (растворение ядерной оболочки, расположение спаренных хромосом в экваториальной плоскости);
– анафаза I (разделение гомологичных хромосом, начало их удлинения и расхождение к полюсам);
– телофаза I (хромосомы находятся на полюсах).

Рис. 6.6. Основные стадии мейоза
2. Мейоз II включает профазу II, метафазу II, анафазу II и телофазу II.
К концу мейоза II имеются четыре гаплоидных ядра; в результате клеточного деления образуются четыре клетки.
У диплоидных организмов редукционное деление, обусловливающее смену ядерных фаз, осуществляется в различное время перед образованием половых клеток.
Вопросы для самопроверки
1. Каким способом (консервативным или полуконсервативным) осуществляется репликация ДНК?
2. Из каких соединений и по какому принципу строится новая цепь ДНК?
3. В каком направлении строятся новые полинуклеотидные цепи ДНК и какие особенности их построения на материнской цепи 3¢®5¢ и материнской цепи 5¢®3¢?
4. Какие ферменты осуществляют синтез ДНК?
5. Какая частота ошибок при репликации ДНК?
6. В какой фазе интерфазы происходит репликация ДНК?
7. Из каких фаз состоит митоз?
8. Приведите формулу митоза и сравните генотипы материнского и дочерних ядер.
9. Приведите формулу мейоза и сравните генотипы материнского и дочерних ядер.
10. В какой фазе мейоза происходит кроссинговер и к какому виду наследственных изменений он приводит?
Источник: studopedia.org